神经肌电图联合体感诱发电位在糖尿病神经系统并发症评估中的应用
上海中医药大学附属第七人民医院神经内科,上海 200137
糖尿病患者由于长期处于高血糖状态,极易发生神经系统并发症,包括糖尿病周围神经病(diabetic perilpheral neuropathy,DPN) 以及中枢神经系统损害,严重影响其生活质量,并增加残疾率和死亡率。加强对糖尿病患者的神经系统并发症进行早期筛查、预防、诊断和治疗是改善其生活质量和预后的关键[1]。神经肌电图(electromyography,EMG)是筛查和诊断DPN的重要手段。体感诱发电位(somatosensory evoked potential,SEP)可在一定程度上反映特异性躯体感觉传入通路、脑干网状结构及大脑皮质的功能状态[2],常被应用于周围-中枢神经系统损害的评估。本研究对2017年1—12月上海中医药大学附属第七人民医院神经内科收治的接受EMG和SEP检查的糖尿病住院患者的临床资料进行回顾性分析,旨在探讨EMG联合SEP检查在评估DPN以及中枢神经系统损害中的价值。
1 资料与方法
1.1 病例选择标准
病例纳入标准:(1)明确诊断为2型糖尿病,诊断标准参照《中国2型糖尿病防治指南(2013年版)》[3];(2)在上海中医药大学附属第七人民医院神经内科接受住院治疗。
病例排除标准:患有颈椎病、腰椎病变、肿瘤、外伤、营养缺乏、中毒、自身免疫性疾病、肝肾功能异常、甲状腺功能减退、感染性疾病、吉兰-巴雷综合征、单神经炎、多颅神经炎、多发性硬化等疾病。
1.2 分组
按糖尿病病程(<1年、1~10年、>10年)、有无DPN(DPN的诊断按照《糖尿病周围神经病诊断和治疗共识》[4])症状及体征、是否伴发缺血性卒中(缺血性卒中的诊断按照《中国急性缺血性脑卒中诊治指南2014》[5])以及脑卒中部位进行分组。
1.3 EMG
应用丹麦丹迪KEYPOINT全功能肌电诱发电位仪进行检查。在检查过程中,保持室内安静状态,室温维持于19~26 ℃,患者皮肤温度维持于 29 ℃。
EMG检查部位:尺神经、腓浅神经、腓总神经、正中神经;检查项目:感觉神经传导速度(sensory nerve conduction velocity,SCV)、运动神经传导速度(motor nerve conduction velocity,MCV)、正中神经F波、胫神经F波、尺神经F波。
1.4 SEP
头皮脑电图记录采用国际10-20系统确定电极的安放位置,其中头部记录电极置于C3’或C4’点,参考电极置于Fz点。刺激正中神经和胫神经,观察记录N20和P40潜伏期及波形。
1.5 观察指标
收集患者的一般资料以及EMG和SEP检查数据。EMG和SEP检查指标的正常值X参照汤晓芙《临床肌电图学》[6],以MCV<X-2.5 ms、SCV<X-2.5 ms为异常;波幅<X×50%、潜伏期>X+2.5 ms、F波出现率<50%为异常[7]。尺神经、腓浅神经、腓总神经和正中神经SCV和MCV检查时,只要任何一个检查部位出现波幅降低、潜伏期延长、SCV或MCV减慢中的任一项,即被视为神经传导速度(nerve conduction velocity,NCV)异常。F波最短潜伏期延长和(或)出现率降低均被视为F波异常。SEP检查时刺激正中神经和胫神经,如果出现N20和(或)P40潜伏期延长和(或)波幅降低,均被视为SEP异常。
1.6 统计学方法
2 结 果
2.1 一般资料
2017年1—2017年12月上海中医药大学附属第七人民医院神经内科共收治135例符合病例选择标准的糖尿病患者。在这135例糖尿病患者中,根据《糖尿病周围神经病诊断和治疗共识》[4]明确诊断为DPN者50例(37.0%),诊断为亚临床DPN者33例(24.4%);伴发缺血性卒中者32例(23.7%);EMG发现神经传导速度(nerve conduction velocity,NCV)异常 56 例(41.5%),F波异常16例(11.9%);SEP异常27例(20.0%)。
2.2 糖尿病病程与神经系统并发症评估指标的关系
按糖尿病病程进行分组:40例<1年,50例为1~10年,45例>10年。3组患者的年 龄(P< 0.01)、NCV异 常 率(P< 0.01)、DPN比例(P=0.03)及缺血性卒中比例(P=0.03)的差异均有统计学意义(表1);糖尿病病程1~10年组和>10年组患者的NCV异常率、DPN比例及缺血性卒中比例均显著高于糖尿病病程<1年组。
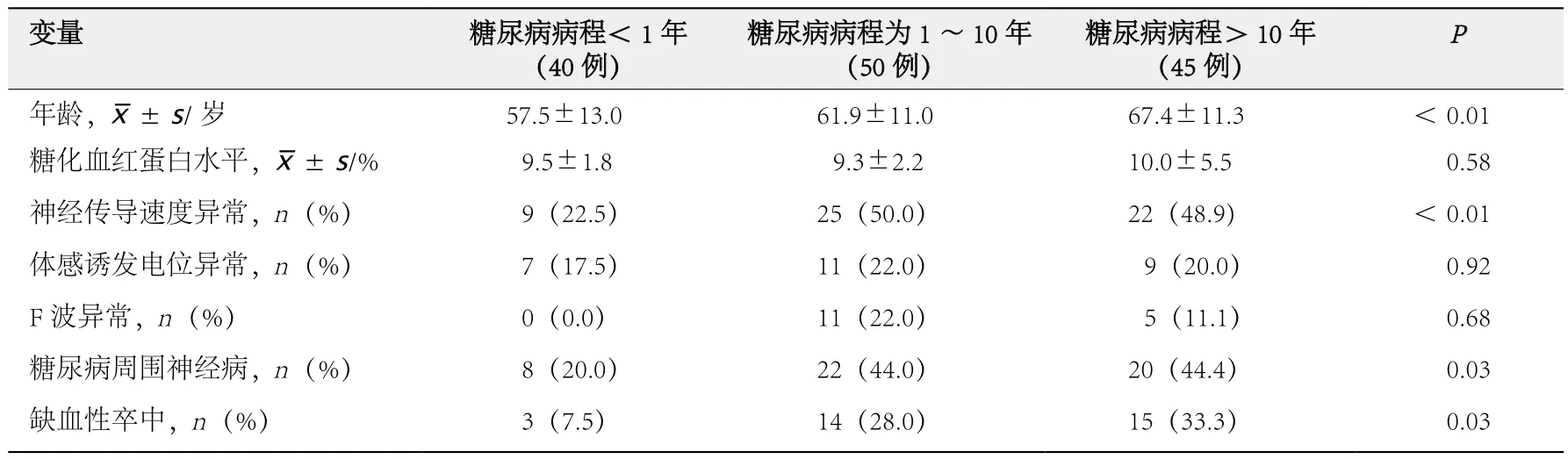
表1 糖尿病病程与神经系统并发症评估指标的关系
3组患者的糖化血红蛋白水平、F波异常率和SEP异常率的差异均无统计学意义(P>0.05,表1)。
Spearman相关分析结果显示,NCV异常(r=0.26,P<0.01)和缺血性卒中(r=0.22,P<0.01)与病程呈正相关;DPN与病程(r=0.21,P<0.05)、年龄(r=0.19,P<0.05)、糖化血红蛋白水平(r=0.24,P< 0.01)、NCV 异常(r= 0.75,P< 0.01)和F波异常(r=0.22,P<0.01)均呈正相关;NCV异常与F波异常呈正相关(r=0.34,P<0.01);NCV异常(r=0.28,P<0.01)和F波异常(r=0.30,P<0.01)均与糖化血红蛋白水平呈正相关;SEP异常与F波异常(r=0.62,P<0.01)和缺血性卒中(r=0.20,P<0.05)均呈正相关。
2.3 有无DPN症状及体征与神经系统并发症评估指标的关系
在剔除32例伴发缺血性卒中患者后,按有无DPN症状及体征对剩余103例糖尿病患者进行分组:10例(9.7%)有DPN症状及体征(占50例DPN患者的20.0%),93例(90.3%)无DPN症状及体征。
在有DPN症状及体征的10例患者中,NCV异常者9例(90.0%),F波异常和SEP异常者各4例(40.0%)。有DPN症状及体征患者的NCV异常率(P<0.01)、F波异常率(P<0.01)和SEP异常率(P<0.01)均显著高于无DPN症状及体征患者(表2)。
2.4 有无伴发缺血性卒中与神经系统并发症评估指标的关系
135例糖尿病患者中,伴发缺血性卒中者32例,其中急性期(缺血性卒中病程<2周)25例、恢复期(缺血性卒中病程为2周~1年)4例,后遗症期(缺血性卒中病程>1年)3例。

表2 有无糖尿病周围神经病症状及体征与神经系统并发症评估指标的关系
伴发缺血性卒中的糖尿病患者与未伴发缺血性卒中的糖尿病患者相比,前者的年龄较大(P<0.01)、病程较长(P=0.01)、SEP异常率较高(P=0.02),但糖化血红蛋白水平、NCV异常率以及F波异常率差异均无统计学意义(P>0.05),见表3。
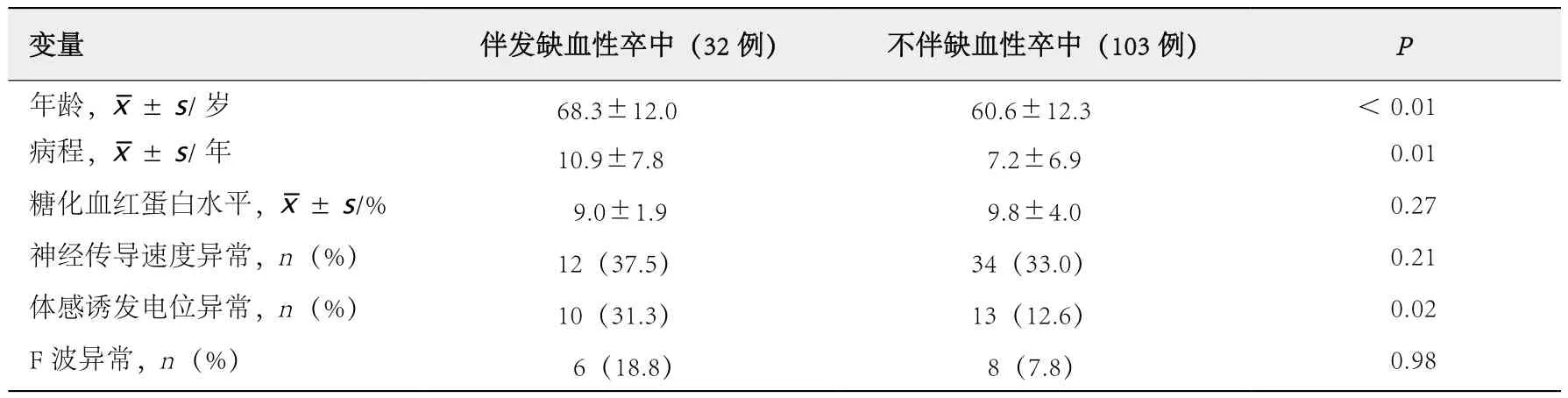
表3 有无伴发缺血性卒中与神经系统并发症评估指标的关系
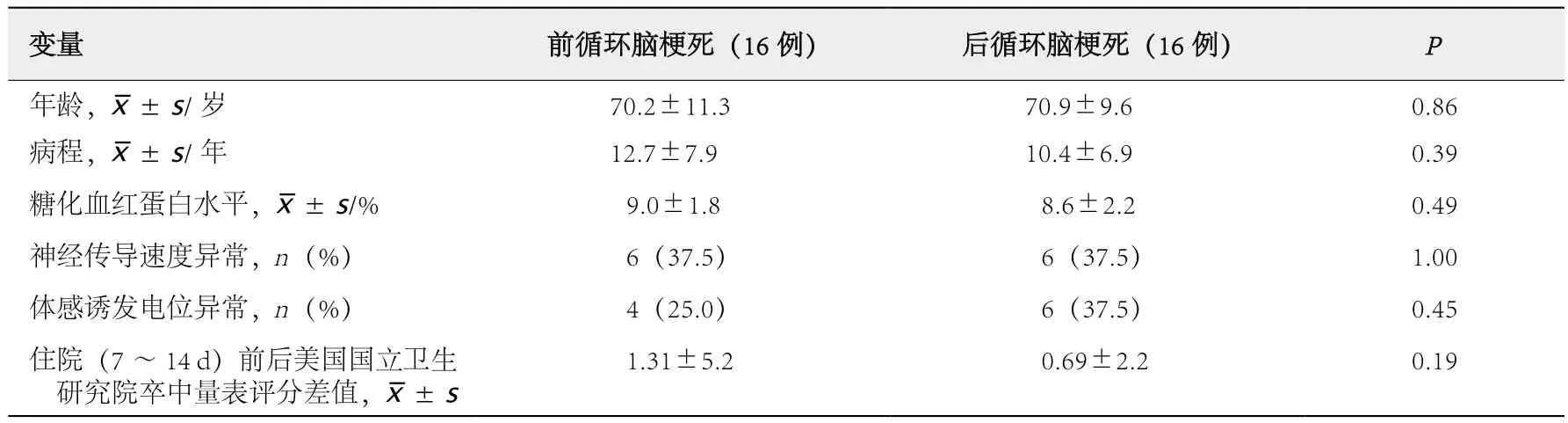
表4 脑梗死部位与神经系统并发症评估指标的关系
2.4 脑梗死部位与神经系统并发症评估指标的关系
32例伴发缺血性卒中患者按脑梗死部位分组:16例为前循环脑梗死,16例为后循环脑梗死。32例患者中,SEP异常10例(1例前循环脑梗死患者表现为上肢N20潜伏期延长,另9例患者均表现为下肢P40潜伏期延长),其中单侧SEP异常4例、双侧SEP异常6例;NCV异常12例。
前循环脑梗死组与后循环脑梗死组患者的SEP异常率和NCV异常率差异均无统计学意义(P>0.05,表4),病程、年龄、糖化血红蛋白水平和住院(7~14 d)前后美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分差值的差异亦均无统计学意义(P>0.05,表4)。
Spearman相关分析结果显示,SEP异常与住院(7~14 d)前后美国NIHSS评分差值呈正相关(r=0.43,P<0.05)。
3 讨 论
约50%的糖尿病患者可并发DPN[8],并且其发病率随糖尿病病程的延长而增加。本研究中,37.0%的糖尿病患者并发DPN,略低于既往文献[8]报道的结果,推测可能与本研究样本量较小以及存在病例选择偏倚有关。DPN患者在出现临床症状及体征前,其周围神经就已受到一定程度的损害。因此,在糖尿病前期和糖尿病早期就应对患者的周围神经损害进行评估。NCV检查对诊断DPN及评估病情具有一定的敏感度和特异度;而诱发电位F波主要反映近端神经的病变情况,其诊断早期DPN的敏感度亦较高[9]。目前,NCV检查和诱发电位F波检查已被广泛应用于DPN的筛查和诊断。然而,由于NCV检查仅能反映有髓神经纤维的传导情况,因此对糖尿病前期及糖尿病早期末梢神经病变的筛查存在一定的局限[10]。随着神经电生理检查技术的不断发展与完善,皮肤交感反应和感觉定量检查等技术[11]的出现弥补了NCV检查的不足,越来越多的亚临床病例得以发现,为早期诊断和治疗提供了可靠的保障。本研究中,糖尿病病程为1~10年组的NCV异常率为50.0%,>10年组的NCV异常率为48.9%,均显著高于<1年组(22.5%,P<0.01);糖尿病病程为1~10年组以及糖尿病病程>10年组的DPN比例也均高于<1年组(P=0.03);Spearman相关分析发现,DPN、缺血性卒中和NCV异常均与病程呈正相关(P<0.05)。由此提示,随着糖尿病病程的延长,NCV异常、DPN及缺血性卒中均有所增加。此外,NCV异常与F波异常呈正相关(P<0.01),且2者与糖化血红蛋白水平亦呈正相关(P<0.01),此结果符合糖尿病的病理生理学变化。
本研究中,有DPN症状及体征患者的NCV异常率高达90.0%;而在无DPN症状及体征的患者中,NCV异常、SEP异常和F波异常的合并率达53.8%。糖尿病病程<1年组的患者均无DPN症状及体征,但其中有9例(22.5%)为NCV异常,7例(17.5%)为SEP异常,2者的合并率为40.0%。由此可见,对于临床上尚无周围神经并发症表现的糖尿病患者,EMG联合SEP检查可在一定程度上提高早期亚临床DPN的检出率。
糖尿病患者长期处于高血糖状态,可引起脑代谢异常、脑血流量降低、微血管病变、氧化应激损伤等[12],临床上可发现脑白质病变、脑梗死、认知功能减退等中枢性损害。有研究发现,糖尿病患者的中枢神经系统并发症发生率为10.8%~17.5%[13],其中以卒中较为多见。本研究发现,糖尿病伴发缺血性卒中的比例为23.7%,高于文献[13]报道的结果,推测可能与本研究样本量较小以及病例选择偏倚有关。循证证据表明,糖尿病是卒中的独立危险因素,其中88%的糖尿病患者发生脑血栓形成或腔隙性脑梗死,约43%的急性卒中患者存在血糖水平升高,糖尿病与卒中之间关系密切[14]。本研究发现,糖尿病伴发缺血性卒中与患者的年龄(P<0.01)和糖尿病病程(P=0.01)密切相关,提示糖尿病病程较长以及年龄较大均可增加卒中发生率。
SEP主要反映大脑皮质及皮质下躯体深感觉传导通路的功能,SEP各波的产生均与特定部位的神经电活动相关,波形异常可提示受损部位和程度,峰潜伏期和波幅的改变分别反映神经髓鞘及轴突受损情况,具有较高的敏感度,且能够进行定量评价。有研究发现,SEP N20可以作为神经功能损伤的敏感指标[15]。本研究中,SEP异常者共27例,但仅1例表现为上肢N20潜伏期延长,其余26例均表现为P40潜伏期延长,考虑这可能与样本的选择以及糖尿病周围神经损害以下肢为主有关。在伴发缺血性卒中的患者中,10例(31.3%)为SEP异常,显著高于不伴缺血性卒中的患者[13例(12.6%),P=0.02],且SEP异常与缺血性卒中呈正相关(r=0.20,P<0.05)。N20和P40均为皮质诱发电位,皮质及皮质下损害如顶叶、基底节区、脑干或丘脑部位的病变均可引起SEP异常。本研究将伴发缺血性卒中的患者按卒中部位分为前循环组和后循环组,发现2组的SEP异常率和NCV异常率差异均无统计学意义(P>0.05)。SEP异常还与脑梗死病灶大小有关,同一病变部位梗死面积大,越易影响感觉传导通路和感觉中枢,继而导致SEP异常率增加。本研究还发现,SEP异常与住院前后美国NIHSS评分差值呈正相关(r=0.43,P<0.05),NCV异常与糖化血红蛋白水平呈正相关(r=0.28,P<0.01),提示SEP对缺血性卒中患者的神经功能缺损及预后评估均具有一定的价值。由此可见,SEP对DPN以及糖尿病中枢神经损害的诊断有其独特价值,尤其在卒中的早期辅助定位诊断、病情严重程度判断、疗效评价及预后评估中均显示出良好的应用价值[16-17]。
综上所述,神经电生理检查技术被广泛应用于糖尿病神经系统并发症的筛查和诊断,其中EMG是筛查和诊断DPN的重要方法。EMG联合SEP对早期DPN进行筛查和诊断,可以在一定程度上提高亚临床DPN的检出率,实现早期诊断和早期治疗,继而改善患者预后,提高患者生活质量。此外,EMG联合SEP也有助于判断糖尿病伴发中枢性损害的病变。鉴于本研究为回顾性研究,存在一定的局限性,因此有待开展大样本的前瞻性研究以进一步验证EMG联合SEP在糖尿病神经系统并发症评估中的应用价值。

