轻度认知障碍转化为痴呆的临床预测因素
王智樱,徐 群,陈 刚,俞 羚
上海交通大学医学院附属仁济医院神经内科,上海 200127
随着人口的老龄化,轻度认知功能障碍(mild cognitive impairment,MCI)是老年人的一种常见疾病,影响了3%~5%的60岁以上以及15%的75岁以上人群[1],且随着年龄的增长,其发病率逐渐增高。MCI患者往往主诉记忆力下降,但日常生活能力正常,且认知心理相关测试结果也无明显异常。阿尔茨海默病(Alzheimer’s disease,AD)是老年人最常见的痴呆类型,占全部痴呆的50%~60%。MCI是一种介于正常老化与痴呆之间的状态,目前普遍认为MCI患者是痴呆的高危人群,具有高度进展为AD的风险[1]。既往的纵向随访研究发现,部分MCI患者脑内可能已经存在AD相关的病理改变,这部分MCI患者发展为AD的风险较高;但仍有相当一部分比例的MCI患者虽然存在焦虑、抑郁症状,却没有AD相关的病理改变[2],也不一定发展为痴呆。因此,如何预测MCI转化为痴呆具有重要的临床意义,可以对痴呆高风险人群进行早期干预和治疗。BRUEGGEN等[3]研究提示,海马、基底前核和其他相关区域的体积缩小使MCI转化为AD的风险增加。李瑜霞等[4]研究提示,除海马外,顶下小叶、楔前叶等脑区灰质体积缩小也可能是预测MCI向AD转化的结构影像学标志物。一项2016年的Meta分析[5]显示,抑郁情绪增加了MCI患者进展为AD痴呆的风险。CONTI等[6]研究了88例MCI患者和46例正常对照者,发现基线嗅觉检测有助于早期预测MCI转化为痴呆。有影像学研究显示,嗅觉障碍与严重的脑白质病变存在明显的相关性,可作为MCI转变为痴呆的预测因素[7]。
在既往研究的基础上,本研究通过对MCI患者嗅觉功能和认知功能进行评估并前瞻性随防观察2年,以期探讨基线嗅觉和认知评分对MCI患者转化为痴呆的临床预测价值。
1 资料与方法
1.1 病例选择标准
参照PETERSEN等[8]的MCI诊断标准:(1)患者(或其家属)报告其存在认知障碍;(2)临床评定证明患者存在认知障碍(包括记忆障碍或其他1项认知功能障碍);(3)患者(或其家属)报告其认知功能在过去1年内与以往相比出现衰退 ;(4)临床痴呆评定量表(Clinical Dementia Rating,CDR)为0.5分,没有严重的日常生活能力减退;(5)未患痴呆。
病例纳入标准:(1)2011年3月—2012年9月在上海交通大学医学院附属仁济医院神经内科记忆障碍门诊初次就诊;(2)符合PETERSEN等[8]的MCI诊断标准;(3)愿意接受随访及神经心理学测验;(4)签署知情同意书。
病例排除标准:(1)其他原因引起的认知功能减退,如癫痫、肿瘤、帕金森病、脑炎、正常颅内压脑积水、多发性硬化、甲状腺功能低下、精神病、梅毒、严重头颅外伤史伴持续神经功能缺损或已知脑结构异常;(2)既往2年内有酗酒及药物滥用或依赖史;(3)肝功能不全、肾功能不全、维生素缺乏;(4)有严重的视力、听力、嗅觉或语言障碍;(5)精神和神经发育迟滞;(5)服用过胆碱酯酶抑制剂或N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid,NMDA)受体拮抗剂。
1.2 基线资料收集
由上海交通大学医学院附属仁济医院神经内科医师收集所有研究对象的基线人口学资料(包括性别、年龄、体质量指数、教育年限、长期居住地)以及个人史(包括吸烟、饮酒史)、既往史(包括高血压、心脑血管疾病、肝肾疾病、内分泌疾病、神经系统其他疾病、外伤等)、家族史等资料,并对患者进行相应的神经系统体格检查以及基线神经心理测验和嗅觉评估。
神经心理测验包括4个量表。(1)简易智力状态检查(Mini-mental State Examination,MMSE)量表[9],检查内容分为10个方面(包括定向力、即时记忆、注意力和计算力、延迟回忆、物体命名、语言复述、言语理解、阅读理解、言语表达以及视空间能力),共30项,每项正确得1分,总分为30分。(2)日常生活能力(Activities of Daily Living,ADL)量表[10],包括基本日常生活能力6项(总评分范围:0~12分)和工具性日常生活能力(Instrumental ADL,IADL)8项(总评分范围:0~16分),这2种日常生活能力总评分相加得到的评分(范围:0~28分)越高,提示日常生活能力越完整;由于MCI不影响患者的基本日常生活能力,因此本研究仅对IADL进行评估。(3)蒙特利尔认知评估(Montreal Cognitive Assessment,MoCA) 量表[11], 包 括视空间与执行功能、命名、注意、语言、抽象、延迟回忆、定向7个方面,共30项,每项正确得1分,总分为30分。(4)神经精神科问卷(Neuropsychiatric Inventory,NPI)[12],评估患者的精神行为症状。
嗅觉评估采用12项跨文化嗅觉鉴定试验(12-item Cross-Cultural Smell Identification Test,CC-SIT)[13]。将12种常见的有气味物品分别放入12个小瓶中,检查时嘱受试者闭目在瓶口上方1 cm处用双鼻吸气来辨别气味;受试者每闻一种气味后,从给出的4个选项(包括1个正确选项和3个干扰选项)中选出正确答案,选对1个得1分,总分为12分。
1.3 随访及评估指标
对入组患者随访2年,随访截止日期为2014年11月30日。随访期间,定期对入组患者进行神经心理测验评估和嗅觉评估。2012年4月—2013年11月完成第1年评估,2013年5月—2014年11月完成第2年评估。
1.4 分组
在2年随访期间转化为痴呆的患者归入MCI转化组,未转化为痴呆的患者归入MCI稳定组。痴呆的诊断参照《精神障碍诊断与统计手册(The Diagnostic and Statistical Manual of Mental Disorders,DSM)》第 4 版[14]。
1.5 统计学方法
2 结 果
2.1 MCI稳定组和MCI转化组患者基线资料的比较
本研究共入组57例符合病例选择标准的MCI患者。至随访结束,18例(31.6%)MCI患者转化为痴呆(MCI转化组),39例(68.4%)MCI患者未转化为痴呆(MCI稳定组)。
MCI转化组中,男性9例(50.0%),女性9例(50.0%);平均年龄为69.8岁(范围:56~80岁);平均受教育年限为13.1年(范围:9~16年);平均体质量指数为23.0。MCI稳定组中,男性10例(25.6%),女性29例(74.4%);平均年龄为68.6岁(范围:59~77岁);平均受教育年限为12.0年(范围:6~16年);平均体质量指数为23.7。2组患者的年龄、性别、教育年限、体质量指数的差异均无统计学意义(P>0.05,表1)。
MCI转化组基线MMSE量表评分、MoCA量表评分、IADL量表评分和嗅觉评分均低于MCI稳定组,差异有统计学意义(P<0.001,表1);NPI评分也低于MCI稳定组,但差异无统计学意义(P=0.364,表1)。
2.2 MCI稳定组和MCI转化组随访第2年神经心理测验和嗅觉评估结果的比较
MCI转化组随访第2年的MMSE量表评分、MoCA量表评分、IADL量表评分和嗅觉评分均低于MCI稳定组,差异有统计学意义(P<0.001,表2);而NPI评分高于MCI稳定组,但差异无统计学意义(P=0.090,表2)。
2.3 MCI转化为痴呆的多因素logistic回归分析
MCI转化为痴呆的多因素logistic回归分析结果显示,年龄、体质量指数、教育年限、MMSE量表评分、IADL量表评分、MoCA量表评分、NPI评分、嗅觉评分均不是MCI转化为痴呆的独立预测因素(P>0.05,表3)。
表1 MCI稳定组和MCI转化组基线临床特征以及神经心理测验和嗅觉评分的比较 ( ± s)
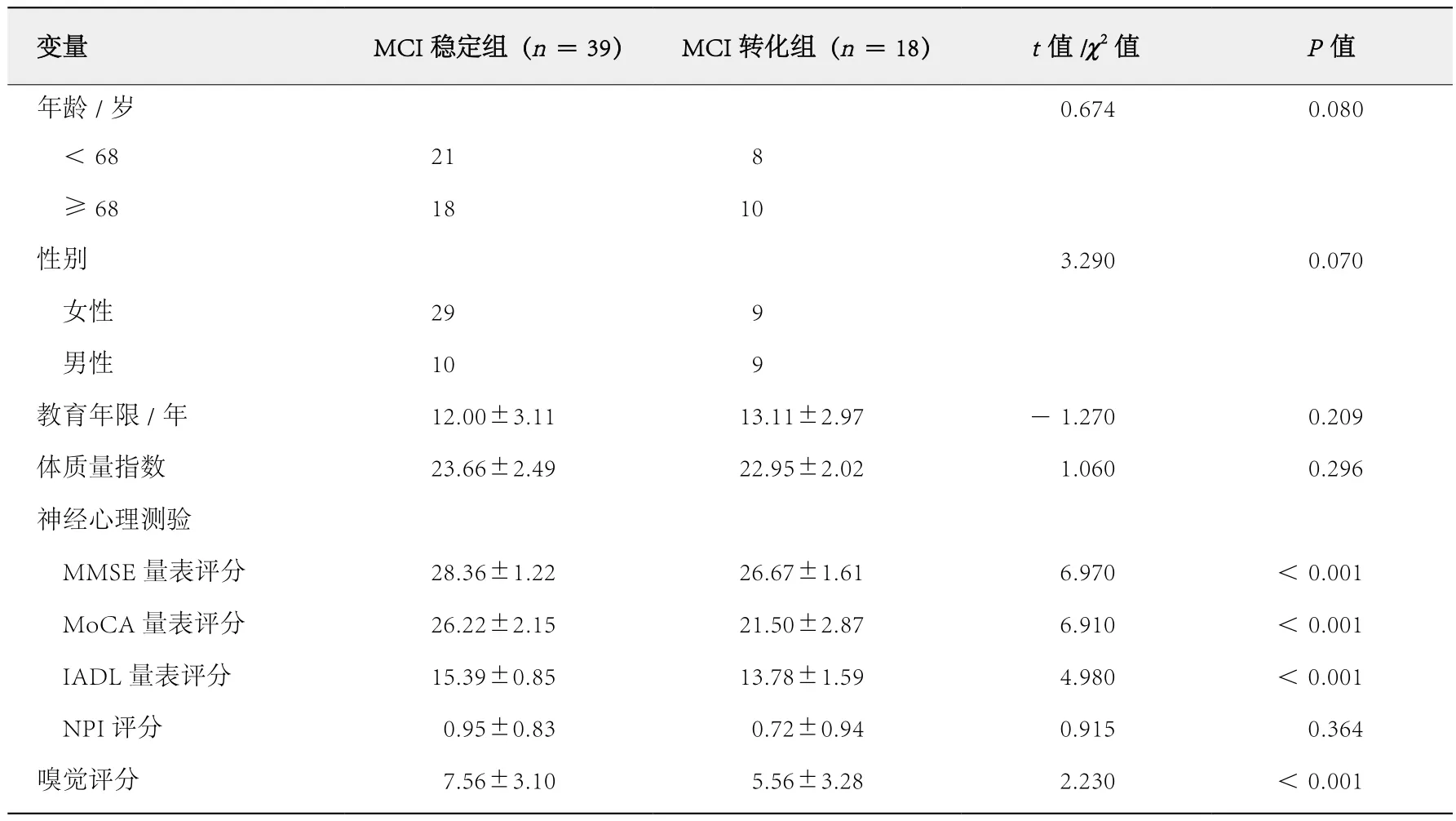
表1 MCI稳定组和MCI转化组基线临床特征以及神经心理测验和嗅觉评分的比较 ( ± s)
=39) MCI转化组(n =18) t值/χ2值 P值年龄/岁 0.674 0.080<68 21 8≥68 18 10性别3.290 0.070女性 29 9男性 10 9教育年限/年 12.00±3.11 13.11±2.97 -1.270 0.209体质量指数 23.66±2.49 22.95±2.02 1.060 0.296神经心理测验MMSE量表评分 28.36±1.22 26.67±1.61 6.970 <0.001 MoCA量表评分 26.22±2.15 21.50±2.87 6.910 <0.001 IADL量表评分 15.39±0.85 13.78±1.59 4.980 <0.001 NPI评分 0.95±0.83 0.72±0.94 0.915 0.364嗅觉评分 7.56±3.10 5.56±3.28 2.230 <0.001变量 MCI稳定组(n
表2 随访第2年MCI稳定组和MCI转化组神经心理测验和嗅觉评分的比较 ( ± s)
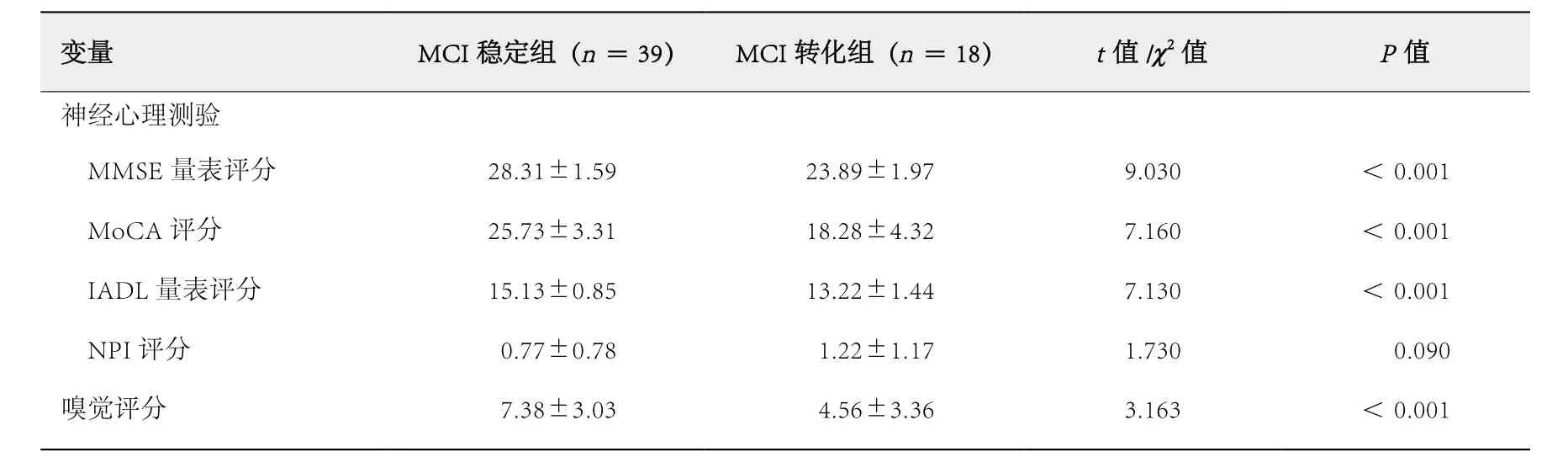
表2 随访第2年MCI稳定组和MCI转化组神经心理测验和嗅觉评分的比较 ( ± s)
变量 MCI稳定组(n =18) t值/χ2值 P值神经心理测验MMSE量表评分 28.31±1.59 23.89±1.97 9.030 <0.001 MoCA评分 25.73±3.31 18.28±4.32 7.160 <0.001 IADL量表评分 15.13±0.85 13.22±1.44 7.130 <0.001 NPI评分 0.77±0.78 1.22±1.17 1.730 0.090嗅觉评分 7.38±3.03 4.56±3.36 3.163 <0.001=39) MCI转化组(n
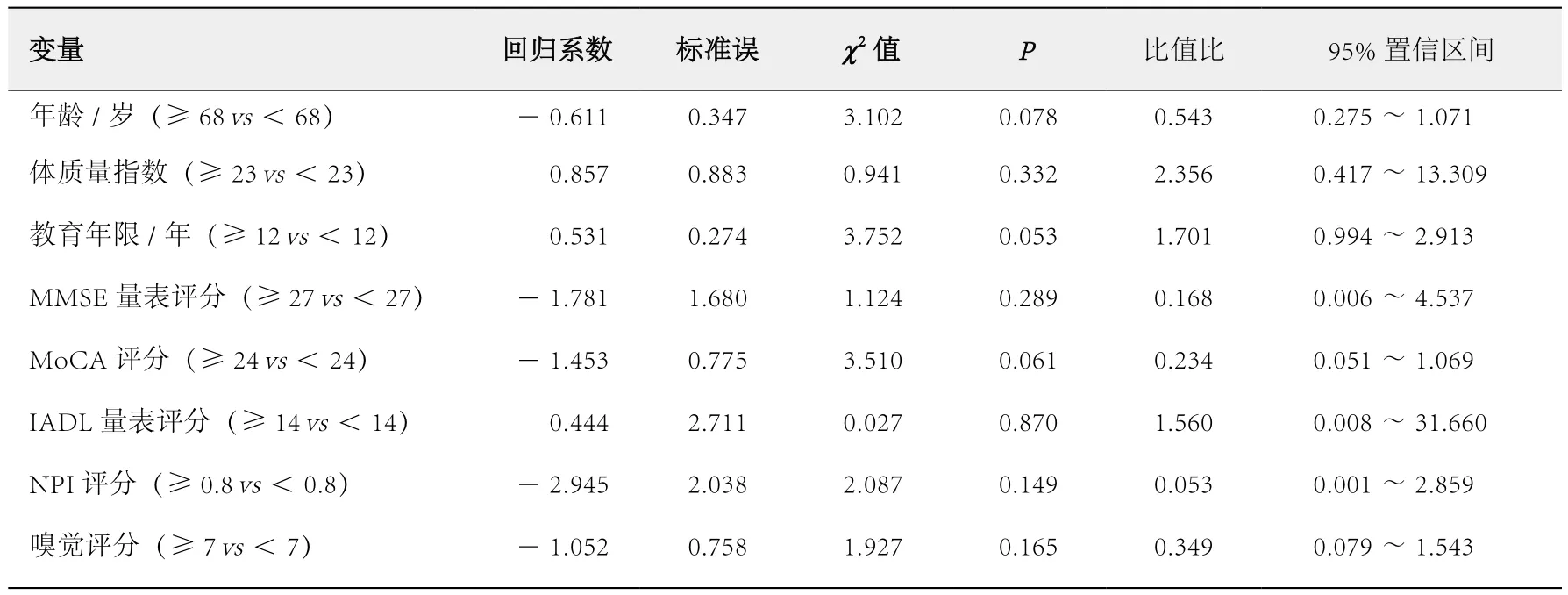
表3 MCI转化为痴呆的多因素logistic回归分析
3 讨 论
本研究通过对上海交通大学医学院附属仁济医院神经内科记忆障碍门诊初次就诊的57例MCI患者进行2年的随访观察,发现其中有18例患者转化为痴呆,转化率为31.6%,这一结果与MARRA等[15]报道的27.8%接近。PETERSEN等[8]的研究表明,在正常老年人群中, 1%~2%发展为AD患者;而在MCI患者中,每年有10%~15%转化为有临床症状的AD患者。因此,预测哪些MCI患者容易转化为痴呆尤为重要。目前为止还无单一的神经影像因子或生物学标志物能够准确地预测MCI患者转化为痴呆,且这类检测手段的花费昂贵,在临床应用中的可行性不高。本研究希望通过采用简单而有效的临床筛选工具来观察哪些因素与MCI发展为AD相关。
本研究发现,MCI转化组不仅基线记忆量表(MMSE量表和MoCA量表)评分均显著低于MCI稳定组(P<0.001),且嗅觉评分和IADL量表评分也较MCI稳定组低(P<0.001)。LEE等[1]收集了382例遗忘型MCI患者的一般人口学资料,并对其进行3年的认知功能纵向随访观察,结果发现约43%的MCI患者发展为AD患者;由此提出,认知功能是预测MCI发展为AD的主要预测因素。其中,记忆缺失较其他认知缺损对IADL的损害更大。LI等[16]对139例MCI患者进行神经影像学、基因、脑脊液及认知功能的随访评估,结论为虽然磁共振成像和认知功能评估在预测MCI发展为AD中的作用是相似的,但从长远来看,认知功能评估比其他生物学标志物更具价值,进一步确定了认知功能评估的重要性。TABERT等[17]随访了183例MCI患者的嗅觉水平,COX比例风险回归模型分析结果提示,嗅觉功能下降与脑的整体功能迅速下降有关,嗅觉评分每降低1分,发生痴呆的风险就增加18%。来自嗅球的嗅觉信息[18]通过嗅觉通路传导至原始嗅皮质(梨状层、杏仁核和内嗅层)及皮质下层(纹状体腹侧及脑室中间的下丘脑),这些结构与继发性嗅觉部位如海马和额眶皮质的病变有关。既往研究[19]认为,嗅觉与Tau蛋白免疫神经纤维缠结有关,提示年龄相关的嗅觉损伤与中枢嗅觉通路神经纤维斑块缠结有关;神经病理学及神经影像学证据提示,颞叶中部结构的损害(尤其是内嗅皮质和海马的损害)在AD早期就已存在,并与嗅觉的缺失有关。本研究结果也提示,嗅觉功能障碍可能是MCI向AD转化的一项早期表现。
本研究中,虽然2组患者的年龄无显著差异,但MCI转化组患者的平均年龄略大于稳定组。HONQ等[20]对129例主观记忆障碍患者进行了平均3.64年的随访观察,发现进展组与稳定组的基线年龄、载脂蛋白E4(apolipoprotein E4,ApoE4)及部分认知领域损害存在差异;基线年龄较大、MMSE量表评分较低、ApoE4基因携带者及动词延迟回忆评分较低是疾病易发生进展的相关预测因素。FONSECA等[21]对62例主观记忆障碍患者进行了平均44个月的随访观察,发现年龄≥61岁、执行功能差、生活上需要较多帮助、同时使用较多内科药物的患者转化为痴呆的风险较高,尤其是发病年龄较晚、第1次评估时年龄偏大的患者,都值得对其开展进一步的随访评估,如对这些患者开展早期治疗将得到较大获益。
本研究中,虽然2组的体质量指数无显著差异,但MCI转化组患者平均体质量指数略低于MCI稳定组,提示体质量较低的患者有可能较易转化为痴呆患者。JOHNSON等[22]对449例正常老年人进行了6年的跟踪随访,最终有125例发展为AD,其余324例仍保持认知功能正常;虽然2组患者在随访期间均有体质量下降,但发展为AD的患者的年平均体质量下降值(1.2 lb/年)是保持认知功能正常患者(0.6 lb/年)的2倍,并且在入组时,前者的平均体质量已比后者轻8磅。本研究得出结论,AD的进展与体质量下降密切相关,体质量下降可能发生于疾病早期甚至在痴呆诊断之前。
本研究多因素logistic回归分析显示,年龄、体质量指数、教育年限、MMSE量表评分、IADL量表评分、MoCA量表评分、NPI评分、嗅觉评分均不是MCI转化为痴呆的独立预测因素,与国外部分研究报道的结果不一致。如TREBBASTONI等[23]研究发现,年龄、男性、基线MMSE量表评分及综合衰退指数是MCI转化的独立预测因素。本研究未得出独立的预测因素,可能与本研究样本量较小及随访时间较短(MCI转化为痴呆较为缓慢)等多个方面的因素有关。今后需要扩大样本量及延长随访时间以进一步确认MCI转化为痴呆的预测因素。
本研究结果提示,MCI向AD的转化是多因素共同作用、长期演变的结果。在临床实践中,一些神经影像学检查和生物学标志物检测的实施相对较为困难;而嗅觉评估和认知功能检查较为简单,且具有无创优势,在基层医疗机构也可实施,其实用性和可操作性较强。通过嗅觉评估和认知功能评估以早期发现并筛选出易转化为痴呆的MCI患者,就能在早期开展有针对性的干预,从而延缓痴呆进展,具有重要的临床意义。

