lncRNA UCA1在肝癌中的表达及对肝癌HepG2细胞增殖和侵袭的作用及机制
王海博,李忠廉
肝癌是发病率和死亡率较高的恶性肿瘤之一,其恶性程度高、预后差,具有很强的侵袭和转移力[1]。尽管目前肝癌发生、发展相关机制的研究已有很多,但是其病因及发病机制尚未明确[2]。因此,探寻调控肝癌发生、发展的分子标志物对揭示肝癌的生物学行为及抑制其恶性进展至关重要。长链非编码RNA(long noncoding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA,可作为基因转录调控分子参与疾病的发生、发展过程[3-4]。近年研究显示,lncRNA UCA1在多种恶性肿瘤细胞中表达,提示其可能与肿瘤的发生、发展及预后有关[5-7]。本研究采用已构建的lncRNA UCA1短发夹RNA(shRNA)质粒,旨在探讨lncRNA UCA1基因沉默后对人肝癌HepG2细胞增殖和侵袭的影响及机制。
1 材料与方法
1.1 实验材料 肝癌和癌旁组织标本各20例均来自天津市南开医院2015年11月—2017年5月行肝癌手术患者,男10例,女10例,年龄47~62岁,平均(56.3±6.8)岁。患者均于术后病理证实为肝细胞癌。标本的收集及使用得到天津市南开医院伦理委员会批准。
1.2 主要试剂与仪器 人肝癌细胞HepG2购自中国科学院典型培养物保藏委员会细胞库;RPMI-1640培养基、胎牛血清、Trizol和Lipofectamine 2000(美国Life Technologies公司);CCK-8试剂盒、细胞蛋白抽提试剂盒和超敏化学发光试剂盒(上海碧云天生物技术有限公司);cDNA反转录试剂盒和SYBR Green Real-time PCR Master Mix(大连宝生物工程公司);Matrigel基质和Transwell小室(美国Corning公司);细胞周期蛋白(Cyclin)D1、血管内皮生长因子(VEGF)、基质金属蛋白酶(MMP)-9、黏着斑激酶(FAK)和整合素(Integrin)β3一抗以及二抗(美国Santa Cruz公司),β-actin单克隆抗体(Sigma公司);引物合成和纯化(六合华大基因科技股份有限公司);其他试剂均为国产分析纯。OLYMPUSBX51光学显微镜(日本Olympus公司),ABI 7500荧光定量PCR仪(美国Applied Biosystems公司)。
1.3 细胞培养及转染 HepG2细胞培养于含10%胎牛血清的RPMI-1640培养基,置于37℃、5%CO2、饱和湿度的培养箱中,0.25%胰酶-EDTA消化传代,所有实验均采用对数生长期细胞。根据靶向lncRNA UCA1序列的不同区域,本研究设计了2种shRNA质粒(pcDNA3.1 vector)。引物序列见表1。
将对数生长期的HepG2细胞以3×106个/mL加入6孔板中,每孔100µL,培养过夜,通过转染试剂Lipofectamine 2000按照说明书方法分别转染lncRNA UCA1 shRNA质粒1和lncRNA UCA1 shRNA质粒2,37℃、5%CO2、饱和湿度培养48 h进行后续实验。不转染细胞作为Control组。
1.4 CCK-8实验检测lncRNA UCA1 shRNA对细胞增殖的影响 转染后的细胞以2×103个/mL接种到96孔微孔板中,每孔100µL,每组设置5个复孔,培养过夜使细胞贴壁,培养72h后按照CCK-8试剂盒说明书的要求每孔加入10µL CCK-8试剂,继续培养2 h。最后用酶标仪测定450 nm波长下的光密度(OD)值。
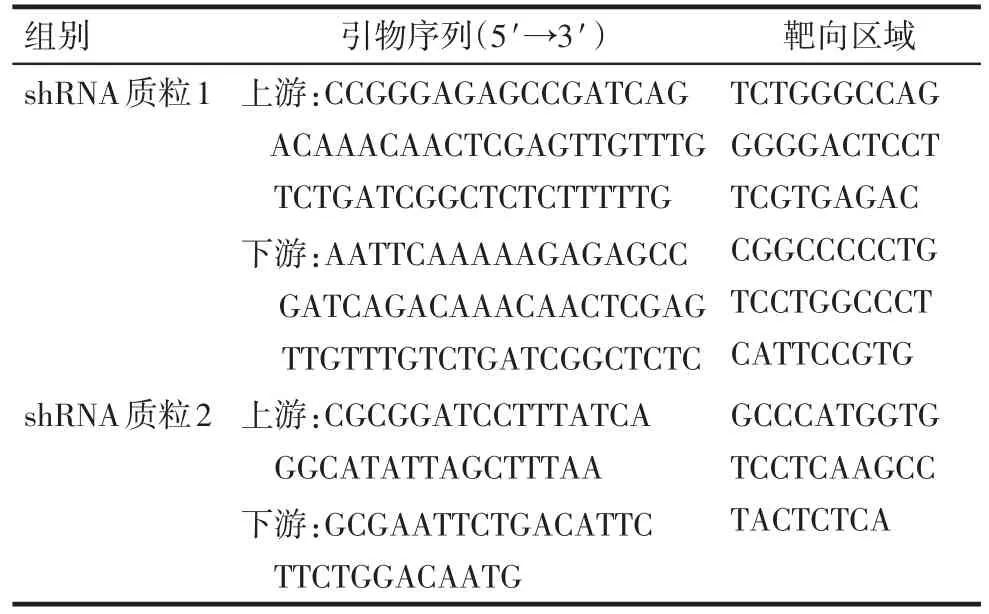
Tab.1 shRNA plasmid primer sequence表1 shRNA质粒引物序列
1.5 体外侵袭实验检测lncRNA UCA1 shRNA对细胞侵袭能力的影响 HepG2细胞转染48 h后,0.25%胰酶-EDTA消化后无血清RPMI-1640制备细胞悬液,1×105个细胞加入预先铺好100µL Matrigel基质的transwell上室中,下室中加入600µL含10%胎牛血清的RPMI-1640培养基,培养24 h。取出小室,棉签擦掉上室未透过聚碳酯膜的Matrigel胶和细胞,4%多聚甲醛固定膜10 min,结晶紫染色20 min,高倍镜下随机计数5个视野中的细胞数,以细胞数代表肿瘤细胞的侵袭能力。
1.6 细胞划痕实验检测lncRNA UCA1 shRNA对细胞迁移能力的影响 HepG2细胞于6孔板中分别转染lncRNA UCA1 shRNA质粒1/2 48 h后,继续培养直至形成单层融合。无血清饥饿培养过夜,然后利用200µL吸头在细胞层中形成划痕,继续培养48 h,显微镜观察并统计划痕的间隙距离。
1.7 Western blot实验检测lncRNA UCA1 shRNA对细胞肿瘤相关基因蛋白表达的影响 HepG2细胞转染48 h后收集细胞,用RIPA裂解液进行裂解,加入40µg蛋白样品,经12%十二烷基硫酸钠⁃聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至硝酸纤维素膜(150 mA,1 h),5%脱脂牛奶封闭1 h后,Cyclin D1(1∶2 000)、VEGF(1∶2 000)、MMP-9(1∶2 000)、FAK(1∶2 000)和Integrin β3(1∶2 000)特异性抗体(一抗)4℃孵育过夜。洗去一抗,以辣根过氧化物酶标记的羊抗鼠二抗(1∶2 000)室温孵育1 h,洗涤,以化学发光试剂盒显示免疫反应条带。β-actin(1∶5 000)作为内参,检测细胞中Cyclin D1、VEGF、MMP-9、FAK和Integrin β3的表达水平。
1.8 Real-time PCR检测lncRNA UCA1 shRNA对细胞中lncRNA UCA1和肿瘤相关基因mRNA表达的影响 所有组织标本活检后均经病理学诊断确认。收集后立即置于液氮中,于-80℃保存。HepG2细胞转染48 h后,采用Trizol法提取组织及细胞的总RNA,紫外分光光度计测定RNA纯度和浓度,然后据cDNA反转录试剂盒说明书进行cDNA的合成。以GAPDH作为内参,在荧光定量PCR仪上以SYBR Green I染料检测靶基因的表达情况。将所扩增的PCR产物进行熔解曲线分析,同时随机进行体积分数为2%琼脂糖凝胶电泳分析,以确定产物是否为所扩增的目的片段。采用2-△△Ct法分析各个样品的基因相对表达差异,引物序列见表2。反应条件:95 ℃预变性3 min;95℃ 15 s,60℃ 20 s,72 ℃ 15 s,40个循环;72℃延伸5 min。

Tab.2 Real-time PCR primer sequence表2 Real-time PCR引物序列
1.9 统计学方法 采用SPSS 11.0统计软件分析数据,实验数据用±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA UCA1在肝癌组织中的表达结果 与癌旁组织相比,肝癌组织lncRNA UCA1的表达水平显著上升(1.000±0.287vs.0.553±0.122,t=6.409,P<0.05)。
2.2 shRNA沉默HepG2细胞中lncRNA UCA1的表达 Real-time PCR检测结果显示,与Control组(1.000±0.112)相比,lncRNA UCA1 shRNA 质粒1(0.673±0.057)和 lncRNA UCA1 shRNA 质 粒 2(0.545±0.053)干扰后,2组HepG2细胞中lncRNA UCA1的表达水平均显著下降(F=44.403,P<0.01)。
2.3 沉默lncRNA UCA1表达对HepG2细胞生长的影响 CCK-8结果显示,lncRNA UCA1表达沉默后,HepG2细胞的体外增殖受到显著抑制,见表3。
2.4 沉默lncRNA UCA1表达对细胞侵袭和迁移的影响 Transwell实验显示,沉默lncRNA UCA1表达后,细胞侵袭能力明显下降,表明lncRNA UCA1影响HepG2细胞的体外侵袭能力。而划痕实验同样显示,Control组的划痕宽度显著减小,沉默lncRNA UCA1表达后,lncRNA UCA1 shRNA1和 lncRNA UCA1 shRNA2的划痕愈合受到显著抑制,见图1、表4。
Tab.3 The effect of lncRNA UCA1 silencing on the proliferation in HepG2 cells in vitro表3 沉默lncRNA UCA1表达对HepG2细胞体外增殖的影响 (n=5,OD值,±s)

Tab.3 The effect of lncRNA UCA1 silencing on the proliferation in HepG2 cells in vitro表3 沉默lncRNA UCA1表达对HepG2细胞体外增殖的影响 (n=5,OD值,±s)
**P<0.01;a与Control组比较,b与shRNA1组比较,P<0.05
组别Control组shRNA1组shRNA2组F 24 h 0.252±0.022 0.214±0.025a 0.181±0.012ab 15.112**48 h 0.552±0.041 0.431±0.042a 0.383±0.035ab 24.361**72 h 1.221±0.130 0.741±0.063a 0.623±0.052ab 63.842**
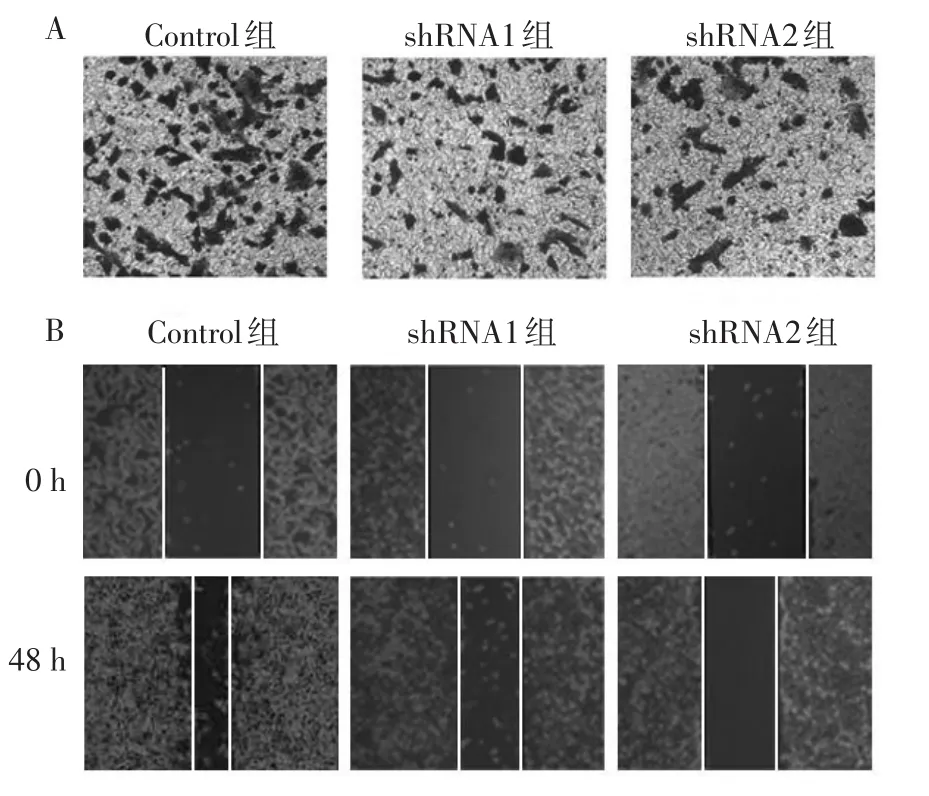
Fig.1 The effect of lncRNA UCA1 silencing on the invasion and migration in HepG2 cells in vitro图1 沉默lncRNA UCA1表达对细胞侵袭和迁移的影响
Tab.4 The effect of lncRNA UCA1 silencing on the invasion and migration in HepG2 cells in vitro表4 沉默lncRNA UCA1表达对HepG2细胞体外侵袭和迁移的影响 (n=3,±s)
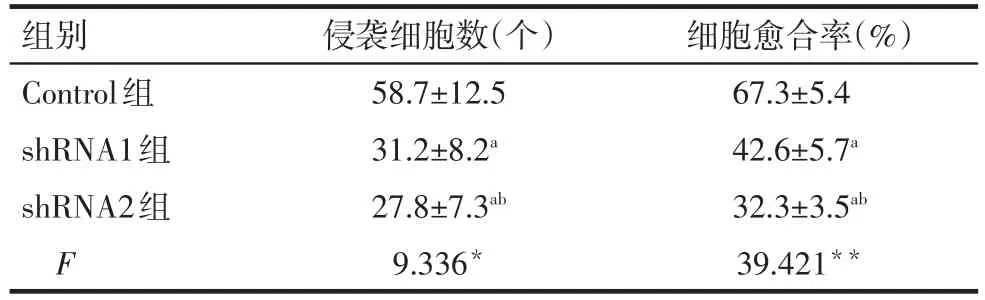
Tab.4 The effect of lncRNA UCA1 silencing on the invasion and migration in HepG2 cells in vitro表4 沉默lncRNA UCA1表达对HepG2细胞体外侵袭和迁移的影响 (n=3,±s)
*P<0.05,**P<0.01;a与Control组比较,b与shRNA1组比较,P<0.05
组别Control组shRNA1组shRNA2组F侵袭细胞数(个)58.7±12.5 31.2±8.2a 27.8±7.3ab 9.336*细胞愈合率(%)67.3±5.4 42.6±5.7a 32.3±3.5ab 39.421**
2.5 沉默lncRNA UCA1表达对Cyclin D1、VEGF、MMP-9、FAK和Integrin β3表达的影响 Western blot结果显示,与Control组相比,沉默lncRNA UCA1表达后细胞中的Cyclin D1、VEGF、MMP-9、FAK和Integrin β3的表达水平显著下降,见表5、图2。
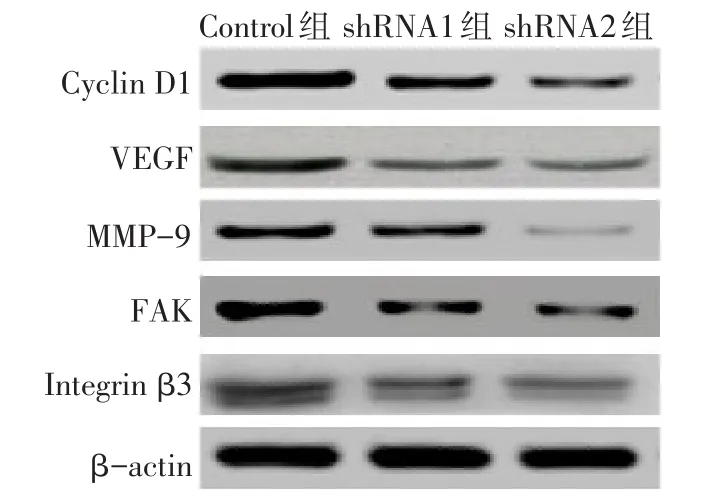
Fig.2 The effect of lncRNA UCA1 silencing on the protein expression of Cyclin D1,VEGF,MMP-9,FAK and Integrin β3 in HepG2 cells图2 沉默lncRNA UCA1表达对Cyclin D1、VEGF、MMP-9、FAK和Integrin β3蛋白表达的影响
3 讨论
LncRNAs已经被证明参与包括肝癌在内的多种肿瘤发生发展过程,本研究通过分析lncRNA UCA1在肝癌中的表达和作用,深入探索肝癌发病的分子机制。
3.1 lncRNA UCA1在肝癌组织中高表达 研究发现lncRNA UCA1在多种肿瘤组织中表达,并且与其恶性程度及患者预后密切相关[8],提示lncRNA UCA1在肿瘤细胞的生存与发展过程中起着重要作用。本研究首先利用Real-time PCR检测了肝癌患者的癌组织和对应的癌旁组织中lncRNA UCA1表达,结果显示lncRNA UCA1在肝癌组织中高表达,提示lncRNA UCA1可作为潜在的肿瘤标志物并可能在肝癌增殖和侵袭等生物学行为中具有调控作用。
3.2 lncRNA UCA1沉默对HepG2细胞的抑制作用和机制 HepG2细胞株是一种分化型肝癌细胞。本研究显示,shRNA沉默lncRNA UCA1后,HepG2细胞的体外增殖、侵袭和迁移能力均显著下降。因此,本研究通过Western blot和Real-time PCR实验进一步分析lncRNA UCA1抑制肝癌的分子机制。
Tab.5 The effect of lncRNA UCA1 silencing on the mRNA expression of Cyclin D1,VEGF,MMP-9,FAK and Integrin β3 in HepG2 cells表5 沉默lncRNA UCA1表达对Cyclin D1、VEGF、MMP-9、FAK和Integrin β3的mRNA表达的影响 (n=5,±s)
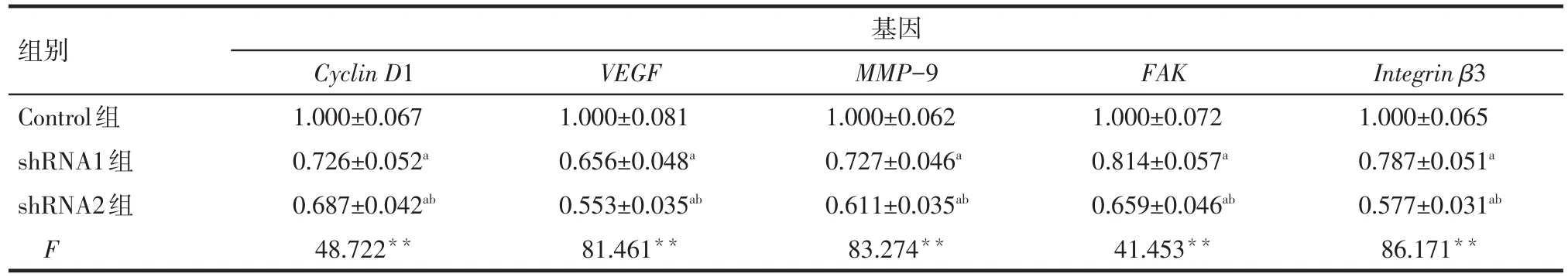
Tab.5 The effect of lncRNA UCA1 silencing on the mRNA expression of Cyclin D1,VEGF,MMP-9,FAK and Integrin β3 in HepG2 cells表5 沉默lncRNA UCA1表达对Cyclin D1、VEGF、MMP-9、FAK和Integrin β3的mRNA表达的影响 (n=5,±s)
**P<0.01;a与Control组比较,b与shRNA1组比较,P<0.05
组别Control组shRNA1组shRNA2组F基因Cyclin D1 1.000±0.067 0.726±0.052a 0.687±0.042ab 48.722**VEGF 1.000±0.081 0.656±0.048a 0.553±0.035ab 81.461**MMP-9 1.000±0.062 0.727±0.046a 0.611±0.035ab 83.274**FAK 1.000±0.072 0.814±0.057a 0.659±0.046ab 41.453**Integrin β3 1.000±0.065 0.787±0.051a 0.577±0.031ab 86.171**
Cyclin D1是调控细胞周期G1期向S期过渡的关键分子,参与细胞的增殖和凋亡,并与肿瘤的发生发展关系密切[9]。VEGF目前被认为是促进某些肿瘤淋巴管新生和淋巴结转移的重要因素之一。Cyclin D1被认为可通过调控VEGF来影响肿瘤转移侵袭,两者均在肿瘤的血管新生过程中发挥关键调节作用并与患者预后不良有关[10-11]。本研究中发现,沉默lncRNA UCA1表达后,Cyclin D1和VEGF表达水平均明显下调,提示Cyclin D1和VEGF在lncRNA UCA1调控肝癌细胞增殖中发挥作用。MMP-9是降解细胞外基质和基底膜的重要基质金属蛋白酶之一,是肿瘤浸润转移过程中重要的调控因子,在肿瘤的发展中起关键作用[12]。本研究中发现,沉默lncRNA UCA1表达后,MMP-9表达水平均明显下调,表明lncRNA UCA1可能通过调控MMP-9而参与调控肝癌细胞的侵袭转移。
3.3 lncRNA UCA1对Integrin β3-FAK通路的调控作用 Integrin β3-FAK通路在细胞增殖、形态改变以及运动过程中具有重要作用,可通过上调Cyclin D1表达使细胞获得侵袭表型。FAK是整合蛋白介导的信号转导通路中的重要成员,在肿瘤向恶性侵袭表型演进的过程中起着重要的作用[13]。Integrin β3是介导细胞与细胞间的相互作用及细胞与细胞外基质间相互作用的细胞黏附分子[14],可介导并激活FAK,从而调控肿瘤细胞的黏附和迁移[15]。本研究发现沉默lncRNA UCA1表达可下调HepG2细胞中Integrin β3和FAK表达,提示lncRNA UCA1可能通过Integrin β3-FAK信号途径调控肝癌细胞的侵袭转移。
本研究显示lncRNA UCA1在肝癌组织中异常高表达,在肝癌细胞增殖和侵袭转移中发挥作用,沉默lncRNA UCA1可抑制肝癌细胞的体外生长、侵袭和迁移,其机制可能涉及Integrin β3-FAK信号途径,并调控Cyclin D1、VEGF和MMP-9的表达。lncRNA UCA1核苷酸序列较长,本研究根据不同序列区域设计了2种shRNA质粒,并发现上述shRNA质粒均可有效抑制HepG2细胞体外增殖和侵袭,但是靶向不同区域对肿瘤细胞的抑制效果不同,本课题组将在今后的研究中进一步探讨其机制。

