不同程度重金属污染对稻田土壤真菌群落结构的影响①
闫 华,欧阳明,张旭辉,应 多,赵熙君,张玉娇,郑聚锋,刘晓雨,卞荣军,李恋卿,潘根兴
不同程度重金属污染对稻田土壤真菌群落结构的影响①
闫 华,欧阳明,张旭辉*,应 多,赵熙君,张玉娇,郑聚锋,刘晓雨,卞荣军,李恋卿,潘根兴
(南京农业大学农业资源与生态环境研究所,南京 210095)
为了研究土壤真菌群落结构在不同程度重金属污染中的变化,本文用Illumina HiSeq高通量测序技术分析了苏南地区某金属冶炼厂和加工产业区的重金属污染水稻土的真菌群落结构,发现不同程度重金属污染对水稻季土壤真菌丰度和群落结构均有显著影响。经过真菌主成分分析发现,PC1影响因素对样品处理差异的贡献率是35.96%,PC2影响因素对样品处理差异的贡献率是21.48%;通过真菌冗余度分析发现,重金属Pb和Cu污染对土壤真菌群落结构的影响显著;通过对真菌属水平的相对丰度分析表明,重金属污染会显著降低敏感真菌的丰度,如被孢霉属相对丰度最高降低了87.50%、木霉属最高降低了99.46%、离壳菌属和菇属最高降低了100.00%,同时耐性真菌的相对丰度会提高,如类球囊霉属的相对丰度最高增加了98倍、四枝孢霉属最高增加了56倍、根囊壶菌属最高增加了2.62倍。综上所述,不同程度重金属污染对稻田土壤真菌群落结构有显著影响,且随着污染程度的增加,抗逆真菌相对数量和种类显著增加,敏感真菌的相对数量急剧减少,真菌群落结构随着重金属污染程度增加进一步分化。
重金属污染;稻田土壤;真菌群落结构;Illumina HiSeq高通量测序
重金属在土壤中不易被微生物所分解,只能在环境中迁移、转化,并不断积累,当超过一定限度时便对植物和土壤微生物产生毒害作用,从而破坏土壤生态系统平衡,进而影响整个环境系统的功能[1-2]。土壤微生物是维持土壤生物活性的重要组分,在地球生物化学循环过程中扮演重要角色,几乎参与土壤中一切生物和生物化学反应,包括对动植物残体的分解、养分的贮藏转化、水分入渗、气体交换、土壤结构的形成与稳定、有机物的合成及异源生物的降解等方面[3],与土壤中的动植物相比土壤微生物群落结构组成对外界环境污染干扰更加灵敏。因此,土壤微生物群落结构是表征土壤生态系统群落结构和稳定性的重要参数,能够较好地指示土壤环境污染状况[4]。而真菌则对重金属污染较细菌敏感,土壤重金属污染可显著减少真菌生物量、改变真菌群落组成[5-7]。
土壤真菌作为土壤微生物中重要的种类之一,参与有机质分解,促进物质循环,为植物提供养分,是生态系统健康的指示物种[8]。与细菌相比,真菌利用等量底物时,可以形成更多的自身生物量,且真菌能量流的周期较长[9-10]。真菌不仅能分泌胞外酶,而且其菌丝具有机械穿插作用,共同降解土壤中难降解的纤维素和木质素[11-12],因此真菌可以更有效地利用有机底物,是土壤有机质分解和转化的积极参与者。因此,虽然真菌数量不及细菌和放线菌,但真菌呼吸作用所释放的CO2占土壤总呼吸作用的81% ~ 95%[13-14],在陆地生态系统碳循环中占有重要地位。土壤重金属污染可能会通过减少微生物对单一碳底物的利用能力,而减少群落的多样性和改变其群落结构。如在重金属污染的稻田土壤中,重金属污染降低了微生物生物量和真菌优势度,提高了代谢商,从而改变了稻田土壤中与碳素周转相关的生物化学过程及CO2排放[15]。外界干扰如杀菌剂的使用、重金属污染等,会影响真菌群落结构或改变丰富度,进而影响土壤有机质的降解[16-17]。不同程度的重金属污染可能对土壤真菌的碳利用效率影响不同,如在培养条件下,土壤中较低浓度的重金属污染可刺激土壤呼吸和土壤碳代谢作用,而较高浓度的重金属污染则会抑制微生物的分解活动从而导致土壤有机碳矿化率降低[18]。研究表明长期Cd、Pb、Cu、Zn的复合污染降低了稻田土壤微生物生物量,污染程度越高,微生物生物量越低,且土壤微生物生物量与土壤有效Cd、Pb、Cu、Zn的含量呈显著负相关关系[19]。重度重金属污染可以显著降低微生物多样性指数,导致微生物群落结构发生实质性变化[20],但在长期重金属污染的田间环境中真菌群落结构是如何随重金属污染程度的变化而变化还需要进一步研究。
随着现代生物技术的发展和分子生物技术水平的提高,在分子水平上研究重金属污染对土壤微生物群落结构的影响已经成为可能。本研究利用Illumina HiSeq高通量测序技术分析了不同程度重金属污染水平下稻田土壤真菌的群落结构差异,研究了不同程度重金属污染对土壤中不同菌群的影响,探讨了土壤中重金属耐性菌和敏感菌的变化,以期为重金属污染下水稻土有机碳稳定性机制的研究提供生物学方面的参考。
1 材料与方法
1.1 试验材料
供试土壤为水稻土-普通铁聚水耕人为土,土壤样品于2015年10月28日采自苏南宜兴地区某金属冶炼厂和加工产业区的Pb-Cd污染水稻土,在污染源的下风向分别选取距污染源120 m(P1)、80 m(P2)、60 m(P3)、30 m(P4)及10 m(P5)的土样代表不同污染程度的土壤样品,并选取邻近农作相同的未污染田块作为对照(P0)。采样时各处理随机3点采集0 ~ 15 cm土壤样品,田间混合后装袋,将土样盛于保鲜箱内带回实验室,分出部分鲜样置于 –80 ℃冰箱中保存,供土壤总DNA提取;剩余土壤样品剔除植物残体和石块后,风干,研磨后分别过20目和100目筛,过20目筛土壤用于测定土壤pH、CEC,过100目筛土壤用于测定土壤有机质、全氮、全磷、全钾及土壤重金属含量。
1.2 试验方法
1.2.1 供试土壤基本性质测定 供试土壤的基本理化性质参照《土壤农化分析》[21]相关方法测定。土壤Pb、Cd、Cu、Zn全量用王水-高氯酸消化[22],土壤重金属有效态含量采用DTPA浸提,其中Cu和Zn采用火焰原子吸收分光光度法测定,Cd、Pb采用石墨炉原子吸收分光光度法测定。
评价土壤重金属污染水平高低,常用内梅罗污染指数[23]表示。内梅罗指数的计算公式如下:{[(均)2最大)2]/2}1/2,式中均和最大分别是平均单项污染指数和最大单项污染指数,内梅罗指数的计算参照国家土壤环境质量标准(GB15618-2008)。
表1为供试土壤样品的基本理化性质,因为试验地是一直作为农用地使用,各养分含量差异不显著。表2是供试土壤样品的重金属全量和DTPA浸提有效态重金属含量,根据国家土壤环境质量标准,综合评价指标内梅罗指数的计算结果表明,无污染稻田内梅罗指数最低,污染区域越靠近污染源点的稻田,内梅罗指数越高,且主要污染因子为Pb、Cd。
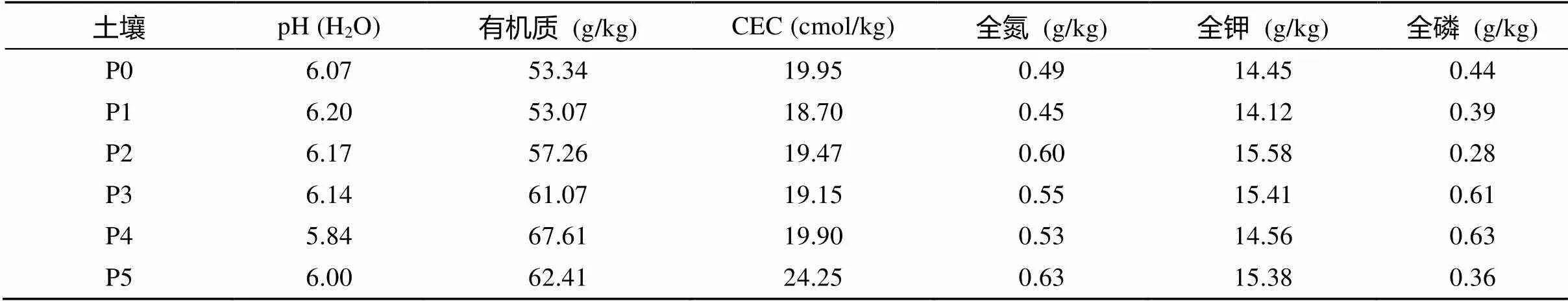
表1 供试土壤样品基本性质
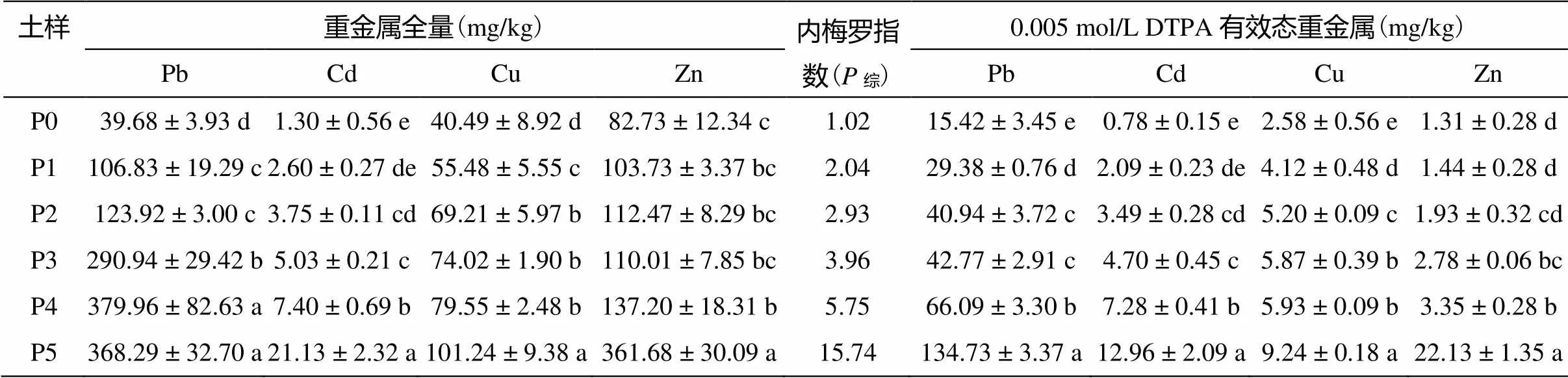
表2 不同程度重金属污染下土壤重金属含量和内梅罗综合指数
注:同列数据小写字母不同表示不同土样间差异显著 (< 0.05);土壤综合污染程度分级:综≤0.7 安全;0.7<综≤1.0 警戒线;1.0<综≤2.0 轻污染;2.0<综≤3.0 中污染;综>3.0 重污染。
1.2.2 土壤微生物基因组DNA的提取 取0.30 g土样提取总DNA,使用DNA快速提取试剂盒(Power Soil,Mo Bio公司),按操作说明进行。DNA提取完成后,用1.5% 的琼脂糖凝胶电泳检测质量,并对土壤总DNA的浓度进行测定,测定采用NanoDrop ND-1000微量分光光度计。
1.2.3 土壤真菌丰度的测定——定量PCR技术 土壤真菌18S rRNA基因拷贝数采用荧光定量PCR的方法进行测定。定量试剂采用SYBR®TM(Takara Bio, Otsu, Shiga, Japan)反应液,实验在iCycler IQ5定量PCR仪(Bio-Rad, Hercules, CA)上进行,定量反应体系为20 μl,包括1 μl的DNA模板,10 μmol/L上、下游引物各0.4 μl,7.8 μl灭菌双蒸水和10.4 μl扩增酶混合物。所用引物及PCR扩增程序见表3。

表3 定量PCR分析所用目的基因的引物序列及扩增程序
1.2.4 Illumina HiSeq高通量测序 随着分子生物学技术的发展,土壤微生物学研究专家开发出一系列研究土壤微生物群落结构的方法,如PCR-DGGE、PLFA、BIOLOG,而这些方法往往会低估土壤微生物群落结构组成。随着高通量测序技术的发展,因其能够较为全面和准确地反映土壤微生物群落结构,并能较为客观地反映其中低丰度的重要功能微生物等优势,已逐渐成为土壤微生物学研究中最先进的测序手段。目前,应用于微生物测序的常见平台有 454、Illumina 测序平台,其中Illmina公司包含有HiSeq和MiSeq测序平台,基于Solexa技术,其基本原理是单分子簇边合成边测序(Sequencing by Synthesis,SBS)和dNTP可逆终止化学反应,该测序方法的主要优点是通量高、准确率高以及成本低等[25-27]。本试验研究采用Illumina HiSeq高通量测序技术,图1为测序原理图,表4 是测序所用引物序列。

图1 测序原理图

表4 高通量测序引物序列
1.3 数据分析方法
Illumina HiSeq高通量测序数据统计分析:对原始数据进行QC之后,用usearch软件对数据进行去嵌合体和聚类的操作,usearch聚类时,先将reads按照丰度由大到小排序,通过97% 相似度的标准聚类,得到OUT,每个OUT被认为可代表一个物种。在聚类过程中利用denovo方法去除嵌合体。接下来对每个样品的tags进行随机抽平处理,并提取对应的OUT序列。然后使用Qiime软件,做alpha多样性指数的稀释曲线,根据稀释曲线选择合理的抽平参数,利用Qiime软件对得到的抽平后OUT进行分析,首先从OUT中分别提取一条reads作为代表序列,使用uclust方法,将该代表序列与ITS数据库比对,从而对每个OUT进行物种分类。归类后,根据每个OUT中序列的条数,从而得到OUT丰度表,最后根据该OUT丰度进行后续分析 (数据库为:Findley ITS Database(ITS))。
数据处理用Excel 2003完成,采用SPSS 20.0统计软件进行单因素方差分析(LSD法),处理之间的显著性分析均在<0.05 水平下进行。
2 结果与分析
2.1 高通量测序序列预处理结果
不同程度重金属污染水平下真菌群落结构的变化通过Illumina HiSeq高通量测序进行分析,高通量测序获得了883 206条原始序列,除去质量差的及嵌合体的序列,保留了863 969个序列,平均长度为240.14 bp。利用usearch在0.97相似度下进行聚类,对聚类后的序列进行嵌合体过滤后得到1 926个OUT,平均每个样品有544 ± 26.95个OUT。由于不同样本对应的reads数量差距较大,为了保证后期分析结果合理,对每个样本的数据进行随机抽平处理,抽平参数根据alpha多样性指数的稀释曲线确定为39 705条reads,抽平后总OUT数是1 926,平均OUT数是543.81。
2.2 不同程度重金属污染土壤的真菌丰度及多样性分析
由表5可知,与对照P0相比,重金属污染土壤的真菌丰度均显著减少,但不同浓度重金属污染处理之间的差异不显著。真菌的香浓指数和辛普森指数均没有显著差异,但是重金属污染对真菌的丰富度有显著影响,与对照相比,P5处理Chao1指数虽然增加,但是差异不显著,中、低浓度重金属污染差异显著,丰富度指数显著降低,且随着污染程度的降低,丰富度指数降低。

表5 不同程度重金属污染土壤真菌的丰度、多样性指数及丰富度指数
注:同列数据小写字母不同表示不同土样间差异显著(< 0.05)。
2.3 不同程度重金属污染土壤的真菌群落结构主坐标分析
通过对不同程度重金属污染下土壤真菌的主坐标分析发现(图2),各处理间真菌群落结构发生明显的变化。PC1、PC2、PC3影响因素对样品处理差异的贡献率分别为35.96%、21.48%、11.71%,并将离污染源不同距离的采样点明显区分,大致呈现随着距污染源距离由远到近,PC1值呈现逐渐增大的趋势。P5样品作为高浓度重金属污染样品,与其余处理明显分开,说明该样品的真菌群落结构组成与其他样品有显著差异,P3、P4样品作为中浓度重金属污染样品其真菌群落结构组成较相近,P1、P2样品作为低浓度重金属污染样品其真菌群落结构组成较相近,且高中低3个程度重金属污染样品与对照P0相比,真菌群落结构组成差异显著。
2.4 不同程度重金属污染土壤的真菌类群分析
由图3可知,在所有土壤样品中检测到7个真菌门,子囊菌门(Ascomycota)为最优势门,其次是接合菌门(Zygomycota)和担子菌门(Basidiomycota),相对丰度较少的是壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、Rozellomycota和新丽鞭毛菌门(Neocallimastigomycota)。其中Basidiomycota随着重金属污染程度增加其相对丰度减少,而Chytridiomycota随着重金属污染程度增加其相对丰度增加,但是这两个门的真菌丰度在不同污染水平下差异均不显著;Zygomycota的相对丰度随着重金属污染程度降低而显著增加,与对照P0相比,P3、P4样品其丰度差异不显著,P1、P2样品中显著降低,在P5中最小;Ascomycota在重金属污染样品中的丰度与对照P0相比均显著增加;与对照P0相比,Glomeromycota相对丰度随着样品受重金属污染程度增加而增大,P4处理相对丰度最大;Rozellomycota的相对丰度在高污染样品P5中最高,并与其他处理相比差异显著;Neocallimastigomycota在P3样品中丰度最高,与其他处理相比差异显著。
进一步分析不同程度重金属污染对不同真菌属水平分布产生的影响,由表6可知,粪伞属()、假酵母状菌属()及烟管霉属()在各土样间均不存在显著差异。被孢霉属()在P0样品中丰度最大,与P3、P4土样差异不显著,与其他土样相比差异显著,且高浓度重金属污染的P5样品其丰度最小。拟拱顶菌属()和单端孢霉属()均在P1样品中丰度最高,且与其他样品差异显著;田头菇属()在P2样品中丰度最高,且与其他样品差异显著。这表明此3种真菌在较低浓度重金属污染中可以正常生长,甚至低浓度重金属会刺激其生长,增加其丰度;但高浓度重金属污染,毒性增强,会抑制其生长,从而降低其相对丰度。离壳菌属()和菇属()均在P0样品中其丰度最高,且与其他样品处理差异显著,这表明这两种真菌属对重金属污染敏感,重金属污染显著影响其生长。穗葡萄孢菌属()在高浓度重金属污染样品P5中丰度最高,且与其他样品中的丰度有显著差异,说明这种真菌在高浓度重金属污染土壤中可以更好地生长,高浓度重金属污染促进其生长。木霉属()在高浓度重金属污染样品P5中丰度最低,显著低于其他土壤样品,说明高浓度重金属污染抑制其生长。镰刀菌()的相对丰度在P0与P1、P2、P3没有显著差异,在P4、P5样品中显著降低,表明镰刀菌不耐高浓度重金属污染,当重金属污染程度较大时其丰度显著降低。水玉霉属()、四枝孢霉属()、无足孢壳属()及根囊壶菌属()这4个真菌属均在P0和P5样品中其丰度出现显著差异,P0与其他样品均没有显著差异,说明这4种真菌能承受一定浓度的重金属污染,当重金属污染程度较大时,其生长遭到抑制,丰度显著降低。类球囊霉属()在P4样品中其丰度最大,与其他处理的差异显著,在P0样品中丰度最小,表明这种真菌随着重金属污染程度的增加,其丰度增加,当达到最适重金属浓度时达到最大丰度,重金属污染程度再增加会降低其丰度。
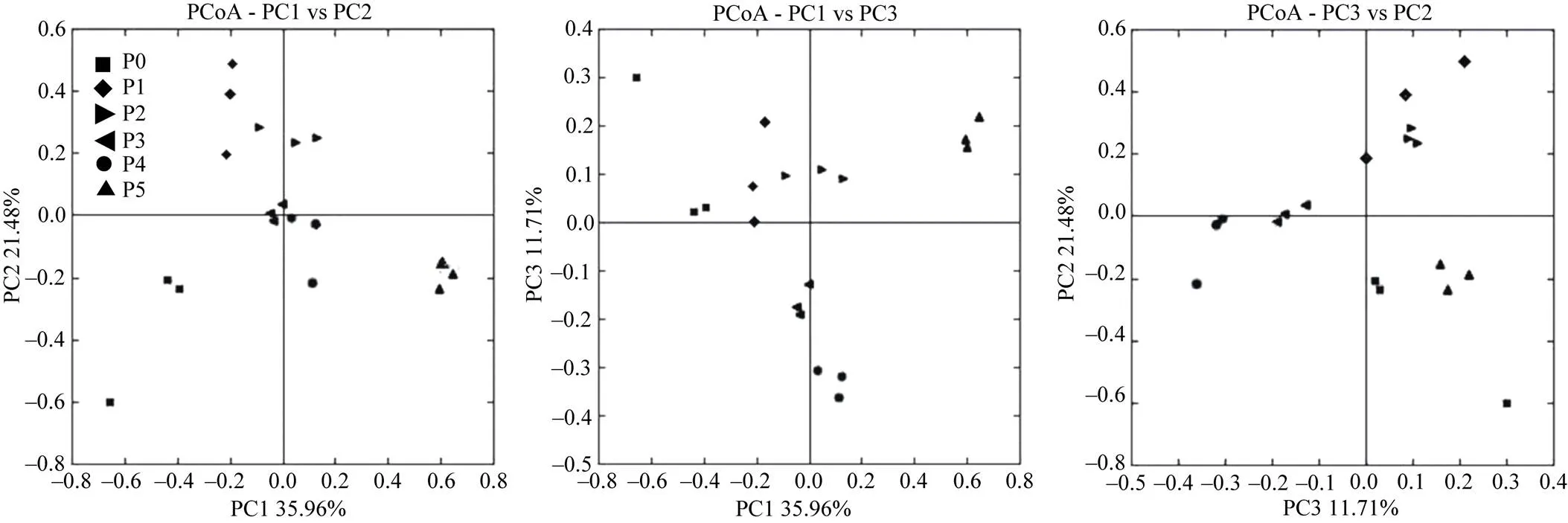
图2 不同程度重金属污染土壤的真菌主坐标分析

图3 不同程度重金属污染土壤中主要真菌门的相对丰度
2.5 不同程度重金属污染土壤的真菌群落结构组成与环境因子的冗余分析
为进一步了解土壤不同重金属污染元素与真菌群落结构多样性变化的对应关系,引入了RDA分析。由图4可知,重金属污染对真菌群落结构的影响显著,影响程度最大的环境因子是全量Pb和全量Cu,其次是有效态Cu和Pb。其中全量Pb与Cd、Zn呈负相关关系,与Cu是正相关关系;有效态Zn与Cd呈负相关关系,与Cu、Pb呈正相关关系。总量Pb对样品的影响程度最大,对真菌群落结构的影响差异显著。

表6 不同程度重金属污染下土壤优势真菌属的相对丰度(%)
注:数据是平均值,同一行数据小写字母不同表示同一真菌属相对丰度在不同土样间差异达到<0.05显著水平。

图4 不同程度重金属污染土壤真菌冗余分析(RDA)
3 讨论
不同重金属元素对土壤真菌群落结构影响不同。本研究通过RDA分析发现,重金属Pb和Cu污染对真菌群落结构的影响最显著,Cd次之,Zn的影响最小,且Cd、Pb、Cu和Zn 4种金属元素对真菌群落结构的复合效应机制表现为协同效应和拮抗效应并存,这与韩桂琪等[28]研究结果相似。在对重金属污染下红壤微生物群落结构变化的研究中发现,Cd、Cu对供试土壤微生物学指标的毒性影响较为明显,Zn次之,Pb的影响最小[29];杨晔等[30]认为Cd对真菌的抑制比较明显。造成这种不同重金属元素影响能力不同的原因可能是供试土样的重金属元素浓度、土壤类型和基本性质等不同,从而使不同重金属元素的生物毒性出现差异。
野外长期的重金属污染会显著降低真菌丰度,改变土壤中微生物耐性菌的比例。通过分析不同程度重金属污染下稻田土壤真菌属水平下的相对丰度变化情况可知,类球囊霉属、青霉属等真菌其相对丰度均在重金属污染严重的土壤样品中存在显著增加趋势,其中类球囊霉属随着重金属污染程度增加,其相对丰度显著增高,说明这类真菌对重金属有一定的耐性。这与孔凡美[31]的研究结果相似,其在沈阳矿区重金属污染土壤中发现类球囊霉属的相对丰度显著增高,而类球囊霉属中有些菌种属于丛枝菌根真菌,对重金属污染具有较强的耐性和适应能力,这些丛枝菌根真菌能够改善植物生长状况,减轻重金属对植物的毒害。杜立栋等[32]研究发现某株青霉菌真菌可富集土壤中的可溶态铅离子,最高富集率达96.54%,而青霉能够产生草酸与重金属发生化学反应,生成不溶性的草酸盐,减少Pb的毒性。在高浓度铜离子培养基中,真菌抗铜菌株青霉可以诱导细胞合成高浓度的甘油帮助其排出过量的铜离子[33]。这些研究结果均表明,重金属污染会增加耐性菌的数量,改变土壤中的优势菌群结构,进一步改变微生物群落结构。
重金属污染还会显著影响土壤中敏感菌的比例。本研究中被孢霉属、离壳菌属与菇属对重金属比较敏感,在重金属污染水稻土中其相对丰度均明显降低,且被孢霉属相对丰度随着重金属污染程度增加而显著降低。被孢霉属可生产多不饱和脂肪酸,是被认为最有前途的工业生产多不饱和脂肪酸的微生物,而且被孢霉属有的菌种可以兼性寄生于线虫卵囊、卵和雌虫,杀死线虫[34-35]。木霉属和镰刀菌的相对丰度只在重金属污染严重的土壤样品中显著降低,可能原因是这两种真菌具有一定的重金属抗性,但是当重金属浓度过高时,其生长受到显著抑制,相对丰度显著降低。木霉属的某些菌种如绿色木霉菌对重金属污染有一定的耐受能力,能耐受Pb2+浓度为2 000 mg/L[36],已有研究也发现了一种耐受重金属的非致病内生尖孢镰刀菌可以促进超积累植物提取和积累重金属的功能[37],而从铅锌尾矿废弃地分离出耐重金属Cd的尖孢镰刀菌的耐Cd浓度是15 mmol/L[38]。
这些研究均表明,长期重金属污染胁迫会改变真菌群落结构组成,使某些在没有污染胁迫的土壤中不占优势,但具有某些特殊功能而在重金属污染环境中正常生活的微生物成为优势种群。造成这种现象的可能原因是,重金属污染胁迫改变原有的群落结构内部种群竞争关系,导致原来的优势种群失去优势地位,耐性菌群快速生长,成为重金属污染环境中的优势种群[39];或者是一部分微生物在长期重金属污染环境中产生的重金属抗性,保护了其他种群的微生物,从而使重金属污染土壤的优势种群发生了明显改变[40]。
4 结论
综上所述,重金属污染会显著改变土壤真菌的丰度和群落结构,其中重金属Pb和Cu对真菌群落结构的影响最大,且随着污染程度增加,真菌群落结构组成发生了显著变化,抗逆真菌相对数量和种类显著增加,敏感真菌的相对数量急剧减少,如对重金属较敏感的被孢霉属等的相对丰度显著降低,而耐性菌如类球囊霉属的相对丰度显著增加,敏感菌降低,耐性菌增加,且随着污染程度的增加,微生物群落结构进一步分化,这使得微生物群落对环境胁迫的适应能力进一步增强。
[1] 高林, 张继光, 吴元华, 等. 镉污染对烤烟根际土壤细菌和真菌群落结构的影响[J]. 土壤通报, 2015, 46(3): 628–632
[2] 王建坤. 铅锌污染对土壤微生物多样性的影响[D]. 成都: 四川农业大学, 2009: 1–49
[3] Bååth E. Effects of heavy metals in soil on microbial processes and populations (a review)[J].Water, Air and Soil Pollution, 1989, 47(3): 335–379
[4] 孙波, 赵其国, 张桃林, 等. 土壤质量评价的生物学指标[J]. 土壤, 1997, 29(5): 225–341
[5] 贺枫. 重金属污染对水稻土团聚体有机碳矿化及微生物群落结构和功能的影响[D]. 南京: 南京农业大学, 2013: 1–69
[6] Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of America Journal, 2006, 70(2): 555–569
[7] Nordgren A, Bååth E, Söderström B. Microfungi and microbial activity along a heavy metal gradient[J]. Applied and Environmental Microbiology, 1983, 45(6): 1829–1837
[8] 王芳. 呼伦贝尔草原蒙古白丽蘑蘑菇圈土壤真菌多样性研究[D]. 长春: 吉林农业大学, 2013: 1–76
[9] Holland E A, Coleman D C. Litter placement effects on microbial and organic matter dynamics in an agroecosystem[J]. Ecology, 1987, 68(2): 425–433
[10] Sakamoto K, Oba Y. Effect of fungal to bacterial biomass ratio on the relationship between CO2evolution and total soil microbial biomass[J]. Biology and Fertility of Soils, 1994, 17(1): 39–44
[11] 郁艳红, 曾光明, 胡天觉. 真菌降解木质纤维素研究进展及在好氧堆肥中的研究展望[J]. 中国生物工程杂志, 2003, 23(20): 57–61
[12] Johansson G, Ståhlberg J, Lindeberg G, et al. Isolated fungal cellulose terminal domains and a synthetic minimum analogue bind to cellulose[J]. Febs. Letters, 1989, 243(2): 389–393
[13] Anderson J P E, Domsch K H. Measurement of bacterial and fungal contributions to respiration of selected agricultural and forest soils[J]. Canadian Journal of Microbiology, 1975, 21(3): 314–322
[14] Susyan E A, Ananyeva N D, Blagodatskaya E V. The antibiotic-aided distinguishing of fungal and bacteria substrate-induced respiration in various soil ecosystems[J]. Microbiology, 2005, 74(3): 394–400
[15] Liu Y, Zhou T, Crowley D, et al. Decline in topsoil microbial quotient, fungal abundance and C utilization efficiency of rice paddies under heavy metal pollution across South China[J]. PLoS One, 2012, 7(6): e38858
[16] Bailey V L, Smith J L, Jr H B. Fungal-to-bacterial ratios in soils investigated for enhanced C sequestration[J]. Soil Biology and Biochemistry, 2002, 34(7): 997–1007
[17] Kandeler F, Kampichler C, Horak O. Influence of heavy metals on the functional diversity of soil microbial communities[J]. Biology and Fertility of Soils, 1996, 23(3): 299–306
[18] Fließbach A, Martens R, Reber H H. Soil microbial biomass and microbial activity in soils treated with heavy metal contaminated sewage sludge[J]. Soil Biology and Biochemistry, 1994, 26(9): 1201–1205
[19] 吴建军, 蒋艳梅, 吴愉萍, 等. 重金属复合污染对水稻土微生物生物量和群落结构的影响[J]. 土壤学报, 2008, 45(6): 1102–1109
[20] 李晔, 孙丽娜, 杨继松, 等. 基于PCR-DGGE的重金属污染土壤微生物种群指纹分析[J]. 生态环境学报, 2010, 19(9): 2204–2208
[21] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000: 12–227
[22] 崔立强. 生物黑炭抑制稻麦对污染土壤中Cd/Pb吸收的试验研究[D]. 南京: 南京农业大学, 2011: 1–113
[23] Nemerow N L. Stream, lake, estuary and ocean pollution[M]. Van Nostrand Reinhold Publishing Co, New York. 1991: 1–472
[24] May L A, Smiley B, Schmidt M G. Comparative denaturing gradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage[J]. Canadian Journal of Microbiology, 2001, 47(9): 829–841
[25] 夏围围, 贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报, 2014, 54(12): 1489– 1499
[26] 王绍祥, 杨洲祥, 孙真, 等. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196–203
[27] 楼骏, 柳勇, 李延, 等. 高通量测序技术在土壤微生物多样性研究中的应用[J]. 中国农学通报, 2014, 30(15): 256–260
[28] 韩桂琪, 王彬, 徐卫红, 等. 重金属 Cd、Zn、Cu 和Pb复合污染对土壤生物活性的影响[J]. 中国生态农业学报, 2012, 20(9): 1236–1242
[29] 滕应, 黄昌勇, 骆永明, 等. 重金属复合污染下红壤微生物活性及其群落结构的变化[J]. 土壤学报, 2005, 42(5): 819–828
[30] 杨晔, 陈英旭, 孙振世. 重金属胁迫下根际效应的研究进展[J]. 农业环境科学学报, 2001, 20(l): 55–58
[31] 孔凡美. 重金属污染土壤中丛枝菌根菌的种群分布特征与菌根效应研究[D]. 山东泰安: 山东农业大学, 2003: 1–95
[32] 杜立栋, 王有年, 李奕松, 等. 微生物对土壤中铅富集作用的研究[J]. 北京农学院学报, 2008, 23(1): 38–41
[33] 曹霞. 耐铅镉微生物筛选及其对污染土壤铅镉化学形态的影响[D]. 武汉: 华中农业大学, 2009: 1–62
[34] Vadivelan G, Venkateswaran G. Production and enhancement of omega-3 fatty acid from Mortierellaalpina CFR- GV15: its food and therapeutic application[J]. Biomed Research International, 2014, 4: 9
[35] 朱海, 关贵全, 任巧云, 等. 土壤中食线虫真菌的分离与鉴定[J]. 中国兽医科学, 2013, 43(9): 881–887
[36] 靳治国. 耐铅锡菌株的筛选及其在污染土壤修复中的应用[D]. 重庆: 西南大学, 2010: 1–68
[37] 张新成. 东南景天内生菌分离鉴定及其强化重金属超积累效应与机制[D]. 杭州: 浙江大学, 2012: 1–189
[38] 隆美容, 谢小林, 冯广达, 等. 铅锌尾矿中耐重金属镉的丝状真菌的分离鉴定[J]. 微生物学通报, 2013, 40(12): 2203–2216
[39] 谢学辉, 范凤霞, 袁学武, 等. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 2012, 39(5): 624–637
[40] 郭建华, 李华平, 朱红惠. 大宝山重金属污染土壤微生物群落优势种群分析[J]. 华南农业大学学报, 2010, 31(3): 56–60, 89
Effects of Different Gradients of Heavy Metal Contamination on Soil Fungi Community Structure in Paddy Soils
YAN Hua, OUYANG Ming, ZHANG Xuhui*, YING Duo, ZHAO Xijun, ZHANG Yujiao, ZHENG Jufeng, LIU Xiaoyu, BIAN Rongjun, LI Lianqing, PAN Genxing
(Institute of Resource, Ecosystem and Environment of Agriculture, Nanjing Agricultural University, Nanjing 210095, China)
Fungi community structure in paddy soils in south Jiangsu under different gradients of heavy metal pollution was analyzed in order to study the impact of heavy metal pollution on the microbial variability. The results showed that heavy metal pollution has significant impact on fungi number and community structure in paddy soil. Principal coordinate analysis (PCoA) revealed that the first and second components accounted for 35.96% and 21.48% of contribution rates, respectively. The results of redundancy analysis (RDA) showed that Pb and Cu greatly influenced fungi community structure. Relative abundance analysis of fungi at genus taxonomic level showed that heavy metal pollution significantly reduced the population of sensitive fungi but increased the population of patience fungi. Sensitive fungi genus included Mortierella, Trichoderma, Apodus and Hypholoma, wheras patience fungi genus included Paraglomus, Tetracladium and Rhizophydium. In conclusion, heavy metal-contamination can significantly influences soil fungi community structure in paddy soils, increasing heavy metal concentration can increase the population and diversity of heavy metal tolerant fungi and decrease sensitive fungi, which furtherly increases the differentiation of the structure of fungi community.
Heavy metal pollution; Paddy soil; Fungi community structure; Illumina HiSeq sequencing
国家自然科学基金项目(41471193)和江苏高校品牌专业建设工程项目(PPZY2015A061)资助。
(xuhuizhang@njau.edu.cn)
闫华(1990—),女,山东枣庄人,硕士研究生,主要研究方向为土壤环境学。E-mail: 2014103102@njau.edu.cn
10.13758/j.cnki.tr.2018.03.011
X53;S154
A

