铝改性秸秆生物质炭去除水体中的大肠杆菌①
钱 薇,赵安珍,刘兆东,王如海,唐昊冶,俞元春,徐仁扣*
铝改性秸秆生物质炭去除水体中的大肠杆菌①
钱 薇1,2,赵安珍1,刘兆东1,王如海1,唐昊冶1,俞元春2*,徐仁扣1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 南京林业大学南方现代林业协同创新中心,南京林业大学生物与环境学院,南京 210037)
用一次平衡实验和柱淋溶实验研究了秸秆生物质炭和铝改性秸秆生物质炭对水中大肠杆菌的吸附量和去除率。结果表明,未改性秸秆生物质炭对大肠杆菌的吸附量很低,铝改性秸秆生物质炭对大肠杆菌有很高的吸附容量和去除率,0.6 mol/L Al(III) 改性生物质炭对大肠杆菌的去除效果优于0.3 mol/L Al(III) 改性生物质炭。当大肠杆菌浓度低于0.63 mg/ml时,铝改性大豆秸秆炭对大肠杆菌的去除率达100%,铝改性花生秸秆炭和铝改性稻草炭对大肠杆菌的去除率在96% 和90% 以上。0.5 mg/ml的大肠杆菌悬液通过装有2 g铝改性稻草炭的淋溶柱,每次收集10 ml淋出液,共收集152次,大部分淋出液中大肠杆菌浓度小于0.02 mg/ml,大肠杆菌去除率在95% 以上。因此,铝改性生物质炭可用于水体中大肠杆菌的去除。
秸秆生物质炭;铝改性生物质炭;大肠杆菌;吸附;去除
大肠杆菌是水体中常见的致病微生物,饮用含大肠杆菌的水影响人和动物的健康。我国2006年颁布的《生活饮用水卫生标准》(GB5749-2006)中专门规定了总大肠杆菌和耐热大肠杆菌的指标。因此,有效去除水体中的大肠杆菌对保障饮水安全具有重要意义。
生物质炭是由植物生物质在完全或部分缺氧的情况下经热解炭化产生的一类高度芳香化难溶性固态物质[1]。我国农业生产中每年都产生大量农作物秸秆等农业废弃物,将这些农业有机废弃物经过厌氧低温热解可制备成秸秆生物质炭,它是一种优良的吸附剂和土壤改良剂[2-4]。生物质炭表面一般带负电荷[5]细菌的大小在微米级,它主要以胶体颗粒状悬浮于水体中,其表面也带负电荷[6-7]。因此,带负电荷的生物质炭与带负电荷的细菌之间存在静电排斥力,只有当两者之间的范德华引力大于静电斥力时才能发生吸附作用;另一方面,酸性条件下铁铝氧化物表面一般带正电荷,因此细菌在铁铝氧化物表面可发生很强的吸附作用[6-8],富含铁铝氧化物的可变电荷土壤对细菌也有很高的吸附容量[9-10]。如能用铁铝离子对生物质炭进行表面改性,应可提高生物质炭对细菌的吸附能力。本文用Al(III) 对3 种秸秆生物质炭进行改性,比较了改性前后生物质炭对大肠杆菌的吸附作用的变化,研究结果可为水体中细菌去除方法的建立提供参考。
1 材料与方法
1.1 改性生物质炭的制备
试验用大豆秸秆、花生秸秆和稻草均采自江苏南京。分别将风干、粉碎过0.83 mm孔径筛的秸秆装入陶瓷坩埚中,轻轻压实,盖好后放入马弗炉中,按20℃/min的速度将温度升至350 ℃,保持225 min,待马弗炉冷却至室温,取出炭化产物,磨细过0.25 mm孔径筛备用[11]。
铝改性秸秆生物质炭的制备步骤如下:在磁力搅拌条件下将20 g生物质炭添加到200 ml 初始浓度为0.3 mol/L的AlCl3溶液中,再用0.5 mol/L NaOH将pH调至7.0,维持2 h。于25 ℃恒温培养箱中放置48 h后离心分离,用去离子水洗涤1次,再用酒精洗至无Cl-[8]。室温下风干、磨细过0.25 mm筛。用相同方法将生物质炭与0.6 mol/L的AlCl3溶液反应制备0.6 mol/L铝改性生物质炭。
1.2 Zeta电位测量
称取过0.04 mm筛的0.050 g生物质炭和改性生物质炭于250 ml锥形瓶中,分别加入0.1 mmol/L NaNO3溶液200 ml以制备悬液。将悬液用超声波分散1 h,分置于6个100 ml塑料瓶中,用HNO3和NaOH调节pH至4.0 ~ 9.0,待pH稳定后,在恒温下放置24 h,用Zeta电位仪(ZetaPlus, Brookhaven Instruments, New York, USA)测定胶体悬液的Zeta电位[12]。
1.3 细菌处理
供试菌株为大肠杆菌(,编号: 1.2389),购买自中国科学院微生物研究所菌种保藏中心。细菌培养及收集过程如下:37 ℃下在牛肉膏蛋白胨培养基中振荡培养15.5 h, 在8 000 g下离心获得菌体,然后用去离子水洗涤3次,最后将细菌起悬,分散后用紫外可见分光光度计(上海美谱达仪器有限公司,UV-3000)在420 nm处调节悬液中细菌的浓度使吸光度为1.2,此时菌液的浓度为2.5 mg/ml,细菌的数量大约为1.144´109cfu/ml,细菌的重量为鲜重[7,13]。然后将细菌悬液稀释成0.5、1.0、1.5、2.0和 2.5 mg/ml,分别测定它们的吸光度制作细菌浓度与吸光度的标准曲线。
1.4 改性前后生物质炭对大肠杆菌吸附量比较
吸附实验:称取30 mg生物质炭或改性生物质炭,分别加入10、12.5、15、17.5、20、22.5和25 ml起悬菌液,用去离子水和NaCl溶液将溶液总体积调至30 ml,背景电解质浓度为1 mmol/L NaCl,pH调节至6.0左右。25 ℃、20 r/min旋转振荡70 min后,往离心管底部加入3 ml蔗糖溶液(质量浓度60%),在4 000g下离心分离,吸取上层溶液,用分光光度计测定未被吸附的细菌的吸光度,由加入细菌量与平衡液中未被吸附的细菌量之间的差值计算生物质炭对细菌的吸附量[13]。
1.5 淋溶条件下改性生物质炭对大肠杆菌的去除效果
在内径2 cm、长9 cm的玻璃淋溶柱底部铺一层尼龙布,在尼龙布上均匀铺3 g 20目石英砂,再铺2 g 60目的石英砂,然后在石英砂上部均匀装入2 g铝改性稻草炭,在稻草炭上部铺一层尼龙布。用蠕动泵从淋溶柱上部均匀加入含0.5 mg/ml大肠杆菌的水,从淋溶柱底部收集淋出液,每10 ml为一次采样。用分光光度法测得淋出液中大肠杆菌的浓度,计算大肠杆菌的去除率。
2 结果与讨论
2.1 铝改性前后生物质炭对大肠杆菌的吸附量与去除率
图1为大肠杆菌在未改性大豆秸秆炭和铝改性大豆秸秆炭表面的吸附量。大肠杆菌在未经改性的大豆秸秆炭表面的吸附量较低,但经过铝改性后,大肠杆菌在生物质炭表面的吸附量显著提高。0.6 mol/L Al(III) 改性的大豆秸秆炭表面大肠杆菌的吸附量显著高于0.3 mol/L Al(III) 改性的大豆秸秆炭,因此用0.6 mol/L Al(III) 改性秸秆生物质炭所获得的吸附剂对大肠杆菌的吸附效果更好。生物质炭对大肠杆菌的吸附量也随大肠杆菌浓度的增加而增加。根据图1中的吸附量和平衡浓度可计算生物质炭对大肠杆菌的去除率,当大肠杆菌初始浓度小于0.63 mg/ml时,0.6 mol/L Al(III) 改性大豆秸秆炭对大肠杆菌的去除率均达100%;大肠杆菌初始浓度为0.83 mg/ml时,0.6 mol/L Al(III) 改性大豆秸秆炭对大肠杆菌的去除率也达96%。在上述浓度范围内,未改性大豆秸秆炭对大肠杆菌的去除率在55% ~ 78%,远低于铝改性大豆秸秆炭。虽然未改性生物质炭表面带负电荷,对同样带负电荷的大肠杆菌存在静电排斥力,但由于两者之间存在范德华引力(分子间作用力),当后者大于前者时,生物质炭能够吸附一定量的大肠杆菌。但与Al(III) 改性生物质炭相比,其对大肠杆菌的吸附量要低得多。
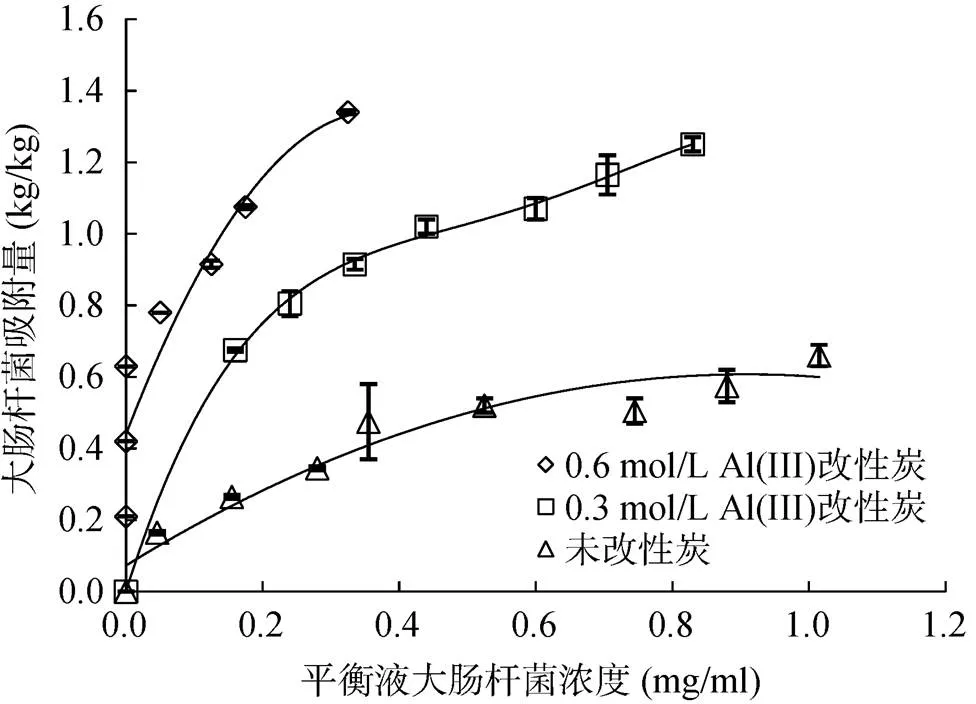
图 1 未改性和不同初始浓度铝改性的大豆秸秆炭对不同初始浓度大肠杆菌吸附量的比较
0.6 mol/L Al(III) 对花生秸秆炭进行改性,所获得的铝改性花生秸秆炭对大肠杆菌的吸附量列于图2。与0.6 mol/L Al(III) 改性的大豆秸秆炭相似,铝改性花生秸秆炭对大肠杆菌也有很高的吸附量,而未改性花生秸秆炭对大肠杆菌的吸附量很小。当大肠杆菌的初始浓度低于0.42 mg/ml时,铝改性花生秸秆炭对大肠杆菌的去除率达100%;当大肠杆菌初始浓度为0.63 mg/ml时,铝改性花生秸秆炭对大肠杆菌去除率达96%。在上述浓度范围内,未改性花生秸秆炭对大肠杆菌的去除率在11% ~ 30%。因此,铝改性花生秸秆炭对水中大肠杆菌有很高吸附量和去除率。

图2 未改性和铝改性花生秸秆炭对不同初始浓度大肠杆菌的吸附量
进一步用0.6 mol/L Al(III) 对稻草炭进行改性,并研究铝改性稻草炭对大肠杆菌的吸附量。结果表明,在较低初始浓度下,铝改性稻草炭对大肠杆菌的吸附量虽略低于铝改性大豆秸秆炭和铝改性花生秸秆炭,但仍比未改性稻草炭对大肠杆菌的吸附量高得多(图3)。从图3中计算稻草炭和铝改性稻草炭对大肠杆菌的去除率,当大肠杆菌的初始浓度小于0.63 mg/ml时,铝改性稻草炭对大肠杆菌的去除率在90% 以上,但未改性稻草炭对大肠杆菌的去除率不超过28%。因此,铝改性稻草炭对大肠杆菌也有很好的去除效果。
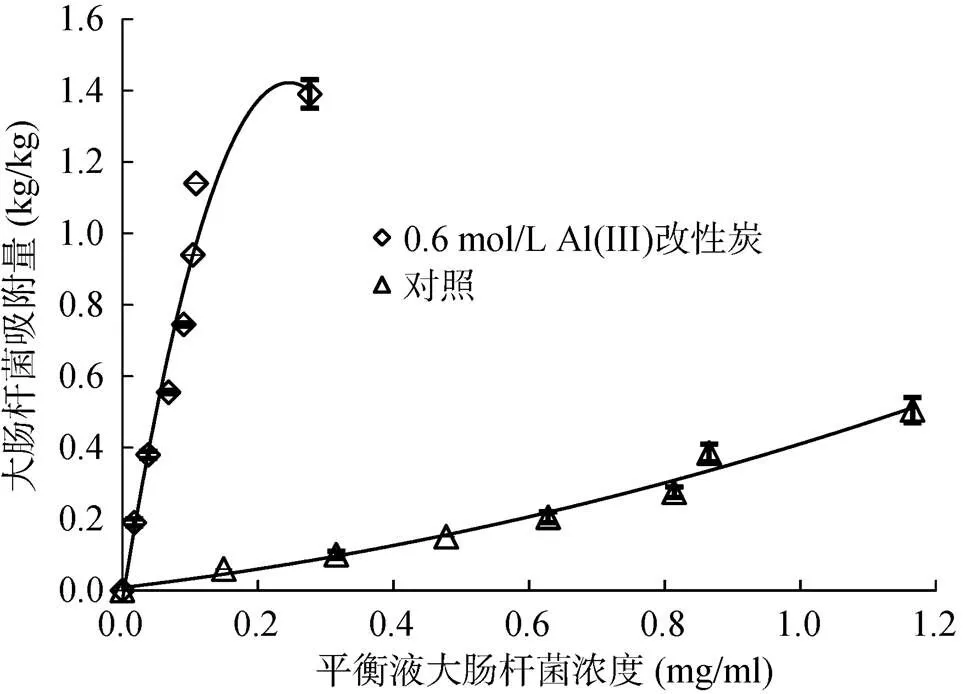
图3 未改性和铝改性稻草炭对不同初始浓度大肠杆菌的吸附量
从上述分析可以看出,0.6 mol/L Al(III) 改性的秸秆生物质炭对水中大肠杆菌均有很高的吸附容量和去除率,可用于含大肠杆菌的水的净化处理。
2.2 淋溶条件下铝改性生物质炭对大肠杆菌的去除率
为考察淋溶条件下铝改性生物质炭对大肠杆菌的去除效果,选择铝改性稻草炭用浓度为0.5 mg/ml的大肠杆菌悬液进行柱淋溶实验。淋溶实验过程中,共连续采样152次,淋出液中大肠杆菌浓度大多低于0.02 mg/ml,处于很低水平(图4)。图5显示淋溶过程中铝改性稻草炭对大肠杆菌的去除率,从152次采样中获得的大肠杆菌的去除率均在95% 以上。因此,淋溶条件下铝改性生物质炭对大肠杆菌也表现出很好的去除效果。
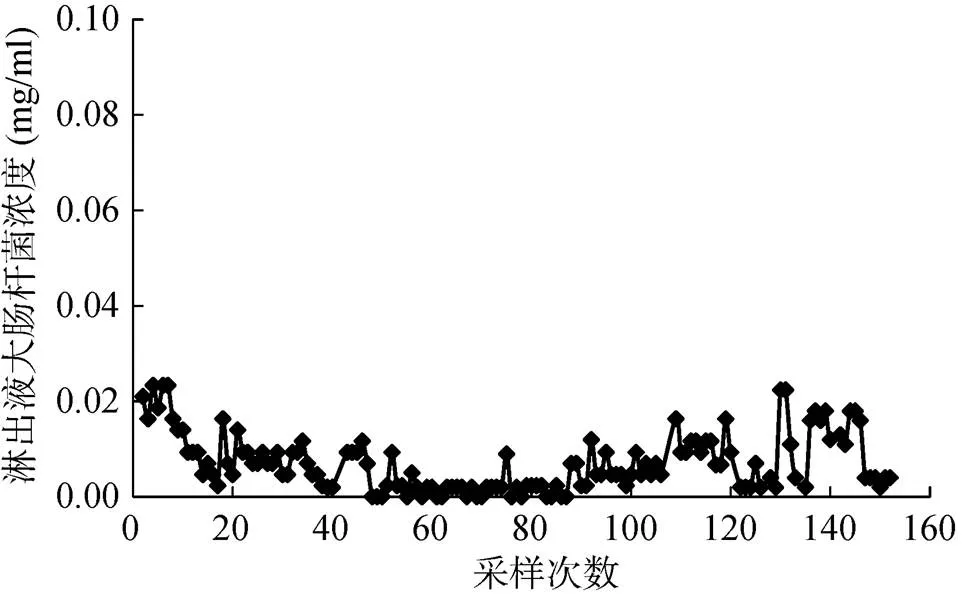
图4 含大肠杆菌的水通过装有铝改性稻草炭的淋溶柱后淋出液大肠杆菌浓度
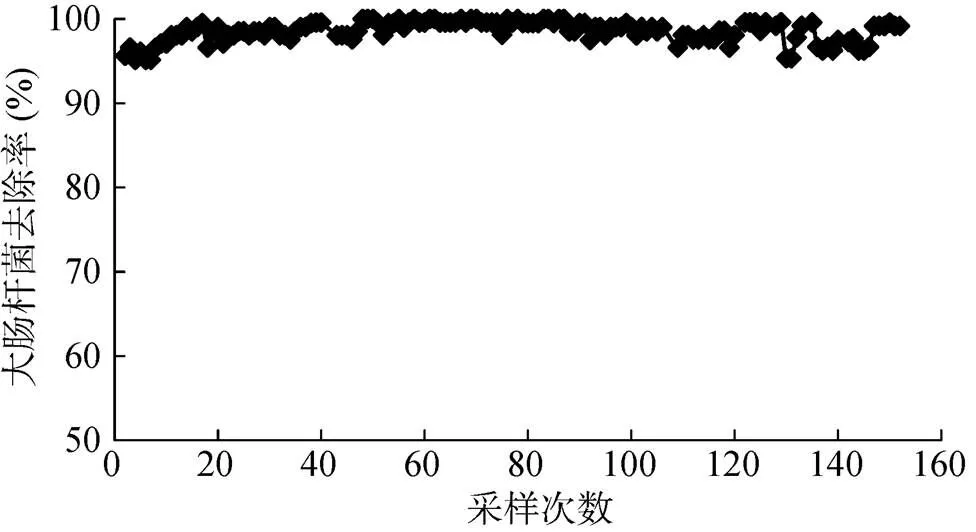
图 5 含大肠杆菌的水通过装有铝改性稻草炭的淋溶柱后大肠杆菌的去除率
2.3 铝改性生物质炭去除大肠杆菌的机制
生物质炭和大肠杆菌表面均带负电荷,两者之间存在静电排斥力[2,7]。只有当两者之间的范德华引力大于静电排斥力时,大肠杆菌才能在生物质炭表面发生吸附。当用铝对生物质炭进行改性后,生物质炭的表面电荷性质发生变化,在酸性条件下Zeta电位为正值(图6),说明酸性条件下铝改性生物质炭表面带净正电荷。因此,酸性条件下铝改性生物质炭与大肠杆菌之间的静电引力和范德华引力使大肠杆菌在铝改性生物质炭表面发生较强的吸附作用。这是铝改性生物质炭对大肠杆菌有很高的去除率的主要原因。另外,大肠杆菌表面丰富的含氧官能团可与改性生物质炭表面的铝形成化学键[8,14],进一步促进大肠杆菌在生物质炭表面的吸附。
在铝改性生物质炭过程中,随着NaOH的加入,体系中铝离子发生水解形成羟基铝聚合物和氢氧化铝沉淀,这些羟基铝和氢氧化铝在酸性条件下带大量正电荷[7],他们分散并结合在生物质炭表面,使生物质炭的表面电荷性质发生改变,从而有利于细菌等微生物在生物质炭表面的吸附。
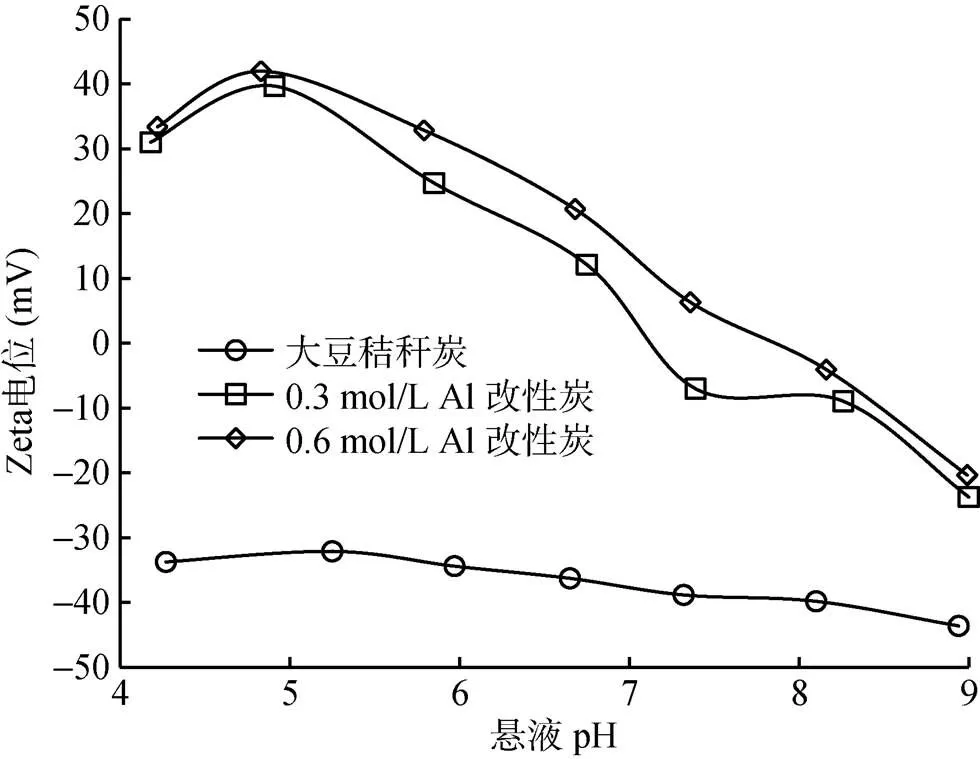
图6 大豆秸秆炭和铝改性大豆秸秆炭的Zeta电位
3 结论
铝改性秸秆生物质炭对大肠杆菌有很高的吸附容量和去除率,可以用作高效吸附剂去除水体中的大肠杆菌。
[1] Sohi S P, Krull E, Lopez-Capel E, et al. A review of biochar and its use and function in soil[J]. Advances in Agronomy, 2010, 105: 47–82
[2] Xu R K, Qafoku N P, Van Ranst E, et al. Adsorption properties of subtropical and tropical variable charge soils: Implications from climate change and biochar amendment[J]. Advances in Agronomy, 2016, 135: 1–58
[3] 索龙, 潘凤娥, 胡俊鹏, 等. 秸秆及生物质炭对砖红壤酸度及交换性能的影响[J]. 土壤, 2015, 47(6): 1157–1162
[4] 刘荣琴, 钱林波, 晏井春, 等. pH及共存金属离子对生物质炭吸附铅稳定性的影响[J]. 土壤, 2017, 49(3): 467–475
[5] Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488–3497
[6] 荣兴民, 黄巧云, 陈雯莉, 等. 土壤矿物与微生物相互作用的机制及其环境效应[J]. 生态学报, 2008, 28(1): 376–387
[7] Liu Z D, Wang H C, Li J Y, et al. Adhesion ofandto amorphous Fe and Al hydroxides and their effects on the surface charges of the hydroxides[J]. Journal of Soils and Sediments, 2015, 15(11): 2293–2303
[8] Hong Z N, Li J Y, Jiang J, et al. Competitive adsorption between bacteria and phosphate on gibbsite: An in situ ATF-FTIR spectroscopic and macroscopic study[J]. Colloids and Surfaces B: Biointerfaces, 2016, 148: 496– 502
[9] 赵炳梓, 蒋艳. 外源细菌添加对红壤吸附病毒的影响[J]. 土壤学报, 2014, 51(3): 505–512
[10] 赵文强, 刘星, 蔡鹏, 等. 病原菌在红壤胶体上的吸附机制研究[J]. 土壤学报, 2013, 50(2): 221–229
[11] 佟雪娇, 李九玉, 姜军, 等. 添加秸秆生物质炭对红壤吸附Cu(II)的影响[J]. 生态与农村环境学报, 2011, 27(5): 37–41
[12] 水相Cr(VI)的吸附试验[J]. 生态与农村环境学报, 2014, 30(4): 500–504
[13] 蒋代华, 黄巧云, 蔡鹏, 等. 粘粒矿物对细菌吸附的测定方法[J]. 土壤学报, 2007, 44(4): 656–662
[14] Rong X M, Chen W L, Huang Q Y, et al.adhesion to goethite: Studied by equilibrium adsorption, SEM, FTIR and ITC[J]. Colloids Surfaces B: Biointerfaces, 2010, 80(1), 79–85
Removal offrom Water Using Al(III)-modified Crop Straw Biochars
QIAN Wei1,2, ZHAO Anzhen1, LIU Zhaodong1, WANG Ruhai1, TANG Haoye1, YU Yuanchun2*, XU Renkou1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 Co-Innovation Center for the Sustainable Forestry in Southern China, College of Biology and Environment, Nanjing Forestry University, Nanjing 210037, China)
Batch and leaching experiments were conducted to investigate the adsorption and removal of()from water by crop straw biochars and Al(III)-modified biochars. Results indicated that the amount ofadsorbed by non-modified crop straw biochars was very low, while Al(III)-modified crop straw biochars showed great adsorption capacity and high removal efficiency for. The adsorption capacity of the biochars modified by 0.6 mol/L Al(III) was greater than that of the biochars modified by 0.3 mol/L Al(III). When the concentration ofwas less than 0.63 mg/ml, the removal percentage ofwas 100% by Al(III)-modified soybean straw biochar and more than 96% and 90% by Al(III)-modified peanut straw bioachar and Al(III)-modified rice straw biochar, respectively. In leaching experiment, when the suspension of 0.63 mg/mlpassed through the leaching column containing 2 g Al(III)-modified rice straw biochar, 152 leachates were continuously collected with each leachate of 10 ml. The concentration ofin most leachates was less than 0.02 mg/ml and the removal percentage offrom the suspension was above 95%. Therefore, Al(III)-modified crop straw biochars can be used to removefrom water efficiently.
Crop straw biochar; Al(III)-modified crop straw biochar;; Adsorption; Removal
国家自然科学基金项目(41571233,31670615,31270664)资助。
(rkxu@issas.ac.cn;ycyu@njfu.edu.cn)
钱薇 (1968—),女,江苏南京人,高级工程师,主要从事土壤分析及相关研究。E-mail: wqian@issas.ac.cn
10.13758/j.cnki.tr.2018.03.010
X131.3
A

