不同强度超声波对多孔钛合金支架上成骨细胞生物学行为的影响
秦丽梅,吴琳,吴镇先
(中国医科大学附属口腔医院修复一科,辽宁省口腔医学研究所,沈阳 110002)
低强度脉冲超声 (low-intensity pulsed ultrasound stimulation,LIPUS) 是一种以超声波为形式的机械波,其强度范围通常在5~100 mW/cm2之间,主要通过机械作用调节人体局部微环境从而促进成骨[1-2]。美国食品和药品管理部门于1994年和2000年相继批准了在临床上应用LIPUS治疗新鲜骨折和骨不连,2017年英国医学期刊出版了LIPUS治疗骨折愈合的最新临床实用指南[3]。LIPUS与人工骨修复材料联合应用对骨缺损修复的作用近年来日益受到关注。医用多孔钛合金支架具有良好的生物相容性、骨传导性和机械性能,已应用于临床多领域。微弧氧化(micro-arc oxidation,MAO) 技术能在金属材料表面构建具有多孔结构的氧化膜层,该层富含钙、磷等离子,可提高材料的抗腐蚀性和生物活性,有利于成骨,是钛金属表面处理的新技术[4-5]。因此,表面经MAO处理的多孔钛合金 (micro-arc oxidation treated titanium alloy,MT) 支架可能会是一种是非常适宜修复骨缺损的支架材料。LIPUS的生物学效应与其作用的时间、强度、频率等参数密切相关。因此,在研究LIPUS联合多孔MT材料用于大面积骨缺损修复时明确最优的超声参数非常重要。本研究将多孔MT与MC3T3-E1成骨细胞复合培养,从细胞黏附、细胞增殖和细胞分化几个方面评价不同强度LIPUS刺激对支架材料上成骨细胞的生物学行为的影响,筛选出最适宜的LIPUS强度参数,为进一步研究LIPUS作用下高强韧多孔钛人工骨材料的生物学作用及机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 多孔MT:由中国科学院金属研究所制作提供,样品为直径10 mm、高度2 mm的圆柱体,孔径400~500 µm,孔隙率65%~70%。依次用丙酮、75%乙醇、去离子水清洗样品,并高温高压灭菌后备用。细胞接种前4 h将多孔MT材料放入培养液中抽真空4 h,吸除材料内气体并使材料达到预湿润状态。
1.1.2 细胞:小鼠MC3T3-E1成骨细胞由中国医科大学附属口腔医院中心实验室提供。
1.1.3 主要仪器与试剂:Sonicator 740型超声波发生器 (美国Mettler Electronics公司),LSRFortessa 流式细胞仪 (美国BD公司) ,Hitachi S-3400N扫描电子显微镜 (scanning electron microscope,SEM) (日本HITACHI公司) ,超声耦合剂 (美国Sonic Relief公司) ,ALP试剂盒 (南京建成有限公司) ,MTT和DMSO (美国Sigma公司) ,碘化丙啶染液和BCA总蛋白试剂盒(北京鼎国试剂公司) 。
1.2 实验方法
1.2.1 实验分组:将多孔MT支架材料随机分为5组(0 MT、10 MT、30 MT、60 MT、100 MT组) ,分别加载不同的超声强度。
1.2.2 细胞培养:当细胞达到80%融合时,用0.25%胰酶消化细胞,吹打细胞成单细胞悬液。调整细胞悬液密度[用于SEM、MTT、细胞增殖指数(proliferation index,PI)、碱性磷 酸 酶(alkaline phosphate,ALP)检测的细胞悬液密度分别为8×105/mL、8×105/mL、2×106/mL、2×106/mL],将50 µL细 胞 悬 液 缓 慢 均匀地接种到支架材料上,静置孵育2 h后,每孔加入1 mL培养基,细胞培养箱中静置24 h使细胞贴壁稳定。将细胞脱落较多的样本丢弃,其余样本随机分为实验组和对照组,每2 d换液1次,每组保证3个样本。
1.2.3 超声加载:超声加载参数为频率1 MHz,脉冲宽度1 ms,脉冲重复频率100 Hz,20 min/次,1次/d,5组材料加载强度分别为0、10、30、60、100 mW/cm2。其中,强度0 mW/cm2组为不开功率源的假辐照。超声波辐照时,在超声探头和孔板间使用超声耦合剂,避免二者间产生气泡引起超声波的反射和衰减。
1.2.4 细胞形态学观察:各组细胞培养4 d后,清洗试件,2.5%戊二醛4 ℃固定 24 h,然后将各试件乙醇梯度逐级脱水,干燥,表面喷金后用SEM观察材料表面细胞的附着情况。
1.2.5 MTT检测:各组细胞培养1、4、7 d后,吸弃培养基,PBS冲洗3次,每孔加入200 µL MTT液及800 µL无血清培养基,培养箱孵育4 h,吸弃孔内液体,每孔加入1 mL DMSO,于震荡器上震荡10 min后移入96孔板中,每孔200 µL,在490 nm波长下测其OD值。
1.2.6 流式细胞仪检测:各组细胞培养5 d后取出,吸弃培养基,PBS冲洗2次,消化细胞并离心收集细胞沉淀,用预冷的PBS洗涤细胞沉淀2次,然后以预冷的70%乙醇溶液轻吹混匀沉淀细胞,4 ℃固定过夜。次日再次离心固定的细胞,预冷的PBS洗涤细胞1次,重悬细胞后再次离心,去除上清。每管细胞中加入400 µL碘化丙啶染液,于37 ℃下避光静置染色30 min,用流式细胞仪检测细胞周期 (波长488 nm) ,计算细胞PI。
1.2.7 ALP检测:各组细胞培养1、4、7 d后,弃除原培养基,PBS冲洗3次,胰酶消化,离心,再次加入PBS吹打材料上剩余细胞,收集并离心,弃除上清液,采用化学、物理双重裂解法裂解细胞,低温高速离心5 min,取上清液备用,按照总蛋白试剂盒和ALP定量检测试剂盒说明书分别对样品进行检测,按公式计算细胞内ALP含量。
1.3 统计学分析
2 结果
2.1 SEM观察结果
细胞接种4 d后,在各组多孔MT材料表面均伸展良好,细胞间靠伪足相互连接,并可见细胞长入材料孔径内部 (图1) 。
2.2 MTT
各组细胞MTT值均随着培养时间的延长而增加。在培养1、3、7 d时,100 MT组的MTT值低于其他4组,有统计学差异 (P < 0.05) ,而其他4组间无统计学差异 (图2) 。
2.3 PI值
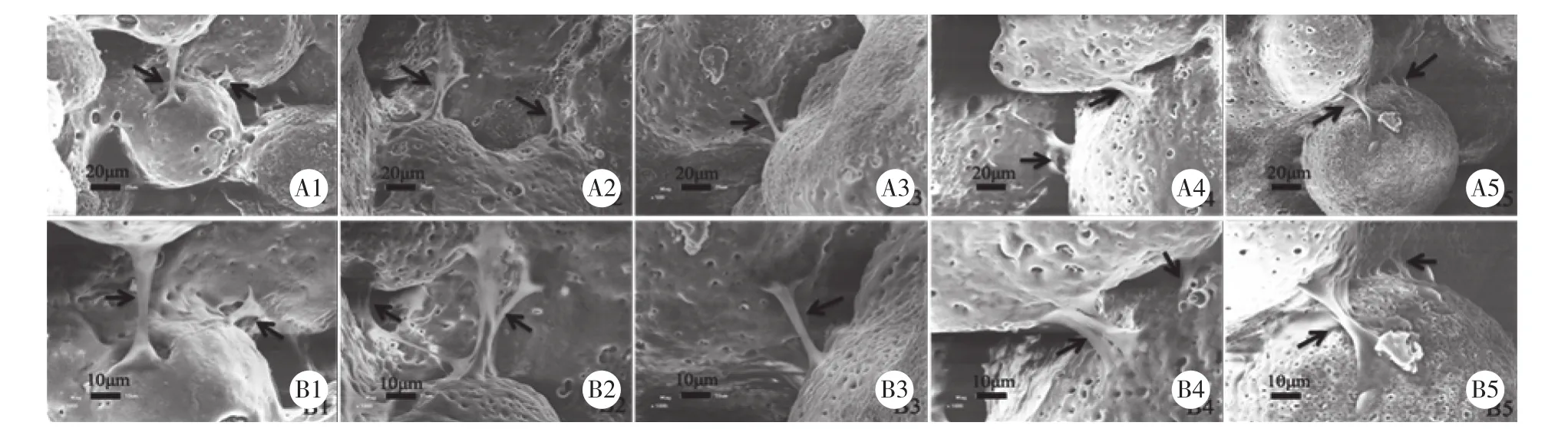
图1 SEM观察培养4 d后材料表面成骨细胞的形态Fig.1 SEM images of osteoblasts at 4 days post seeding on scaffold materials

图2 不同超声强度刺激下各组MTT值Fig.2 The MTT content in each group with stimulation at different ultrasound intensities
在共培养、超声加载5 d后,100 MT的PI值低于其他4组,有统计学差异 (P < 0.05) ,而其他4组之间无统计学差异。进一步表明100 mW/cm2的LIPUS超声强度更加不利于MC3T3成骨细胞的增殖,而不同的超声强度参数并未对其他4组成骨细胞的增殖造成显著的影响 (图3) 。
2.3 ALP值

图3 培养5 d时各组材料表面细胞的增殖指数Fig.3 The cell proliferation index in the different groups at 5 days post seeding on scaffold materials
各组细胞的ALP值随着培养时间的延长都有一个先增高再降低的趋势,在同一时间点上,30 MT组的ALP值高于其他4组,有统计学差异 (P < 0.05) 。表明当LIPUS的超声强度为30 mW/cm2时,更有利于促进MC3T3细胞的成骨向分化 (图4) 。
3 讨论
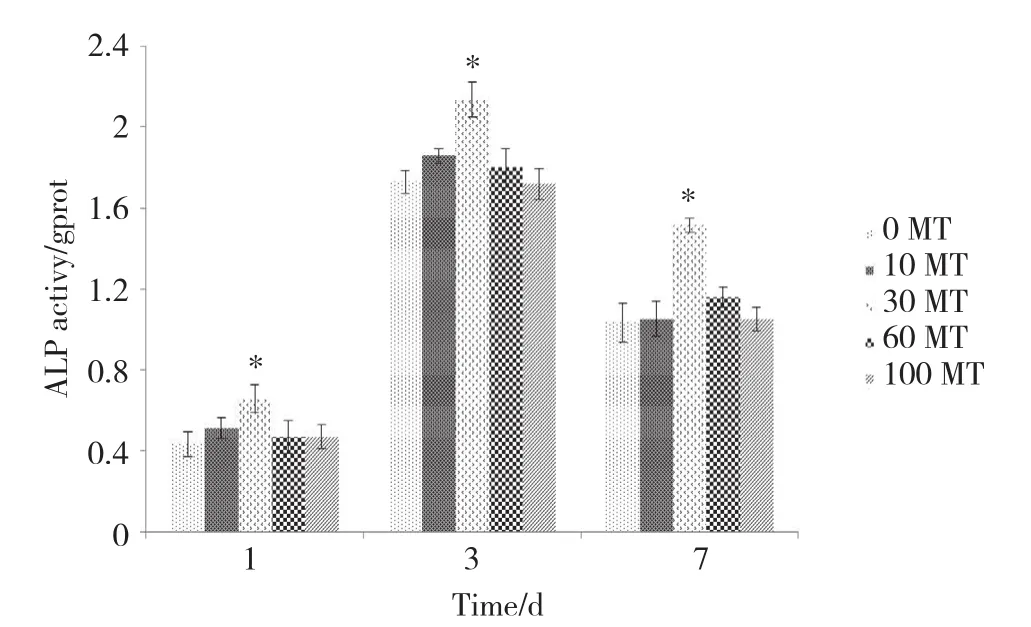
图4 不同超声强度刺激下每组ALP活性结果Fig.4 ALP content in each group with stimulation at different ultrasound intensities
LIPUS对骨折和骨不连愈合的促进作用已经被逐渐认可,它能通过作用于不同的生物成分促进骨再生的整个过程,目前已被广泛应用于辅助促进大面积骨缺损愈合[6]。LIPUS发射的脉冲式超声波能克服一般超声波的致热不良反应,产生的直接和间接的机械作用力可通过声流、声波的辐射、液体流动等引起微循环改变,利于细胞生长所需的营养物质和氧气的交换,制造更有利于细胞生长的生物学微环境,从而引发细胞的一系列生物行为变化。近年来,将LIPUS与多孔三维支架材料联合应用于体外细胞培养的研究受到越来越多的关注。WU等[7]将碳化硅支架材料与成骨细胞复合培养,发现LIPUS能够增加细胞在支架材料内部的长入深度,促进细胞增殖。
LIPUS作用的结果受到超声波的强度、频率、辐照时间等参数设置、加载装置、细胞类型、组织类型等多重因素的影响[8-13]。ZHOU等[10]通过动物实验发现40 mW/cm2的超声能明显促进新骨形成,提高骨质疏松小鼠的骨结合能力。XU等[11]研究发现,60 mW/cm2的超声强度对造血干细胞增殖的作用最为显著。安恒远等[12]的研究表明不同强度的LIPUS均可促进兔软骨细胞增殖,其中以40 mW/cm2的促进作用最显著。而AKAGI等[13]的研究认为LIPUS对细胞的增殖无影响,但能促进分化,且辐照时间和频率的差异会影响分化结果。在LIPUS对小鼠前成骨细胞生物行为影响的研究[14-15]中,常用的超声参数为强度30 mW/cm2,时间20 min,频率1~1.5 MHz,但这一参数也没有受到国内外学者的一致认可。KATIYAR等[16]通过体外研究得出结论,不同大小的超声强度会不同程度地影响MC3T3-E1细胞的增殖,而不同频率和辐照时间对细胞增殖的影响无统计学差异。ANGLE等[8]发现低于30 mW/cm2的强度对成骨细胞依然有效,并且在各个强度组中2 mW/cm2组的矿化效果最好。综上所述,LIPUS的作用效果受到多种因素的影响,为了今后能更好地研究LIPUS联合多孔钛合金支架材料对修复大面积骨缺损中各种生物学行为的影响,明确最佳的超声参数是非常必要的。
本研究通过SEM观察各组材料表面成骨细胞的黏附状态,发现各组材料上细胞均伸展良好,并长入至材料孔径内部,表明LIPUS不会影响成骨细胞在多孔MT上的黏附。本研究中LIPUS强度为100 mW/cm2组的MTT值低于其他组,差异有统计学意义 (P < 0.05) ,而其他组之间无统计学差异,流式细胞仪检测结果进一步验证了MTT的检测结果。提示当超声强度达到100 mW/cm2时,会在一定程度上抑制MC3T3细胞的增殖。值得注意的是,与假辐照的0 MT组相比,10 MT、30 MT和60 MT这3个组的细胞在增殖方面的检测结果均不具有统计学差异,表明在本实验条件下,LIPUS对MC3T3细胞增殖没有促进作用。关于LIPUS对细胞增殖的影响,目前国内外研究尚无统一定论,大部分研究[9,15]认为它能促进细胞增殖,然而部分研究[17]认为它对细胞增殖无明显影响,甚至还有研究[18]显示LIPUS能够抑制细胞的增殖。LIPUS对细胞增殖产生不同结果的具体机制尚不清楚,可能与细胞、材料或者超声参数有关,还有待于进一步研究。
ALP是成骨细胞分泌的一种蛋白酶,是成骨细胞早期分化的特异性标志之一。本实验对各组材料上细胞的ALP含量进行了定量检测,结果显示,在检测的各个时间点上30 MT组的ALP值均高于其他组,差异有统计学意义 (P < 0.05) 。表明强度为30 mW/cm2的LIPUS能显著促进MC3T3细胞的成骨向分化,与之前国内外的大量研究[13-15]结果一致。
综上所述,本研究结果显示,30 mW/cm2的强度是促进MC3T3细胞成骨向分化的最优超声强度参数。本研究组将采用此超声强度参数进行后续的深入研究。

