黄瓜CsGA20ox1异源表达促进拟南芥植株发育
庞保亚,李 强,任仲海
山东农业大学园艺科学与工程学院,山东果蔬优质高效生产协同创新中心,农业部黄淮地区园艺作物生物学与种质创制重点实验室,作物生物学国家重点实验室,山东 泰安 271018
黄瓜(Cucumis sativusL.)一年生的草本植物,属于葫芦科(Cucurbitaceae),是世界十大蔬菜之一,我国是世界上黄瓜生产面积最大、总产量最高的国家[1-3]。赤霉素是植物体内重要的激素调节物质之一。研究表明赤霉素在植物生长发育过程中起重要作用,包括种子萌发、表皮毛发育、茎和叶的伸长、花的发育和果实的形成[4-10]。另外赤霉素在植物免疫方面也有重要作用[11]。目前,赤霉素合成途径在一些植物中已经研究的比较清楚,在高等植物中赤霉素的生物合成是一个多级化的氧化酶催化反应过程并且是保守的[12],赤霉素氧化酶GA20ox1是催化反应的关键酶之一。
在已知的赤霉素生物合成路径中有三种关键酶类,分别是GA20ox,GA3ox和GA2ox。这三种酶类属于20G-Fe(II)oxygenase亚家族并且是被多基因家族所编码[9]。其中赤霉素20-氧化酶是目前已知的在赤霉素合成过程中重要的限速酶,在赤霉素合成后期催化连续的氧化反应[13],它以中间产物(GA12,GA53,GA15,GA44,GA24,GA19)为底物最终形成GA9和GA20,再经过赤霉素3-氧化酶的作用最终形成有生物活性的赤霉素[14]。在拟南芥中,含有5个赤霉素20-氧化酶,进化树分析表明AtGA20ox1,2,3和4的亲缘关系非常近,而AtGA20ox5与其余四种亲缘关系较远;分析比较催化活性发现AtGA20ox1,2,3和4均具有完整的催化能力,而AtGA20ox5只能催化前两步反应,不具有完整的催化活性;功能分析表明AtGA20ox3与AtGA20ox1和AtGA20ox2具有功能冗余性,ga20ox1突变体表现出植株矮小的性状,而ga20ox2单突变体和ga20ox3单突变体并没有明显变化。ga20ox1-3三突变体植株表现出严重的植株矮小和不育,以ga20ox1-3三突变体为背景突变AtGA20ox4或AtGA20ox5没有进一步影响植株表型[15,16],而超量表达AtGA20ox1由于提高了赤霉素的水平而增强植株的生长[17-20],表现出莲座丛增大和叶柄长度增加[13]。最近的研究发现,在水稻中GNP1即AtGA20ox1的同源基因OsGA20ox1可以催化合成赤霉素合成必须的重要中间产物GA20,促进赤霉素的合成,同时超量表达OsGA20ox1可以增加谷粒的数量和最终的产量[21]。棉花中GhGA20ox1在烟草中异源表达不仅增加了叶柄的长度,并且显著增加了子叶下胚轴、果炳和花的长度[22]。研究表明在黄瓜中同样含有5个赤霉素20氧化酶(CsGA20ox1,2,3,4和5),并且5个氧化酶的功能是相似的,都可以将GA12转化为GA9(主要产物)和GA25(次要产物),另外,CsGA20ox1还可以有效催化13-羟基化途径中早期的GA53转化为GA20的反应[23]。但CsGA20ox1在黄瓜生长发育过程中的作用还不清楚。
为探明CsGA20ox1在黄瓜生长发育中的作用,本实验采用同源克隆的方法克隆了黄瓜赤霉素20-氧化酶基因CsGA20ox1,成功构建了CsGA20ox1超量表达载体,并通过农杆菌介导的遗传转化获得了CsGA20ox1转基因拟南芥株系。通过分析转基因拟南芥种子萌发速率、转基因拟南芥地上部分生长情况和叶片表皮细胞大小,初步揭示CsGA20ox1在植株生长发育中的作用。
1 材料与方法
1.1 试验材料
“新泰密刺”黄瓜取自山东农业大学南校区园艺试验站,取样时间为2017年5月至7月。分别对不同的组织生长根、幼茎、新生叶、开花当天的花、开花当天的果实和卷须取样,样品用液氮速冻保存用于检测CsGA20ox1表达。
选择3周左右生长状态一致的拟南芥(Arabidopsis thaliana(L.)Heynh)转基因植株拍照并测量叶片面积、叶柄长度和莲座丛面积。取新生叶片,样品用液氮速冻保存用于检测CsGA20ox1、AtGA20ox1等基因的表达。
1.2 总 RNA的提取以及实时荧光定量PCR分析
转基因拟南芥和黄瓜各组织的RNA提取均采用TRIZOL法,以提取的总RNA为模板,按照北京全式金生物技术有限公司cDNASynthesis Super Mix试剂盒说明书合成cDNA第1链。
选取CsActin(GenBank accession number AB010922)为黄瓜内参基因和AtGAPDH为拟南芥内参基因。PCR 反应体系为:1 μL cDNA,2.5 μL 10×Taq buffer,2 μL dNTPs(2.5 mmol·L-1),上、下游引物各 1 μL(10 μmol·L-1)和 0.5 μL(5 U·μL-1)Taq 酶(全式金,北京),加去离子水至 25 μL。PCR反应程序为:94℃预变性5 min,94℃30 s,56℃30 s,72℃30 s,72℃5 min,28~32个循环;PCR产物1%琼脂糖凝胶电泳。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR反应都设 3 次重复。PCR 反应体系为:2×Realtime PCR Super mix 10 μL,上、下游引物浓度为 0.5 μmol·L-1,模板1 μL,加去离子水至20 μL。PCR反应程序为:95℃预变性1 min,95℃15 s,60℃15 s,72℃30 s 40个循环。采用2-ΔΔCT法进行定量数据分析。
1.3 亚细胞定位
通过引物中引入的BamHⅠ和XhoⅠ酶切位点,将CsGA20ox1基因从pJET-T载体切下回收,并对pROKⅡ进行相同酶切位点的酶切,将两者在22℃连接,转化大肠杆菌,鉴定阳性单菌落。构建pROKⅡ-CsGA20ox1-GFP表达载体。
通过液氮冻融法将质粒pROKⅡ-CsGA20ox1-GFP和p19转入农杆菌C58C1。以农杆菌浸润法侵染本生烟,挑取阳性菌落接种到含对应抗生素的LB液体培养基(25 mg·L-1Rif,50 mg·L-1Kan),每分钟200 转 28 ℃振荡培养 12~16 h。将 2 种菌液 5000×g 离心 5 min,悬浮(悬浮缓冲液:10 mmol·L-1MgCl2,10 mmol·L-1MES,150 μmol·L-1As)。含 p19 的菌液与含 pROKⅡ-CsGA20ox1-GFP 菌液等体积混合,使其OD600为0.6~0.8。室温静置3 h后注射烟草叶片,48~96 h内观察定位结果。
荧光观察时撕取浸润48~96 h的本生烟叶片下表皮进行观察。GFP经488 nm激光激发,通过550~590 nm滤镜后获得荧光信号。
1.4 植物过表达载体的构建及拟南芥转基因株系的获得
通过引物中引入的BamHⅠ和SacⅠ酶切位点,将CsGA20ox1基因从pJET-T载体切出回收,并对pBI121进行相同酶切位点的酶切,将两者在22℃连接,转化大肠杆菌,鉴定阳性单菌落。构建pBI121-CsGA20ox1植物过表达载体。
转基因拟南芥通过侵染拟南芥花序的方法获得[24]。经过50 mg·L-1卡那抗性筛选后,PCR检测得到阳性转基因植株,收取种子,经过自交纯化得到纯合株系,进行表型分析。
1.5 拟南芥叶面积、叶柄长度和莲座丛面积的测量
野生型(WT)拟南芥和转基因(CsGA20ox1)拟南芥在恒温光照条件下培养23 d,对莲座丛和第六片叶进行拍照,并运用Image J测量叶面积、叶柄长度和莲座丛面积。
1.6 DIC(Differential Interference Contrast)实验
脱色:取上面拍照所用的第六片真叶,用14%冰醋酸和84%的乙醇混合液(比例1:4),浸泡24 h。
脱水:用75%乙醇浸泡24 h,重复1次;再用99.5%乙醇浸泡脱水24 h,重复1次;最后用水合三氯乙醛浸泡30 min。
观察:制作临时玻片,通过显微镜观察叶片下表皮细胞并拍照。
3次生物学重复,每次每个株系取三片以上真叶进行处理观察,观察时选取叶片中间远离叶脉及表皮毛的部位,运用五点取样法测量表皮细胞面积。
2 结果与分析
2.1 黄瓜CsGA20ox1的分离克隆及系统进化树分析
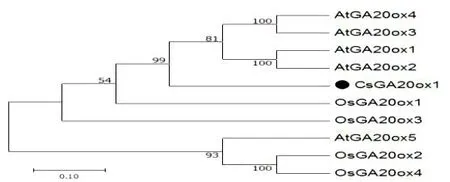
图1 黄瓜CsGA20ox1及其他物种同源基因的进化分析Fig.2 Evolution analysis of cucumber CsGA20ox1 and other homologous genes
以黄瓜cDNA为模板,CsGA20ox1-OE-F/R为引物进行PCR扩增,获得1122 bp特异条带。该基因编码一个含374个氨基酸的蛋白质。利用MEGA7.0软件将黄瓜CsGA20ox1蛋白序列与拟南芥、水稻的GA20ox蛋白序列进行同源序列比对分析并构建进化树(图1),结果表明,黄瓜CsGA20ox1与拟南芥AtGA20ox1、2、3和4的氨基酸序列同源性较高且亲缘关系比较近。
2.2 黄瓜中CsGA20ox1表达模式分析
为了探明CsGA20ox1在黄瓜不同组织中的表达特性,在同一时间获取黄瓜各个组织,提取总RNA(三个生物学重复)后反转录得到cDNA第一链,以此作为模板进行定量PCR分析。结果如图2所示,CsGA20ox1在黄瓜子房和幼叶中表达量较高,在花和卷须中表达量相对较低。
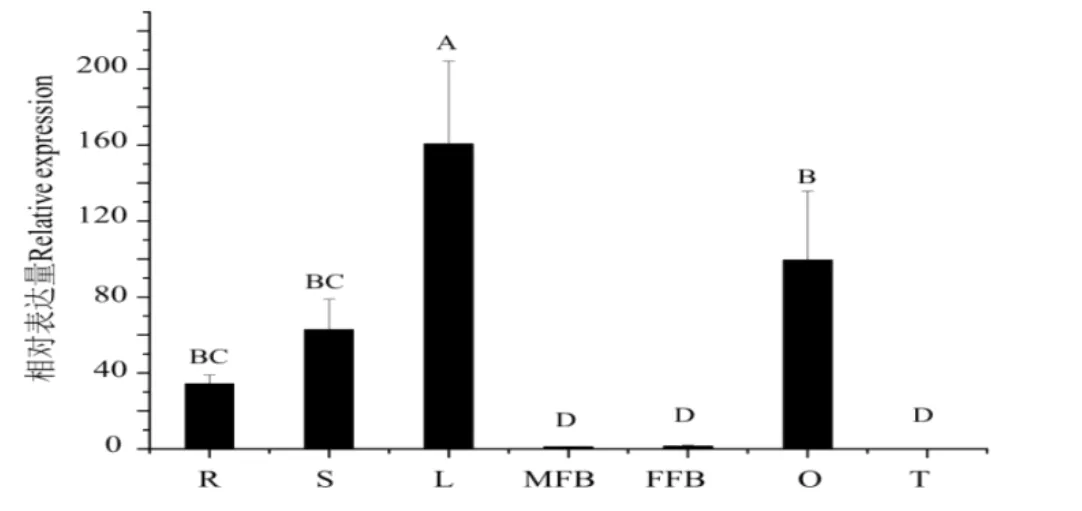
图2 CsGA20ox1在黄瓜不同组织中的表达分析Fig.2Analysis of the expression of CsGA20ox1 gene in different tissues of cucumber
2.3 CsGA20ox1的亚细胞定位
为探究CsGA20ox1的亚细胞定位,构建了以35S为强启动子驱动的含有CsGA20ox1完整编码区并连接GFP的融合蛋白表达载体(35S::CsGA20ox1-GFP),以35S::GFP为对照,通过农杆菌侵染烟草叶片进行瞬时表达。经过三次生物学重复,每次观察三个以上临时玻片得到结果如图3(D-F)所示,融合蛋白在烟草叶片表皮细胞的细胞核中有荧光信号,表明CsGA20ox1在细胞核中有表达。

图3 CsGA20ox1的亚细胞定位Fig.3 Subcellular localization of CsGA20ox1
2.4 拟南芥中异源表达CsGA20ox1
构建CsGA20ox1超量表达载体pBI121-CsGA20ox1(图4),转化农杆菌LBA4404,利用侵染拟南芥花序的方法进行基因的遗传转化。通过自交纯化得到OE-7、OE-9和OE-10纯合转基因株系,实时荧光定量PCR检测转基因株系CsGA20ox1表达量如图5。
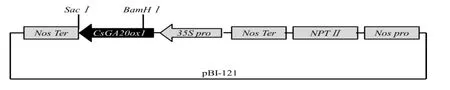
图4 pBI-121-CsGA20ox1结构示意图Fig.4 pBI-121-CsGA20ox1 structure diagram
2.5 超量表达CsGA20ox1提高拟南芥种子萌发速率
对获得的CsGA20ox1拟南芥转基因株系进行种子萌发实验。每次播种100粒种子统计发芽率,三次生物学重复得到结果如图6所示,在培养12 h后转基因拟南芥开始萌发,在24 h、36 h、48 h和60 h转基因拟南芥的种子萌发率显著高于野生型拟南芥,72 h后种子发芽率均达到99%以上,说明选取的种子良好,表明超量表达CsGA20ox1提高了拟南芥种子的萌发速率。
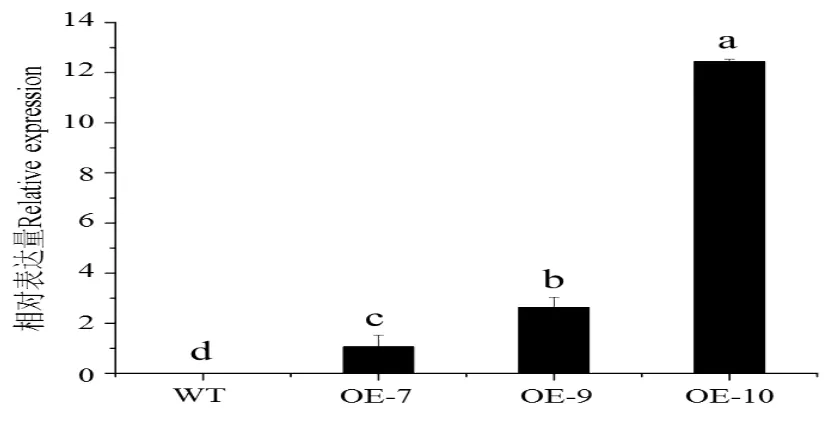
图5 CsGA20ox1在野生型(WT)和转基因拟南芥OE-7、OE-9、OE-10株系中的表达水平Fig.5 Expression value of CsGA20ox1 in wild type(WT)and transgenic Arabidopsis thaliana OE-7,OE-9andOE-10strain
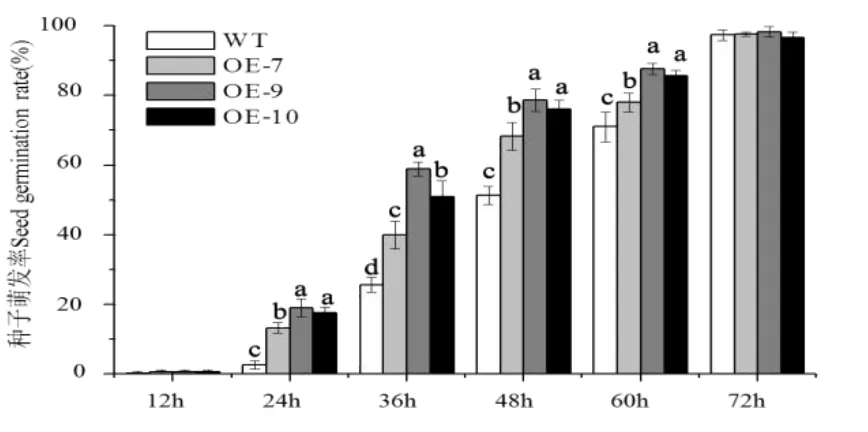
图6 野生型拟南芥(WT)和转基因株系(OE-7、OE-9、OE10)的种子萌发率统计Fig.6 Seed germination rate of wild type Arabidopsis(WT)and transgenic strain(OE-7,OE-9 and OE-10)
2.6 超量表达CsGA20ox1可以增加拟南芥地上部分的叶面积、叶柄长度和莲座叶大小
对获得的CsGA20ox1转基因拟南芥生长状况进行观察,在培养23 d后发现,转基因拟南芥莲座叶面积明显大于野生型(图7-A)。通过比较此时期各个叶片的大小发现第六片真叶差异最明显。因此,选择第六片真叶来统计叶面积和叶柄长度。统计结果表明与野生型相比转基因拟南芥三个株系的叶面积、叶柄长度均有所增加,其中OE-7增加54%、OE-9增加150%、OE-10增加179%。说明CsGA20ox1基因在拟南芥中异源表达可以促进植株地上部分的生长发育。
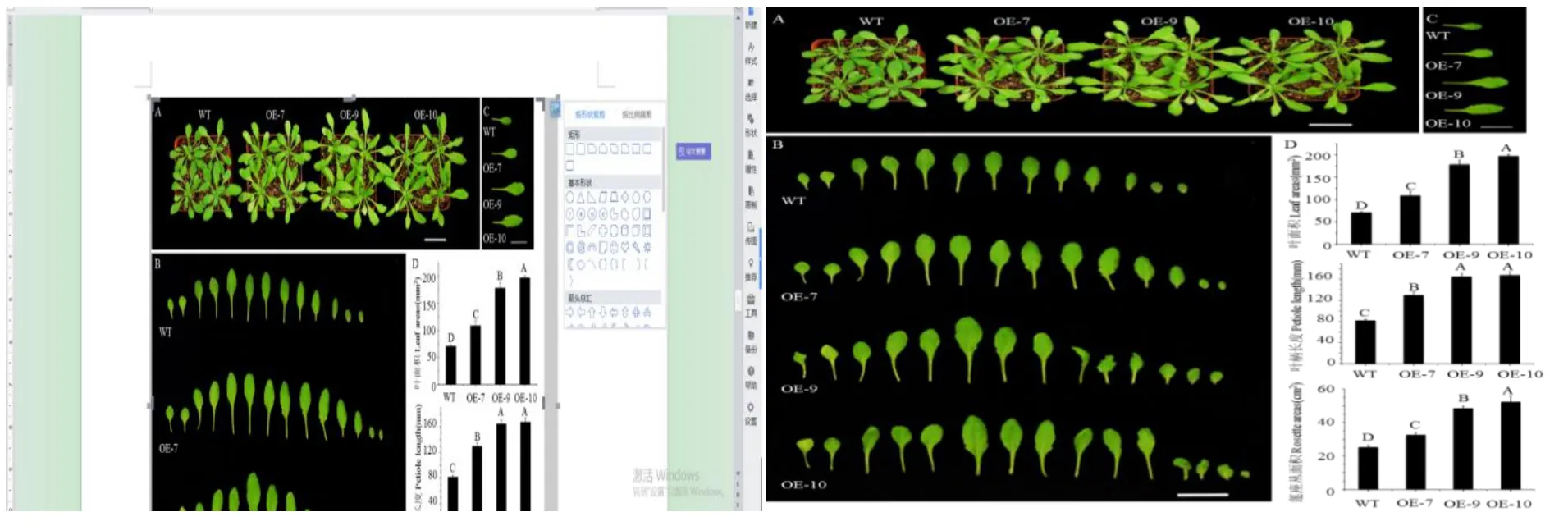
图7 野生型和转基因拟南芥莲座丛面积及第六片真叶叶面积和叶柄长度表型及统计Fig.7 Phenotype and statistics of rosette area,the sixth euphylla area and petiole length of wild type and transgenic Arabidopsis thaliana
2.7 超量表达CsGA20ox1增大叶片表皮细胞面积
异源表达CsGA20ox1后拟南芥表现出叶面积增大的表型,说明CsGA20ox1可能影响了叶片细胞的大小或者数量。取WT和转基因株系植株同一部位叶片,通过DIC实验观察叶片表皮细胞(选取叶片中部并避免叶脉存在)结果如图8,可以看出与野生型相比,转基因株系的叶片表皮细胞有显著增大。统计结果表明与野生型相比,表皮细胞面积OE-7增加21%、OE-9增加46%、OE-10增加58%。
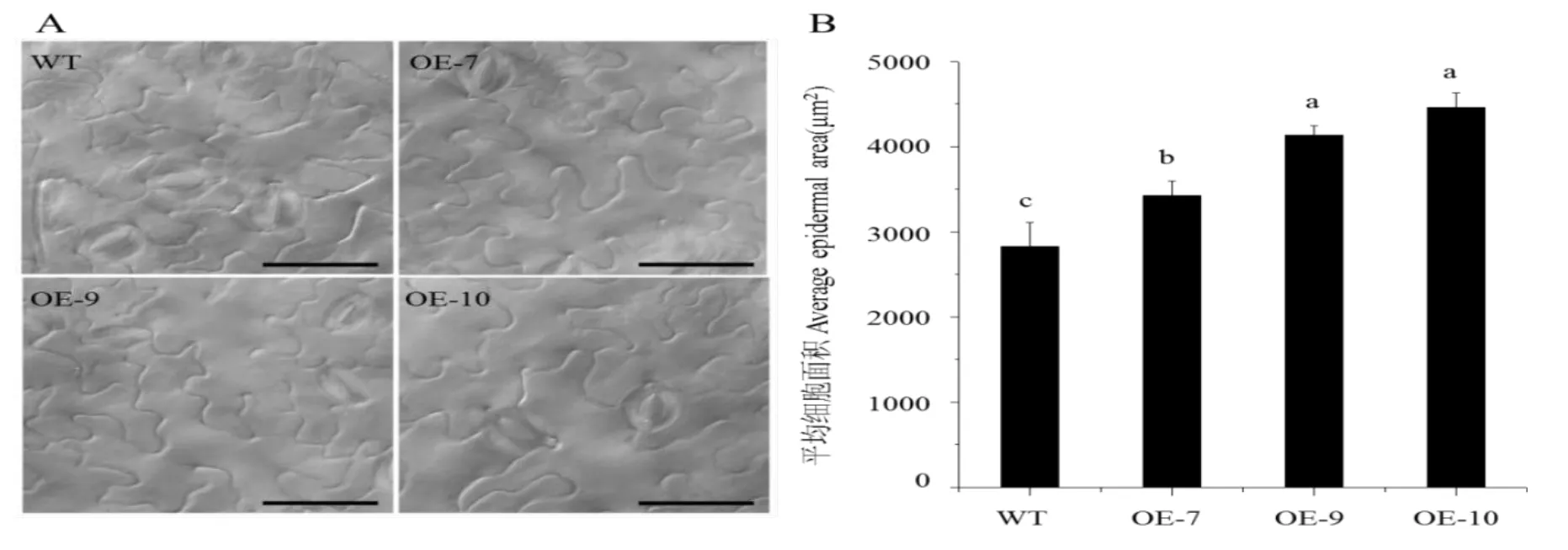
图8 观察统计野生型和转基因拟南芥叶片下表皮细胞大小Fig.8 Observation and statistics on the size of epidermal cells in leaves of wild-type and transgenicArabidopsis thaliana
3 讨 论
进化树分析表明,黄瓜CsGA20ox1与拟南芥AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4亲缘关系均非常近,推测其功能相近。同时,组织表达分析结果显示,该基因在黄瓜各组织中均有表达,其中在幼叶和开花当天的果实中表达量较高,CsGA20ox1可能在种子萌发和叶片生长发育过程中起着重要的调节作用。
目前,在黄瓜中赤霉素氧化酶的亚细胞定位还没有相关研究,但是在拟南芥、水稻等植物中已有所研究。在拟南芥赤霉素氧化酶AtGA20ox2的亚细胞定位是通过构建融合荧光蛋白表达载体并在烟草叶片中瞬时表达实现的,检测荧光信号显示拟南芥AtGA20ox2同时在细胞核和细胞质中表达[25]。另外,赤霉素氧化酶的GA2ox家族基因的亚细胞定位也有所研究,在水稻中通过侵染洋葱表皮细胞研究赤霉素氧化酶OsGA2ox5、OsGA2ox6的亚细胞定位,结果显示其均是在细胞核和细胞质中表达[26-27],而本实验结果(如图4)CsGA20ox1主要在细胞核中表达。
为了进一步研究CsGA20ox1在黄瓜生长发育中的功能,我们构建了CsGA20ox1基因的超量表达载体,并通过农杆菌介导遗传转化拟南芥。转基因拟南芥表现出种子萌发速率加快(图7)并且地上部分生长状况明显优于野生型(图8),表明CsGA20ox1在促进种子萌发速率和植株生长中发挥重要作用。以前的研究表明通过外源施加赤霉素可以显著促进茄子、西瓜的种子萌发[28,29],在白菜生长过程中通过外源施加赤霉素可以显著促进白菜整个植株的生长发育[30]。这说明转基因拟南芥(CsGA20ox1)促进种子萌发和植株发育可能是由于促进了拟南芥体内赤霉素的合成所引起的。另外转基因拟南芥叶面积的增大可能是由于增加了单个细胞的面积,通过显微镜观察统计,结果也证实了转基因拟南芥叶片表皮细胞的平均面积与野生型相比有显著增加(图8),但是叶片细胞数量有没有增加还不清楚需要通过进一步实验探究。
4 结 论
通过克隆获得黄瓜CsGA20ox1,该基因编码373个氨基酸。进化树分析表明该基因与拟南芥AtGA20ox1亲缘关系最近,组织表达特异性分析结果显示黄瓜CsGA20ox1主要在幼叶和开花当天的果实中表达。亚细胞定位结果表明黄瓜CsGA20ox1主要在细胞核中表达。在拟南芥中异源表达黄瓜基因CsGA20ox1能够促进种子萌发和植株生长,其中叶片的增大可能是通过增大细胞面积和增加细胞数量实现的。因此,黄瓜CsGA20ox1可以促进种子萌发和叶片生长发育。

