灰树花多糖对TNF-α/IFN-γ诱导的HaCaT细胞炎症因子分泌的影响
杜一峰 郑 浩 刘 进 李 艺 雷 萍 侯殿东
特应性皮炎(atopic dermatitis,AD)是一种常见的慢性复发性炎症性皮肤病。近30年来AD的发病率在全球呈明显上升趋势,在发达国家可累及10%~20%的儿童及1%~3%的成人,污染严重的国家尤为明显[1]。近年来随着我国城市化,工业化进程的加速,环境污染日益加重,AD在我国的发病率亦呈现快速上升趋势[2]。局部外用糖皮质激素,并配合应用润肤保湿剂是目前AD的一线疗法,但长期应用糖皮质激素副作用大,患者不易耐受[3,4]。AD作为严重影响人类健康,尤其是儿童身心健康发展的疾病,日益受到世界各国的广泛关注。因此,寻找有效的治疗方法具有重要的公共卫生意义。灰树花(Grifola frondosa)属担子菌纲多孔菌科,是一种药食两用珍稀食用菌,其含有众多活性物质,灰树花多糖(Grifola frondosa Polysaccharide, GFP)是灰树花最主要的一类活性成分[5]。已有研究表明,GFP可明显抑制AD小鼠皮损部位的炎症反应,并且对Th1/Th2平衡也具有调节作用[6],但其进一步机制并不明确。本实验采用TNF-α与IFN-γ诱导活化的HaCaT细胞为AD体外模型,通过研究GFP对TNF-α/IFN-γ诱导的HaCaT细胞炎症因子产生的影响及对NF-κB信号通路的影响,深入揭示GFP对AD炎症抑制的作用机制,为GFP治疗AD提供理论和实验依据。
1 材料与方法
1.1 材料 GFP(纯度>70%)购自南京广润生物制品有限公司,DMEM高糖培养基购自GIBCO公司,胎牛血清购自HyClone公司,TNF-α和IFN-γ均购自Sigma公司,RNA提取、逆转录、qPCR扩增试剂盒及引物均购自Promega公司,TARC、MDC ELISA检测试剂盒购自武汉华美生物工程有限公司,anti-NF-κB、anti-磷酸化(p)-NF-κB 苏州睿瀛生物技术有限公司,HRP标记羊抗兔IgG Proteintech,ECL发光试剂盒Pierce公司。
1.2 方法
1.2.1 细胞培养人角质形成细胞系(HaCaT细胞) 购自江苏凯基生物技术股份有限公司。该细胞系用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM高糖培养基在37℃,5% CO2条件下恒温贴壁培养。
1.2.2 实验共分5组 A组为正常对照组,B组为TNF-α/IFN-γ活化组,C、D、E组分别为GFP低、中、高剂量干预组。将HaCaT细胞接种于六孔板中,106/孔, 37℃、5% CO2条件下过夜培养,细胞贴壁后,弃培养基,PBS清洗2次,加入不含血清DMEM培养基2 mL,TNF-α/IFN-γ活化组和GFP干预组细胞加入IFN-γ和TNF-α,终浓度均为10 ng/mL ,对照组加入等量PBS。GFP干预组细胞加入不同浓度的GFP工作液(GFP溶于PBS),使其终浓度分别为0.2 mg/mL、0.4 mg/mL和0.8 mg/mL。对照组和模型组加入等量PBS,37℃、5% CO2条件下培养24 h后收集细胞培养上清液和细胞。
1.2.3 qPCR法检测TARC、MDC、IL-6 和TNF-α mRNA表达Trizol法提取总RNA后参照说明书进行反转录,然后进行qPCR。引物序列见表1。qPCR方法如下:以1 μL cDNA为模板,GAPDH为内参,采用ABI 7500 Real time PCR系统进行扩增。PCR反应条件:变性95℃、30 s;变性95℃、5 s,退火延伸60℃、30 s,40个循环。每个样品做3个复孔,反应结束后确认扩增曲线及熔解曲线,取Ct值的平均值,再用公式2-ΔΔCt计算各基因的相对表达量。
1.2.4 ELISA检测TARC和MDC分离细胞培养上清液,80℃保存待测。按试剂盒说明书操作检测其含量。
1.2.5 NF-κB和p-NF-κB蛋白表达的检测细胞裂解液裂解细胞,超声处理10 s,12000×g离心5 min,取上清液BCA法检测蛋白浓度。取25 μg蛋白经10%SDS PAGE电泳分离蛋白,将目的蛋白转移至硝酸纤维素滤膜上,在5%脱脂奶粉的封闭液中室温下封闭2 h,分别加入NF-κB和p-NF-κB一抗4℃过夜,洗膜后,加入二抗,37℃,l h。ECL发光,信号在图像分析系统中进行吸光度扫描。以β-actin作为内参,获得蛋白相对量。
1.2.6 统计学方法 以上检测每一浓度的药物设3个平行复孔,重复实验三次。所得实验数据均以均数±标准差表示,各组间均数比较采用一维方差分析(one-way ANOVA),P<0.05为差异有统计学意义。应用SPSS 13.0统计分析软件进行统计学分析。

表1 qPCR引物序列
2 结果
2.1 GFP对TNF-α/IFN-γ诱导的HaCaT细胞TARC、MDC、IL-6 和TNF-α mRNA表达的影响从图1可见,与正常对照组细胞相比,TNF-α和IFN-γ可显著上调HaCaT细胞TARC、MDC、IL-6 和TNF-α mRNA的表达;与TNF-α/IFN-γ诱导的HaCaT细胞相比,GFP可显著下调TARC、MDC、IL-6和TNF-α mRNA的表达。
2.2 GFP对TNF-α/IFN-γ诱导的HaCaT细胞TARC、MDC表达的影响从图2可见,与正常对照组细胞相比,TNF-α和IFN-γ可显著促进HaCaT细胞TARC和MDC的表达;与TNF-α/IFN-γ诱导的HaCaT细胞相比,GFP可显著抑制TARC和MDC的表达。
2.3 GFP对TNF-α/IFN-γ诱导的HaCaT细胞NF-κB和p-NF-κB表达的影响从图3可见,与正常对照组细胞相比,TNF-α和IFN-γ及GFP对NF-κB表达无明显影响。与正常对照组细胞相比,TNF-α和IFN-γ可显著上调HaCaT细胞p-NF-κB的表达;与TNF-α/IFN-γ诱导的HaCaT细胞相比,GFP可显著下调p-NF-κB的表达。

a:IL-6;b:MDC;c:TARC;d:TNF-α。**:与对照组相比,P<0.01;##与TNF-α/IFN-γ诱导细胞相比,P<0.01;#与TNF-α/IFN-γ诱导细胞相比,P<0.05

a:MDC;b:TARC。**:与对照组相比,P<0.01;##与TNF-α/IFN-γ诱导细胞相比,P<0.01
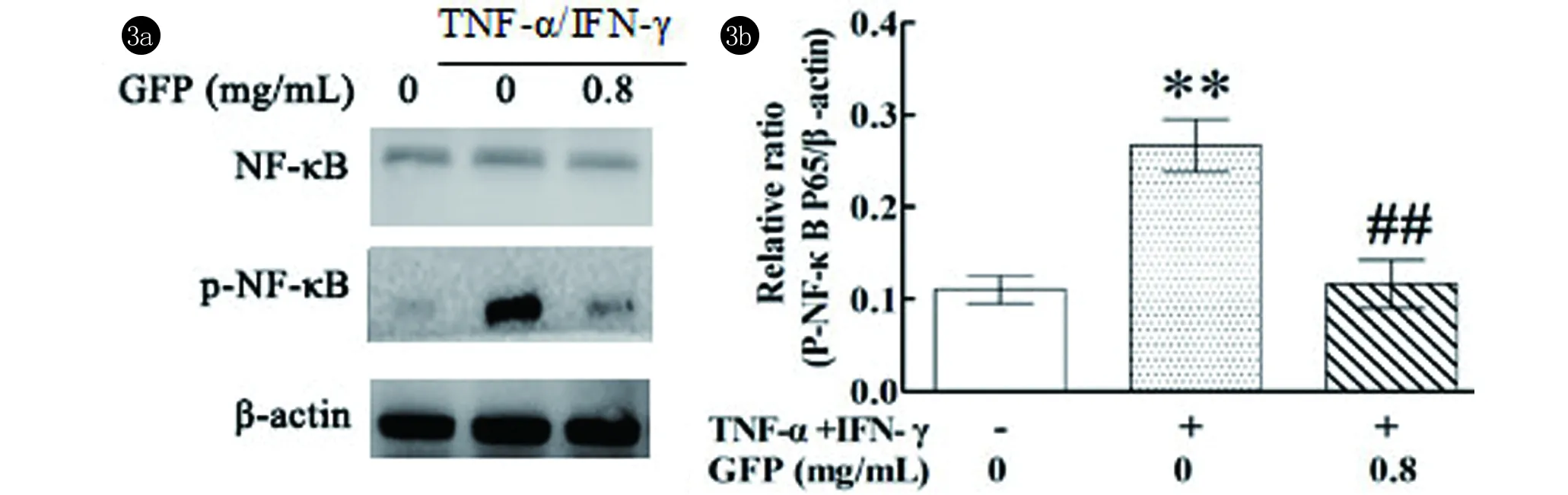
**:与对照组相比,P<0.01;##与TNF-α/IFN-γ诱导细胞相比,P<0.01
3 讨论
本研究采用INF-γ和TNF-α刺激HaCaT细胞以制备细胞炎症模型,在此基础上加入GFP干预,研究GFP的抗炎作用及机制。结果表明,GFP对TNF-α/IFN-γ诱导的HaCaT细胞胸腺活化调节趋化因子(thymus and activation regulated chemokine, TARC/CCL17)和巨噬细胞源趋化因子(macrophage derived chemokine,MDC/CCL22)、IL-6和TNF-α mRNA及TARC、MDC蛋白的表达均有明显抑制作用(P<0.05)。
在AD发病过程中,Th2细胞过度活化,分泌大量Th2型细胞因子[7]。过度表达的Th2型细胞因子使AD患者表皮丝聚合蛋白(filaggrin,FLG)表达下降[8]。FLG的减少和缺失,可能是引起AD等干燥性皮肤病的主要原因[9]。因此,拮抗Th2型细胞因子、调节Th1/Th2平衡是修复皮肤屏障功能的策略之一。TARC和MDC为Th2细胞的趋化因子,二者均可与Th2细胞表面CCR4结合,将Th2细胞募集至炎症部位[10]。AD患者血清TARC和MDC水平显著升高,这两个指标与疾病严重程度密切相关[11]。IL-6属于Th2型细胞因子,作为前炎症细胞因子,IL-6在炎症反应过程中起着重要的作用[12]。AD患者血清IL-6水平较正常人明显升高[13]。AD患者体内Th2细胞不但能够产生经典的Th2细胞因子IL-4、IL-5和IL-13,还可产生TNF-α,形成“炎症性Th2”反应[14]。
研究表明AD皮损部位TARC、MDC等Th2型细胞因子的产生与NF-κB信号途径有关[15]。核因子κB(nuclear factor -kappa B, NF-κB)可以被多种刺激剂,如TNF-α等激活。激活的NF-κB与IκB解离后转位入核与靶基因启动子/增强子上的κB位点结合,从而调节许多靶基因的表达[16]。结果表明与TNF-α/IFN-γ诱导的HaCaT细胞相比,GFP可显著下调p-NF-κB的表达。这表明GFP的抗炎作用可能与其抑制NF-κB P65信号通路的活化有关。
本研究结果表明GFP具有明显的抗炎作用,其机制可能与调节NF-κB P65信号通路有关。通过研究GFP对在炎症性皮肤病中的作用机制,可以为GFP在临床中应用提供实验依据。

