利用易错PCR构建酱油酿造用T酵母spt15突变库
赵秀丽,张毓秀,孙月芹,侯丽华*
(天津科技大学新农村发展研究院,天津 300457)
在酱油发酵过程中,很多醇类、酯类、挥发性酚和呋喃酮等香味化合物是由耐盐酵母产生[1-4]。例如S酵母(Zygosaccharomyces rouxii)[5]主要产生乙醇和呋喃酮如5-甲基-2-乙基-4-羟基-3(2H)-呋喃酮(4-hydroxyl-2(or5)-ethyl-5(or2)-methyl-3(2H)-furanone,HEMF)[6],T酵母(Candida versatilis)主要产生挥发性酚如4-乙基愈创木酚(4-ethylguaiacol,4-EG)和4-乙基苯酚(4-ethylphenol,4-EP)[7]。T酵母作为酱油发酵的主要菌株之一,具有复杂的耐盐系统,使其在高盐发酵环境中保持正常的生理活动和新陈代谢,该功能丰富了酱油的风味物质,提高了酱油生产质量[3,8]。
SPT15[9-11]为酵母细胞中基本的常规转录因子,具有编码TATA结合蛋白(TATA binding protein,TBP)功能[12-14]。TBP是通过RNA聚合酶I、RNA聚合酶II[15]或RNA聚合酶III指导基因转录时所必需的成分[10,16],而且作为聚合酶I的核心因子、TFIID和TFIIIB的组分,在释放RNA聚合酶I、RNA聚合酶II或RNA聚合酶III到转录起始位点时起着重要的作用[17-19]。目前有研究表明SPT15的突变可以影响乙醇的发酵[20]。
易错聚合酶链式反应(polymerase chain reaction,PCR)技术[21-23]是指一种容易使DNA在复制扩增过程中出现错误配对的PCR技术,又称错配PCR或倾向错误PCR。一般是利用Taq DNA聚合酶的低保真性和一些PCR体系中的条件[20,24],降低DNA复制的保真度,增加碱基在新的DNA链合成过程中的错配率,主要目的在于使得扩增产物出现数量较多的点突变。在实验过程中降低DNA聚合酶保真性的方法主要有改变PCR温度、提高Mg2+浓度、4 种不同dNTP浓度或者改变4 种dNTP的比例、在PCR体系中添加Mn2+等[25-26]。本实验主要通过提高Mg2+浓度和改变4 种dNTP比例进行易错PCR。
1 材料与方法
1.1 材料与试剂
菌种:T酵母、W303菌株(尿嘧啶缺陷型菌株)、WM2菌株(尿嘧啶缺陷型菌株)和大肠杆菌均为本实验室保藏;W303+G、WM2+G为含质粒的尿嘧啶缺陷型酵母菌株。
质粒:YEplac195为本实验室保藏。
试剂:YPD培养基(1%酵母膏,2%蛋白胨,2%葡萄糖;制备固体培养基时加入2%琼脂粉);尿嘧啶缺陷培养基又叫CM-URA培养基(0.8% Ura Minus Media Droupout,2%葡萄糖,2%琼脂,调节pH 7.5,115 ℃灭菌20 min);Taq DNA聚合酶、dNTP 北京索莱宝科技有限公司。
1.2 仪器与设备
RJ-362 PCR扩增仪、CFX-348凝胶成像仪 美国Bio-Rad公司;高速冷冻离心机 美瑞泰克科技有限公司。
1.3 方法
1.3.1 PCR扩增
通过酵母染色体DNA的快速分离[27]得到T酵母DNA。以酵母DNA为模板,分别以ZrURA3-P-up:5’-GC GAGCTCTCGGAATAGCTTTAATGGTG-3’,ZrURA3-P-dn:5’-GCGGTACCACCGATGGGAAATGACTCTT-3’(400 bp);ZrURA3-T-up:5’-GCGCATGCGGAAGG AATTGAACCATATA-3’,ZrURA3-T-dn:5’-GCAAGC TTGTTTAAGGAATCCATCTTTA-3’(200 bp)为引物分别进行正常PCR,得到spt15基因表达的启动子和终止子。反应条件:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃ 30 min,循环30 次;72 ℃2 min;4 ℃保存。PCR体系(50 µL)为:10×Buffer5 μL,MgCl2(25 mmol/L)3 μL,dNTP(1∶1∶1∶1)4 μL,上引物1 μL,下引物1 μL,DNA 模板0.5 μg,Taq聚合酶(5 U/μL)0.25 μL,无菌水35.2 μL。
1.3.2 易错PCR扩增
易错PCR扩增条件为:分别改变反应体系中Mg2+浓度和dNTP中dATP、dTTP、dCTP、dGTP比例,以T酵母DNA为模板,以ZrSPT15-up:5’-GCGTCGACATGGCTG ACGAGGGACGTTT-3’,ZrSPT15-dn:5’-GCCTGCAGC TACATTTTCCTGAATTCAC-3’(720 bp)为引物。反应结束收集反应产物。
1.3.3 酶切、连接反应
启动子用限制性内切酶KpnI和SacI、终止子用限制性内切酶SphI和HindIII双酶切[27]后,经DNA连接酶与载体质粒YEplac195连接[20],构建成YEplac195-P-T。将spt15基因突变库中的基因和YEplac195-P-T用限制性内切酶SalI和PstI进行双酶切,并经DNA连接酶进行连接反应,得到YEplac195-P-T-spt15基因突变质粒库。
1.3.4 酵母细胞的转化及转化子筛选
采用化学转化法[27-28]将YEplac195-P-T-spt15质粒导入W303和WM2菌株中,用CM-URA固体培养基培养。将培养基中长出的单菌落用无菌牙签分别在含2% NaCl CM-URA培养基、4% NaCl CM-URA培养基和6% NaCl CM-URA培养基中对长出的菌落进行点接,每个培养皿中的菌株一一对应、排列整齐,并给每对培养基编号,并做Dilution验证。
1.3.5 Dilution实验
取培养过夜的菌液测OD值,根据OD值取菌数量相同得菌液量进行离心,之后用无菌水进行梯度稀释,一般稀释5 个浓度梯度。稀释之后取1 μL在平板中相同梯度的菌液一一对应进行点接。
1.3.6 酱油氨基酸态氮的测定
对耐盐性好的WM2酵母进行低盐固态发酵[29],用双指示剂甲醛滴定法[30]对酱油中氨基酸态氮进行简单测定。
2 结果与分析
2.1 易错PCR体系建立及spt15基因突变库的构建
2.1.1 改变Mg2+浓度
普通PCR体系中的MgCl2(溶液原始浓度25 mmol/L)的终浓度一般为1 mmol/L左右。本实验将MgCl2终浓度设置成1 mmol/L以上,经易错PCR后,琼脂糖凝胶电泳见图1。


图1 不同MgCl2添加量PCR产物电泳图Fig.1 Electrophoretogram of PCR products with different amounts of MgCl2 addition
MgCl2浓度2.0~2.7 mmol/L之间的电泳条带比较明亮,随着MgCl2浓度的不断增加,所得电泳条带又开始变暗。为得到较多的易错PCR产物,本实验以MgCl2浓度2.0~2.7 mmol/L为条件重复3 次易错PCR实验,将所得的PCR产物全部收集,并进行纯化,共得到3 管易错PCR产物。
2.1.2 改变4 种dNTP的添加比例

图2 改变不同碱基添加量所得电泳图Fig.2 Electrophoretogram of PCR product with different amounts of dNTP addition
普通PCR体系中4 种碱基(dATP-dTTP-dCTP-dGTP)比例为1∶1∶1∶1。在进行易错PCR时,每次改变体系中4 种碱基(dATP-dTTP-dCTP-dGTP)其中一种碱基的添加量其他3 种保持不变,以得到不同的比例。琼脂糖凝胶电泳后见图2。
从图2可以看出,dATP-dTTP-dCTP-dGTP中改变dATP时比例在1∶1∶1∶1~3.6∶1∶1∶1之间的电泳条带较亮,之后的电泳条带较暗。改变dTTP时比例在1∶1∶1∶1~1∶4.0∶1∶1之间时电泳条带比较明亮,之后条带比较暗。改变碱基dCTP量所得PCR产物的电泳条带总体不亮。改变碱基dGTP的量所得到的电泳图像总体明亮,即使碱基dATP-dTTP-dCTP-dGTP比例在1∶1∶1∶4.0时仍有很亮条带。本实验在电泳条带较亮的范围进行3 次平行实验,收集产物。主要以dATP-dTTP-dCTP-dGTP比例在1∶1∶1∶1~3.6∶1∶1∶1、1∶1∶1∶1~1∶4.0∶1∶1、1∶1∶1∶1~1∶1∶4.0∶1、1∶1∶1∶1~1∶1∶1∶4.4之间进行PCR产物的收集,共收集12 管。
在Mg2+浓度和4 种碱基dATP-dTTP-dCTP-dGTP不同比例这几个方面进行易错PCR,并且分别进行3 次平行实验,将所得PCR产物进行收集、纯化,共得到15 管易错PCR产物,所收集的易错PCR产物为spt15基因突变库。
2.1.3 spt15基因突变质粒库的构建
将经KpnI和SacI双酶切后切胶回收的启动子和载体YEplac195片段进行连接,得到YEplac195-P。经SphI和HindIII双酶切后的终止子和载体YEplac195-P进行连接,得到YEplac195-P-T。将SalI和PstI双酶切的spt15切胶回收得到基因片段与YEplac195-P-T用DNA连接酶进行连接,得到YEplac195-P-T-spt15,如图3所示。

图3 重组质粒YEplac195-P-T-spt15Fig.3 Recombinant plasmid pattern of YEplac195-P-T-spt15
在spt15基因突变质粒库的构建过程中,得到一个既含有YEplac195-P-T-spt15重组体、YEplac195-P-T片段自连重组体,也含有游离spt15片段和YEplac195-P-T片段的混合体系。将混合体导入大肠杆菌中,YEplac195-P-T-spt15重组体,YEplac195-P-T片段自连重组体会在LBA平板上生长,随机挑取18 个单菌落,编号完整,摇瓶过夜培养,提取质粒,进行双酶切筛选。

图4 重组质粒YEplac195-P-T-spt15双酶切电泳图Fig.4 Electrophoretogram of double enzyme digestion of recombinant plasmid YEplac195-P-T-spt15
从图4可知,双酶切后出现720 bp条带的为已成功连接spt15基因片段的YEplac195-P-T质粒,可以计算出连接spt15基因片段的效率在50%左右,证明连接基因片段的方法可行性较好,对于连接的片段是否为所需要的目的基因片段还需进一步的验证。
2.2 优势菌株的筛选
2.2.1 W303+G菌株筛选
本实验将所收集的YEplac195-P-T-spt15重组体导入W303[24-25],涂布在尿嘧啶营养缺陷型平板上,30 ℃倒置培养3~5 d,待长出白色菌落后,随机挑取长势良好的菌落划线转接到含2% NaCl的尿嘧啶营养缺陷型平板上,放于30 ℃培养箱中倒置培养3~5 d,待长出菌落后,继续挑取长势旺盛的菌落划线转接到含4% NaCl的尿嘧啶营养缺陷型平板上,经培养继续划线转接到6% NaCl的尿嘧啶营养缺陷型平板上。W303酵母生长情况见图5。
既往研究认为,JME难以治愈,即使癫痫长时间内得到控制,绝大多数病人也需要终生服药。近年来有些长期随访研究提示,在一些JME患者中,并不需要终身服用抗癫痫药物,停药数年后仍可保持发作终止,预后良好,有望治愈[28-29]。JME预后与发作类型、确诊时间、用药情况、脑电图表现等诸多因素有关,早期正确诊断,特别是赶在GCTS出现之前给予及时合理治疗,预后会更好,因此,更多的临床医生加强对此病的认识和判断,非常有意义。

图5 筛选耐盐酵母的过程Fig.5 Screening of salt-tolerant yeast
从图5可以看出,在含2% NaCl的平板中W303+G菌株长势都很好,经梯度增加NaCl后,在含6% NaCl的平板中只有少数W303+G菌株生长较好。在含6% NaCl的尿嘧啶营养缺陷型平板上随机挑取长势旺盛的4 个单菌落,分别命名为A1、A2、A3、A4。进行尿嘧啶缺陷型液体培养基过夜培养,提取质粒a1、a2、a3、a4,导入WM2中,进行过夜培养,测OD值,取相同数量的菌体进行Dilution实验。
2.2.2 WM2+G菌株Dilution实验
将a0(不含spt15基因的质粒)、a1、a2、a3、a4质粒导入WM2菌株,在不同盐浓度的尿嘧啶缺陷型平板上做Dilution实验,结果如图6所示。

图6 WM2G菌株梯度稀释结果图Fig.6 Gradient ddilution of WM2 + G
从图6可以看出,在相同菌个数的情况下,导入a1、a2、a3、a4质粒的菌株比导入a0的菌株生长状况要好,可以判断含突变基因的菌株在耐盐方面比对照菌株要好。
2.2.3 PCR后测序验证
将得到的a1、a2、a3、a4质粒进行PCR,看是否有目的条带,并将所得的PCR产物进行测序。将重组质粒的PCR产物送至测序公司。测序结果使用DNAMAN对测序结果和目的基因序列进行比对见图7。
从图7可以看出,构建后的重组质粒a1、a2、a3和a4中目的基因的序列有碱基的增添、缺失、替换等突变的出现。通过统计分析,在所有突变的碱基中,可得A、G互换的频率较高,其中A、G互换率为28.9%,A、T互换率为19.3%,C、T互换率为24.7%,其他突变率为11.5%。
2.2.4 酱油发酵
将所得的4 个质粒导入本实验室诱变所得的WM2菌株中得WM2+G,在低盐固态酱油的发酵过程中加入WM2+G菌株,待发酵成熟后测定氨基酸态氮的含量,所得结果见图8。
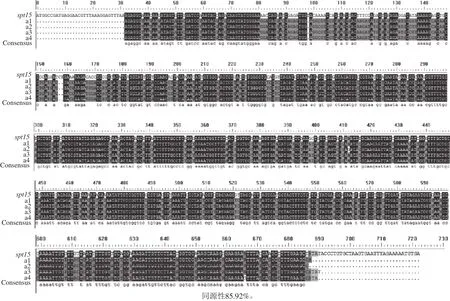
图7 重组质粒表达载体的测序结果Fig.7 Sequencing results of the expression vectors

图8 氨基酸态氮的测量结果Fig.8 Amino nitrogen contents of soy sauces fermented by four mutants
由图8可以看出,a0、a1、a2、a3、a4的氨基酸态氮质量浓度分别为0.8、0.92、0.90、0.86、0.90 g/100 mL。含a1、a2、a3、a4质粒的WM2+G菌株比含a0(不含spt15的YEPlac195质粒)的WM2+G菌株在发酵酱油的过程中能产生更多的氨基酸态氮,经数据分析可得出,含a1、a2、a3、a4质粒的菌较含a0的菌在发酵过程中氨基酸态氮的增加率分别为15%、12.5%、7.5%、12.5%。可知,所筛选的菌株能够在盐浓度高的环境中更好地降解蛋白质,得到更多的氨基酸态氮。这对于高盐稀态酱油发酵是有利的,同时也可知通过易错PCR随机诱变的方法可以得到有利于酱油发酵的突变基因。
3 结 论
分别在Mg2+浓度和4 种碱基dATP-dTTP-dCTP-dGTP不同比例这两个方面进行易错PCR,并且分别进行3 次平行实验,将所得PCR产物进行收集、纯化,共得到18 管易错PCR产物,所收集的易错PCR产物为spt15基因突变库。从所得到的spt15基因突变库中取部分突变基因,经重组体构建,导入W303菌株,尿嘧啶缺陷型平板的筛选,选出了4 个耐盐性较好的菌株A1、A2、A3、A4,并提取出质粒a1、a2、a3、a4。
将得到的4 个重组质粒a1、a2、a3、a4导入本实验室诱变的尿嘧啶缺陷型菌株WM2中,WM2+G经Dilution实验可以看出含4 个质粒的酵母菌株在耐盐方面有一定的优势。在进行酵母发酵中,加入分别含有a0(不含突变基因的质粒)、a1、a2、a3、a4质粒的WM2+G菌株,经过氨基酸态氮的测定,含a1、a2、a3、a4质粒的WM2+G菌株的发酵液中比含a0质粒的WM2+G菌株的发酵液中氨基酸态氮的含量要高。关于所得最佳突变基因会在酱油发酵中提高氨基酸态氮含量的原因,其与发酵环境的机理以及在菌株中的发挥作用的方式等还需进一步的实验探究。此菌株还不能直接用于实际生产,需进行多方面的验证实验。

