气相色谱法测定盐酸林可霉素原料药中有机溶剂残留量
刘瑞华,赵德强
1.新宇药业股份有限公司,宿州,234000;2.宿州市兽药饲料管理站,宿州,234000
林可霉素(Lincomycin)及其衍生物是一类在临床上具有重要意义的林可酰胺类抗生素,主要用于治疗革兰氏阳性菌引起的感染[1]。盐酸林可霉素(Lincomycin hydrochloride)对金葡菌、链球菌、沙门氏菌、大肠杆菌均有显著的抑制作用,对于支气管炎等病症疗效显著[2],在临床上多用于治疗化脓性炎症和感染以及骨质炎症,也可作为抗疟疾药物,具有重要的临床意义和药用价值[3]。药品中的残留溶剂是指在原料药及辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂[4]。残留溶剂超过安全值后会对人体造成一定损害,因此要控制生产过程中有机溶剂残留的含量[5]。本文采用气相色谱法检测新宇药业股份有限公司生产的盐酸林可霉素原料药中有机溶剂残留含量,主要溶剂残留为丙酮和丁醇。方法简便,结果准确。
1 仪器与方法
1.1 仪 器
Agilent GC7890型气相色谱仪(美国Agilent 公司);顶空进样器。
1.2 试剂及药品
丙酮、丁醇均为分析纯;超纯水由超纯水仪制备;盐酸林可霉素原料药3个批次样品(新宇药业股份有限公司提供,批号为:17122098-1,17122098-2,17122098-3)。
1.3 色谱条件
色谱柱:DB-624(125-1334),30.0 m×0.53 mm×3 μm;柱温:50 ℃(2 min, 12 ℃/min)→130 ℃(4 min);进样口:分流模式,分流比1:5,汽化温度200 ℃;载气:N2;FID检测器:温度为250 ℃,氢气流量为30 mL/min,空气流量为300 mL/min ;进样体积:1.0 mL[6-7]。
DK3001顶空进样器检测条件[8]:油浴温度:90 ℃;阀箱温度:100 ℃;管路温度:110 ℃ 平衡时间 30 min。
1.4 试验样品的制备
1.4.1 丙酮、丁醇贮备液:
准确称取丙酮、丁醇各0.5 g至已盛有约50 mL超纯水的100 mL容量瓶中,然后用超纯水稀释至刻度,混匀,备用。
1.4.2 标准溶液:
准确吸取丙酮、丁醇贮备液各5 mL至已加50 mL超纯水的100 mL容量瓶中,再用超纯水定容至刻度线,混匀即得100 μg/mL的标准溶液。
1.4.3 样品溶液:
准确称取盐酸林可霉素原料药1g,至10 mL容量瓶中,用超纯水稀释至刻度,混匀即得0.1 g/mL的样品溶液。
1.5 测定方法
分别移取8.0 mL空白溶液1份、标准溶液9份、样品溶液3份于不同的20 mL顶空样品瓶中,立即盖封;按检测参数设定仪器条件,待系统稳定后依次进样并记录图谱,按下式计算各残留溶剂的量:
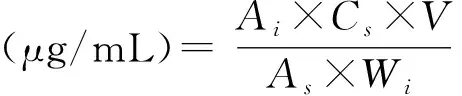
式中:Ai为进样样品溶液所得图谱中相应组分峰面积响应值;As为6次平行进样标准溶液所得图谱中相应组分峰面积响应值的平均值;Cs为标准溶液中响应组分的实际浓度;Wi为样品质量;V为样品溶液的体积。
2 结果与分析
2.1 专属性检测
空白溶剂:超纯水。峰定位溶液:取上述1.4.2下所配标准溶液作为丙酮峰定位溶液和丁醇峰定位溶液。混合对照样:精密量取丙酮和丁醇标准溶液各1 mL加入到10 mL容量瓶中,用超纯水定容,作为混合对照溶液。分别取上述溶液适量进样1 μL,测试结果见表1。
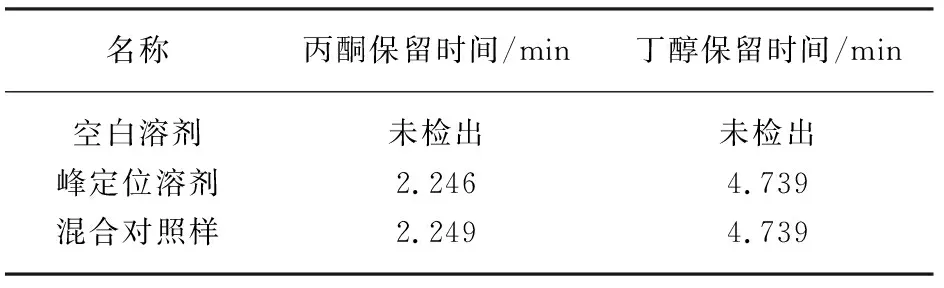
表1 专属性检测结果
2.2 线性关系
精确量取上述1.4.2下所配标准溶液,据 ICH 指南 Q3C(R3)[9]中各残留溶剂的最低限以超纯水配置出一系列浓度梯度的标准溶液。取上述各溶液适量,顶空进样1 μL,记录色谱图如图1,以峰面积对浓度进行线性回归。计算所得结果为表2。
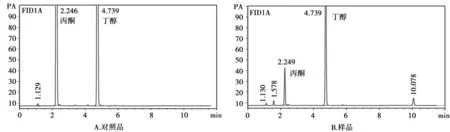
图1 样品溶液的气相色谱图
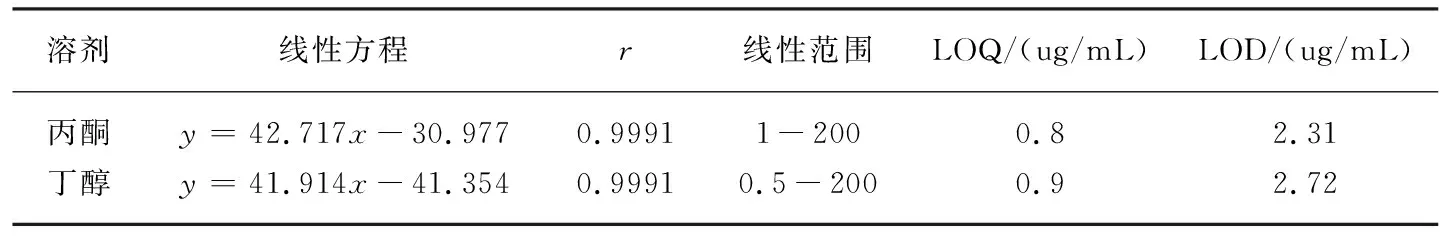
溶剂线性方程r线性范围LOQ/(ug/mL)LOD/(ug/mL)丙酮y=42.717x-30.9770.99911-2000.82.31丁醇y=41.914x-41.3540.99910.5-2000.92.72
2.3 精密度
取上述1.4.2下8 mL丙酮和丁醇标准溶液各3份于不同的20 mL顶空样品瓶中,立即盖封。放入气相色谱中进行测定,根据其保留峰面积计算丙酮和丁醇的RSD分别为2.1%、1.8%。均小于2.5%,表明精密度良好,满足实验要求。
2.4 回收率
标准溶液:分别移取1.4.1项下储备溶液4.0 mL、5.0 mL、6.0 mL到50 mL量瓶,用超纯水定容至刻度线,摇匀,得到3个相对标准溶液浓度分别为 80%、100%、120%的溶液。回收率检测液:精密称取200 mg 的样品到顶空瓶 3份,分别加入2 mL 80%、100%、120%的 3个不同浓度的溶液,每个浓度各取 3份,按照前述分析方法测定。结果测得丙酮的平均回收率为 97.02%,RSD 为 1.4%;丁醇的平均回收率为 98.89%,RSD为 1.7%。
2.5 样品测定
精密移取上述1.4.3方法下所制样品溶液8.0 mL,按照1.5所述方法进行样品含量测定。通过检测峰面积并通过上述计算公式计算可得样品中各溶剂残留含量。结果如表3所示。
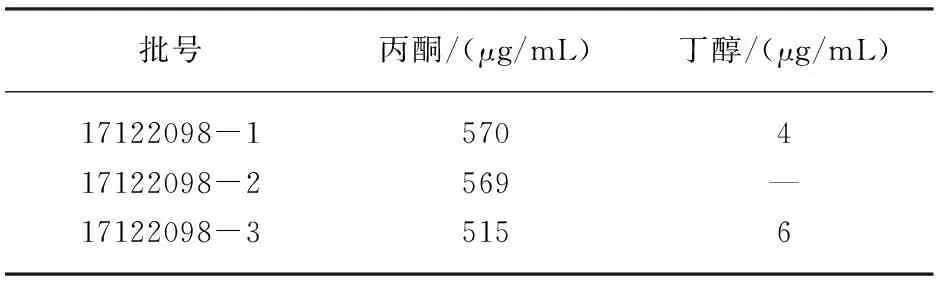
表3 样品中溶剂残留检测结果
注:“—”表示未检测出或含量小于定量限。
3 结果与结论
3.1 色谱柱的选择
由于药物中的残留溶剂丙酮和丁醇的极性差异较大,因此对色谱柱的要求比较高。色谱柱的极性过大或过小,都不能使残留溶剂得到较好分离[10]。通过尝试不同极性的色谱柱,经多次试验并结合文献最终发现,中等极性的DB-624色谱柱可以使药物中残留溶剂达到较好分离效果[11-12]。
3.2 色谱条件的选择
残留溶剂丁醇的沸点和丙酮的沸点相差较大[13],因此我们采用逐渐升温程序,先使沸点低的溶剂分离出来,然后再迅速升温分离高沸点的溶剂,加快分离残留溶剂的时间,缩短了分析时间。
本实验采用气相色谱法检测三种不同批次的盐酸林可霉素原料药中残留溶剂的含量。结果表明采用顶空进样的方式在该色谱条件下,精确度高,操作简单,可快速准确地检测盐酸林可霉素原料药中残留溶剂(丙酮,丁醇)的含量。
经上述实验结果分析,我们所检测的三种不同批次的盐酸林可霉素原料药中溶剂残留丙酮和丁醇的回收率在97%—102%,RSD均小于2.5%,且r>0.999具有良好的线性关系。根据盐酸盐酸林可霉素USP转化及规格中对于丙酮(≤1000 μg/mL)和丁醇(≤500 μg/mL)的残留含量规定[14],我们所检测的样品中残留溶剂含量远低于此标准,减少了药物中有机溶剂残留对人体的伤害,说明新宇药业股份有限公司对处理盐酸林可霉素原料药中有机溶剂残留的方法可行,所生产的盐酸林可霉素原料药为优质产品。

