硒化低聚氨基多糖对RAW264.7细胞的免疫调节作用
顾丽霞,郑 斌,,相兴伟,,,闻正顺,,周宇芳,马剑茵,曲有乐
(1.浙江海洋大学食品与医药学院,浙江 舟山 316022;2.浙江省海洋开发研究院,浙江 舟山 316021)
硒是机体必需微量元素,缺硒会引起多种疾病,如儿童的营养不良、食欲不振、溃疡性结肠炎、关节炎、大骨节病、心血管疾病、免疫力低下等[1]。美国食品和营养委员会提出成人每天摄入硒的安全范围推荐量为50~200 μg。自然界中的硒元素主要以无机硒和有机硒两种形式存在,虽均能被机体吸收,但相对而言,有机硒化合物毒性远低于无机硒,且生物利用率更高;因此有机硒已逐步成为医药、食品保健等诸多领域的研究对象[2]。有机硒主要是硒蛋白、硒多糖等,其中硒多糖为硒和多糖的结合产物,该化合物既能有效避免补充无机硒所引起的毒性反应,又保留了多糖的生物活性;且研究表明,硒多糖的生物活性不只是硒和多糖活性的简单相加,其更是具备较高的或新的生物活性,易于机体吸收和利用[3-4]。天然硒多糖一般存在于植物或微生物中,但普遍含量较低,且提取方法还不够成熟,提取成本较高,因此制约了其开发应用。通过多糖硒化修饰或人工合成等化学方法获得硒多糖是解决上述问题的有效途径,当前这项研究正处于起步阶段,目前已成功合成了南瓜、茶和大蒜等植物多糖硒酸酯[5-7]。
壳聚糖是由广泛存在于虾、蟹等甲壳类动物外壳中的天然高分子聚合物——甲壳素分子脱乙酰基后的产物,其是天然有机化合物中数量仅次于纤维素的一大类含氮有机化合物,是一种丰富的可再生资源[8],因壳聚糖还具有一些独特的生物活性,如抗微生物、抗氧化、增强免疫功能、抑制肿瘤等;因此被广泛应用于生物医药、食品工程等领域[9-11]。目前已有研究证实水溶性的低分子质量壳聚糖能显著增强正常小鼠的部分免疫指标,提高小鼠的免疫能力[12],但针对壳聚糖的硒化修饰及体外免疫调节活性研究较少。本实验依据课题组前期研究的优化结果[13],通过化学合成法,在体外适宜的条件下使低聚氨基多糖与无机硒结合获得硒化低聚氨基多糖(low molecular seleno-aminopolysaccharide,LSA)。所得LSA硒含量为27.3 mg/g,其中由Na2SeO3提供硒源,所用的低聚氨基多糖(亦称低分子壳聚糖)分子质量约为50 kDa。
巨噬细胞以不同形式广泛分布于机体不同组织中,是具有多种功能的免疫效应细胞,其不但参与机体的特异性免疫反应和非特异性免疫反应,而且是两种免疫反应联系的“桥梁细胞”。巨噬细胞不仅能够分泌多种细胞因子及炎症介质,且对病原微生物及癌细胞表现出较高的吞噬能力,能够杀灭和消化机体内抗原性异物[14]。此外,巨噬细胞也能发挥专职抗原递呈细胞的作用,将抗原加工处理并递呈给抗原特异性T、B淋巴细胞,启动免疫反应。因此,本实验以小鼠巨噬细胞系RAW264.7细胞作为研究对象,探讨LSA对巨噬细胞RAW264.7免疫活性的影响,为LSA在免疫学方面的研究利用提供参考依据,同时促进硒源的开辟以及壳聚糖资源的合理深加工。
1 材料与方法
1.1 材料与试剂
LSA由本实验室合成。RAW264.7小鼠单核巨噬细胞系由浙江大学赠予。
高糖杜尔伯科改良依格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)、澳洲胎牛血清(fetal bovine serum,FBS)、胰酶 美国Gibco公司;总RNA提取(total RNA isolation,TRIzol)试剂 美国Invitrogen公司;反转录试剂盒、SYBR Premix Ex Taq(Tli RNaseH Plus)试剂盒 宝生物工程(大连)有限公司;白细胞介素(interleukin,IL)-6、IL-10及肿瘤坏死因子(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 武汉博士德生物工程有限公司;脂多糖(lipopolysaccharide,LPS)、噻唑蓝(methyl thiazol tetrazolium bromide,MTT) 美国Sigma公司;引物通过Primer Premier 5.0软件设计,由生工生物工程(上海)股份有限公司合成;其他试剂均为分析纯。
1.2 仪器与设备
SeriesⅡ细胞培养箱、Multiskan FC全自动酶标仪 美国Thermo Scientific公司;OptiMair™垂直流超净工作台 新加坡艺思高科技有限公司;DMIRB型倒置显微镜 德国Leica公司;5415D高速冷冻离心机德国Eppendorf公司;ND-2000核酸蛋白定量仪 美国Thermo Scientific公司;MyCycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;ABI ViiA™ 7实时荧光定量PCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 细胞培养及处理
RAW264.7细胞用含10%胎牛血清的DMEM(高糖)完全培养液于37 ℃、5% CO2细胞培养箱中传代培养。实验取指数生长期的RAW264.7细胞,经预热磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次,然后用1 mL 0.25%胰酶消化2~3 min,加入DMEM(高糖)完全培养液终止消化,反复轻柔吹打,收集细胞,用PBS洗涤2 次,细胞计数板进行计数,根据实验需要调整细胞浓度进行铺板,用于后续实验。
1.3.2 MTT法检测细胞增殖活性
对数生长期RAW264.7细胞按1×104个/孔接种至96 孔板,过夜培养后弃上清液,分别加入含不同硒质量浓度的LSA(硒的终质量浓度分别为100、200、400、600、800、1 000、1 200、1 400、1 600 µg/L)或Na2SeO3(硒的终质量浓度分别为100、150、200、250、300、350、400、450、500 µg/L)培养液200 µL,空白对照组只加DMEM(高糖)完全培养液。每组设置6 个复孔,37 ℃、5% CO2培养30 h。之后弃培养液,每孔加入200 µL含MTT(MTT终质量浓度为0.5 mg/mL)的新鲜细胞培养液,继续孵育4 h,4 000 r/min离心10 min,小心吸去各孔液体,并加入150 µL二甲基亚砜溶解生成的甲臜,于490 nm波长处测定吸光度。依照公式(1)计算细胞相对增殖率。

1.3.3 RAW264.7细胞形态的变化
对数生长期RAW264.7细胞按2×105个/孔接种至6 孔板,过夜培养后弃上清液,在LSA处理组中分别加入含不同质量浓度硒的LSA(200、600、1 000 µg/L)培养液2 mL,阳性对照组加入终浓度为500 ng/mL的LPS,37 ℃、5% CO2培养24 h后,在倒置显微镜下观察细胞形态变化。
1.3.4 中性红法检测细胞吞噬能力
对数生长期RAW264.7细胞按1×104个/孔接种至96 孔板,过夜培养后弃上清液,按实验分组分别进行加药处理。实验分组如下:空白对照组、阳性对照组(500 ng/mL LPS)和不同硒质量浓度(100、200、400、600、800、1 000 µg/L)的LSA处理组。细胞孵育24 h后,弃上清液,每孔加入200 µL含0.075%中性红的生理盐水继续培养4 h,预热PBS洗涤3 遍,每孔加入200 µL乙醇-乙酸溶液(含50%乙醇、1%乙酸、49%水)于4 ℃静置过夜,通过酶标仪在540 nm波长处测定溶液吸光度,并按公式(2)计算中性红吞噬率。

1.3.5 细胞因子分泌水平测定
RAW264.7细胞按3×105个/孔密度接种至6 孔板,过夜培养后弃上清液,按如下分组进行加药处理。1)空白对照组:DMEM(高糖)完全培养基培养;2)阳性对照组:DMEM(高糖)完全培养基中加入终质量浓度为500 ng/mL的LPS;3)LSA组:完全培养基中加入不同硒质量浓度(200、600、1 000 µg/L)的LSA;4)Na2SeO3组:以低剂量LSA组中硒质量浓度为准,完全培养基中加入相同硒质量浓度(200 µg/L)Na2SeO3;5)低聚氨基多糖组:以低剂量LSA组中低聚氨基多糖浓度为准,完全培养基中加入相同质量浓度低聚氨基多糖(低聚氨基多糖的终质量浓度7 126 µg/L);6)Na2SeO3+低聚氨基多糖组:以低剂量LSA组中LSA的硒质量浓度及低聚氨基多糖浓度为准,完全培养基中加入相同硒质量浓度200 µg/L的Na2SeO3及7 126 µg/L低聚氨基多糖。其中LSA及Na2SeO3的添加量均以硒计算。
采用不同的处理时间(细胞处理24 h后,检测IL-6及TNF-α的质量浓度;细胞处理30 h后,检测IL-10的质量浓度)孵育细胞,到规定处理时间后收集细胞上清液,1 500 r/min离心5 min取上清液。按照ELISA试剂盒说明书检测细胞培养液中细胞因子IL-6、IL-10及TNF-α的水平。
1.3.6 细胞因子mRNA相对表达水平的测定
对数生长期RAW264.7细胞按3×105个/孔接种至6 孔板,过夜培养后弃上清液,按照1.3.5节所述实验分组进行给药处理。经不同的处理时间(细胞处理18 h后,检测细胞IL-6及TNF-α mRNA表达情况;细胞处理24 h后,检测细胞IL-10 mRNA表达情况)孵育细胞后,胰酶消化收集细胞,PBS洗涤3 遍后转移至无RNA酶的EP管中,加入1 mL预冷TRIzol试剂,反复吹打裂解细胞,冻存于-80 ℃冰箱用于后续检测。
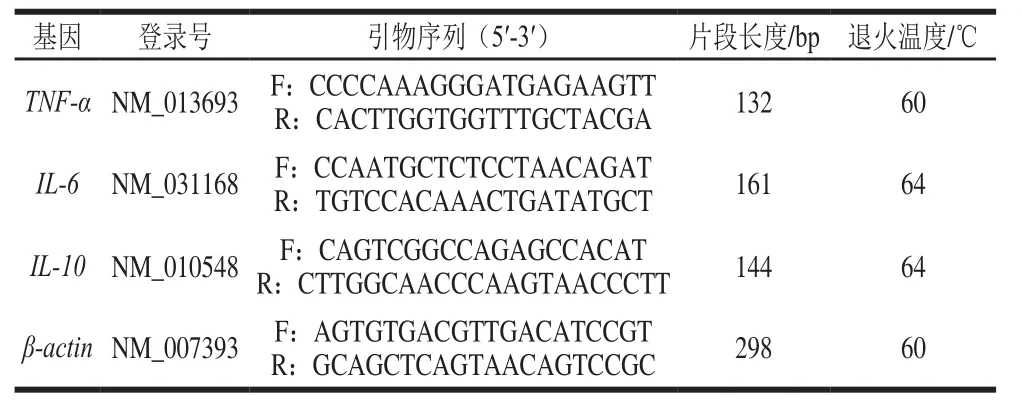
表1 实时荧光定量PCR反应引物序列Table1 Oligonucleotide primers used in qPCR
根据GenBank已报道的小鼠IL-6、IL-10、TNF-α及β-actin基因序列,用Primer Premier 5.0软件设计相应特异性引物,并由上海生物工程公司合成(表1)。取出冻存于-80 ℃冰箱中的细胞,按TRIzol试剂法提取细胞总RNA。用核酸蛋白定量仪检测OD260nm/OD280nm、OD260nm/OD230nm及RNA质量浓度,并通过琼脂糖凝胶电泳检测所提RNA的完整性。检测后的总RNA根据反转录试剂盒(PrimeScript™ Ⅱ 1stStrand cDNA Synthesis Kit)说明书反转录合成cDNA。按照荧光定量试剂盒(SYBR Premix Ex Taq(Tli RNaseH Plus)说明书配制PCR体系,反应总体积为20 µL:SYBR Green qPCR mix 10.0 µL、ROXⅡ 0.4 µL、cDNA 2.0 µL、ddH2O 6.8 µL,上、下游引物(10 µmol/L)各0.4 µL。其扩增条件均为预变性50 ℃ 120 s,95 ℃ 10 min;95 ℃变性15 s,相应退火温度(表1)60 s,循环40 个。荧光的采集与溶解曲线的制作按照荧光定量PCR仪的说明进行。每个样品靶基因的相对mRNA表达水平用2-∆∆Ct计算,其中以β-actin为内参基因。每个样品3 个重复。
1.4 数据统计分析
2 结果与分析
2.1 LSA、Na2SeO3对RAW264.7细胞增殖的影响
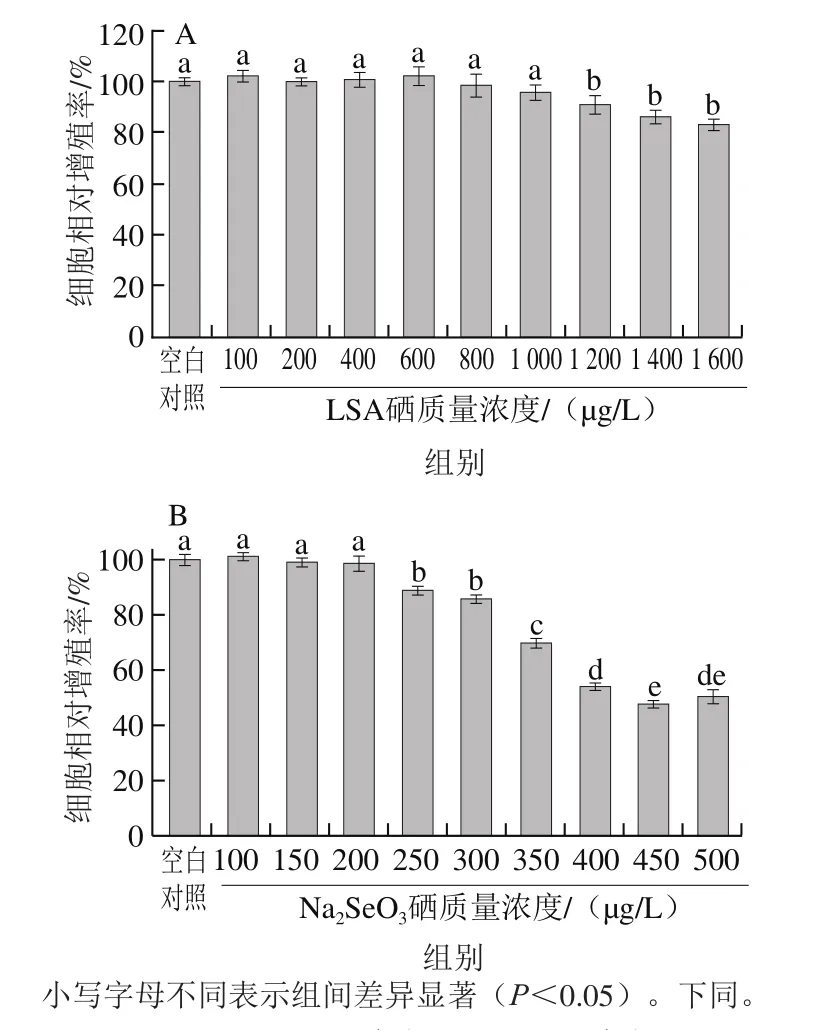
图1 不同硒质量浓度LSA(A)和Na2SeO3(B)对RAW264.7细胞增殖的影响Fig. 1 Effects of different selenium concentrations of LSA (A) and sodium selenite (B) on RAW264.7 cell proliferation
由图1A可知,LSA处理RAW264.7细胞30 h后,相比于空白对照组,硒质量浓度为100~1 000 μg/L的LSA对细胞的相对增殖率无显著影响;而当LSA硒质量浓度为1 200~1 600 μg/L时,细胞的相对增殖率则显著降低(P<0.05)。由图1B可知,Na2SeO3处理RAW264.7细胞30 h后,与空白对照组比较,硒质量浓度为100~200 μg/L的Na2SeO3对RAW264.7细胞增殖无显著影响;而当Na2SeO3的硒质量浓度大于250 μg/L时,细胞的相对增殖率显著降低(P<0.05)。
比较不同硒质量浓度LSA、Na2SeO3对RAW264.7细胞增殖率的影响,Na2SeO3细胞毒性大,安全使用范围窄,当硒质量浓度超过200 μg/L时,细胞增殖率骤然降低,且随着硒质量浓度的增大,细胞相对增殖率快速下降;而LSA细胞毒性相对较小,安全适用范围更广。
2.2 LSA对RAW264.7细胞形态的影响

图2 不同硒质量浓度LSA对RAW264.7细胞形态的影响(×200)Fig. 2 Effects of different selenium concentrations of LSA on morphological changes in cultured RAW264.7 cells (× 200)
由图2可知,通过显微镜观察细胞形态发现,未经处理的RAW264.7细胞体积较小,呈圆形;经LSA处理后的细胞主要呈梭形,随着LSA硒质量浓度的增加,细胞逐渐伸出伪足且数量不断增多,呈现一定的剂量依赖关系。而LPS(500 ng/mL)刺激后的细胞,体积明显增大,呈棱形、多角形或者不规则形,细胞内出现空泡,并伴有大量伪足伸出,部分细胞甚至出现漂浮、凋亡的现象。
2.3 LSA对RAW264.7细胞吞噬作用的影响

图3 不同硒质量浓度LSA对RAW264.7细胞吞噬作用的影响Fig. 3 Effects of different selenium concentrations of LSA on phagocytosis in RAW264.7 cells
LPS是巨噬细胞的活化剂,可诱导巨噬细胞分化、成熟。从中性红吞噬实验结果可知,LPS(500 ng/mL)刺激RAW264.7细胞24 h后,其显著提高巨噬细胞的吞噬能力(P<0.05)(图3)。与空白对照组比较,硒质量浓度为400、600、800、1 000 μg/L的LSA,也能表现出与LPS类似的作用,显著提高巨噬细胞的吞噬能力(P<0.05),但与LPS阳性对照组比较,LSA对RAW264.7细胞的刺激效果远低于LPS组(P>0.05)。
2.4 LSA对RAW264.7细胞细胞因子分泌水平的影响

图4 不同硒质量浓度LSA对RAW264.7 TNF-α(A)、IL-6(B)、IL-10(C)分泌水平的影响Fig. 4 Effects of different selenium concentrations of LSA on TNF-α (A), IL-6 (B), IL-10 (C) secretion of RAW264.7 cells
由图4A可知,LSA处理RAW264.7细胞24 h后,与空白对照组比较,硒质量浓度为200、600、1 000 μg/L的LSA能显著提高RAW264.7 TNF-α分泌水平(P<0.05)。由图4B可知,LSA处理RAW264.7细胞24 h后,与空白对照组比较,硒质量浓度为200 μg/L的LSA对细胞的IL-6分泌水平无显著影响;而当LSA的硒质量浓度为600、1 000 μg/L时,IL-6的分泌水平显著提高(P<0.05)。由图4C可知,LSA处理RAW264.7细胞30 h后,与空白对照组比较,硒质量浓度为200、600、1 000 μg/L LSA能显著提高RAW264.7 IL-10分泌水平(P<0.05)。但与LPS阳性对照组比较,各LSA处理组的TNF-α、IL-6及IL-10分泌水平都远远低于。Na2SeO3处理组、低聚氨基多糖处理组及Na2SeO3+低聚氨基多糖复合添加处理组对RAW264.7 TNF-α、IL-6分泌水平均无显著性增强作用。
通过上述实验结果可知,当硒质量浓度均为200 μg/L时,LSA处理组相比于Na2SeO3单独处理组、低聚氨基多糖处理组及Na2SeO3+低聚氨基多糖复合添加处理组,更能有效刺激RAW264.7细胞分泌细胞因子,提高机体免疫能力。但与LPS阳性组比较,LSA刺激细胞所产生的细胞因子水平与远低于LPS组。
2.5 LSA对RAW264.7细胞细胞因子mRNA表达水平的影响
由图5A可知,与空白对照组比较,当LSA处理细胞18 h后,硒质量浓度为200、600、1 000 μg/L的LSA显著提高RAW264.7细胞TNF-α mRNA表达水平(P<0.05),且呈剂量依赖性。图5B显示,LSA处理细胞18 h后,相比于空白对照组,硒质量浓度为200 μg/L的LSA对RAW264.7 IL-6 mRNA表达水平无显著影响;而当LSA的硒质量浓度达600、1 000 μg/L时,RAW264.7 IL-6 mRNA表达水平显著提高(P<0.05)。图5C显示,相较于空白对照组,200、600、1 000 μg/L LSA处理细胞24 h能显著提高RAW264.7 IL-10 mRNA表达水平(P<0.05)。LSA虽能在一定程度上提高TNF-α、IL-6、IL-10 mRNA表达水平,但其刺激效果远低于LPS(P<0.05)。Na2SeO3组、低聚氨基多糖组及Na2SeO3+低聚氨基多糖复合添加组对RAW264.7 TNF-α、IL-6、IL-10 mRNA表达水平均无显著影响。相同硒质量浓度下,LSA对RAW264.7细胞的作用效果优于Na2SeO3组、Na2SeO3+低聚氨基多糖复合添加组。
3 讨 论
巨噬细胞在机体免疫防御、自身稳定及免疫监视中均起着举足轻重的作用。巨噬细胞是天然免疫应答的主要参与者[15-16],活化的巨噬细胞可以直接杀伤病原微生物、抑制肿瘤细胞生长、清除凋亡细胞和突变细胞,并通过分泌TNF-a、IL-1、IL-6及NO等免疫活性分子参与和调控天然免疫防御和特异性免疫应答[17-19]。
大量研究表明,硒为机体必需微量元素之一,参与机体多种生物系统,如氧化还原系统、内分泌系统、免疫调节系统及生殖系统等[20-22],可是当其以无机硒的形式使用时毒性较大,不慎过量摄入会对机体造成严重的毒害作用。本实验MTT结果也显示,相比于Na2SeO3,LSA作为一种有机硒化合物对RAW264.7细胞的毒性作用小,安全使用范围更广,这与文献[23]报道的结果基本一致。巨噬细胞是继上皮细胞屏障后抵抗病原菌感染的第一道防线,当病原微生物侵入机体出现病理性变化时,巨噬细胞会通过识别抗原表面的受体,使自身活化,进而增强吞噬能力及时清除病原体。中性红实验结果显示,LSA能显著增强RAW264.7细胞的吞噬活性,提示LSA可增强巨噬细胞病原体吞噬作用,从而保护机体免受感染。活化的巨噬细胞还会通过分泌各种细胞因子(TNF-α、IL-6、IL-10、IL-1β等)及炎症介质(NO、前列腺素等)调控机体免疫应答反应,当然这些细胞因子的表达和调控并不是独立的,而是相互作用、相互协调的[24]。其中TNF-α是活化巨噬细胞杀灭病原体的主要效应因子,同时也是典型的前炎症细胞因子,其可介导天然免疫和获得性免疫,激活免疫细胞,并启动其他细胞因子的分泌,前炎症细胞因子的适量产生有助于激发机体正常的免疫功能,利于机体抵御感染;但过量产生则会对机体产生负面影响,造成不同程度的损伤[25-26]。巨噬细胞根据功能特性及其诱导产生的Th1型或Th2型免疫应答的不同,通常相应地分为M1和M2两型[27-28]。TNF-α即是M1型巨噬细胞的标志性细胞因子,具有直接杀伤肿瘤细胞的功能;IL-6和IL-10则是M2型细胞的标志性细胞因子,IL-6既具有促炎的功效,同时又具备一定的抗炎作用[29],而IL-10则主要发挥抗炎的作用,控制机体炎症反应程度[30]。LPS是革兰氏阴性菌细胞壁的主要成分,在动物细胞实验中,常被用于诱导炎症的发生。免疫学研究中则常以RAW264.7细胞为研究对象,通过LPS建立相应的炎症模型,从而进行一系列的实验探讨。LPS会致使巨噬细胞产生大量的炎症性因子,进而形成瀑布效应使巨噬细胞过度活化,表现出强烈的炎症反应,甚至引发死亡[31]。本次细胞实验显示,经LPS刺激的RAW264.7细胞,体积明显增大,细胞内出现许多空泡,并伴有大量伪足产生,部分细胞甚至出现漂浮、凋亡的现象,同时细胞培养液中炎症细胞因子IL-6、TNF-α及抗炎细胞因子IL-10水平均急剧大幅度上升,表明RAW264.7细胞免疫功能被过度激活。而经LSA处理的RAW264.7细胞IL-6、TNF-α分泌水平虽也上升,但其刺激效果远比LPS弱,且LSA在增加促炎症细胞因子分泌的同时也增强了抗炎细胞因子IL-10的分泌水平,提示LSA在激活RAW264.7细胞免疫功能的同时也避免过度刺激细胞,维持免疫平衡状态。此外,基因水平检测到的细胞因子mRNA表达水平与ELISA结果基本一致,说明LSA可能通过促进细胞因子基因表达量来调控细胞因子的分泌水平,进而对RAW264.7细胞起到一定的免疫调节作用。同时,通过比较同等硒质量浓度下Na2SeO3单独处理组和Na2SeO3+低聚氨基多糖复合添加组的作用效果可知,LSA组的免疫调节效果更好。
综上所述,LSA作为一种有机硒化合物能显著增强RAW264.7细胞的吞噬能力,并促进细胞TNF-α、IL-6和IL-10分泌及其mRNA表达水平,提示LSA可通过刺激巨噬细胞诱导产生新的Th1/Th2免疫平衡反应,从而提高机体免疫能力。本研究为将LSA开发成为一种绿色补硒保健产品提供了一定的理论依据,同时拓宽硒源及壳聚糖资源的合理利用范围。

