1987-2014年北京市百白破疫苗基础免疫血清学监测结果波动的影响因素
李晓梅 陈萌 张铁刚 董梅 苗良 王凌云 刘维祥 杨洁 孙美平 陈丽娟 黄芳 卢莉
开展疫苗免疫成功率监测的主要目的,是考核和评价疫苗、接种的质量和效果,并作为调整免疫规划的依据[1]。现汇总1987-2014年北京市百白破疫苗基础免疫后抗体水平监测结果,分析结果波动的影响因素,提升对历史资料的科学利用与评价。
1 材料与方法
1.1资料来源 监测数据来源于1987-2014年历次北京市百白破疫苗基础免疫后血清学监测结果。
1.2监测周期与采样变化 北京市自1987年开始百白破疫苗基础免疫后抗体水平监测,每年1次,在城区、近郊区、远郊区各选择1个区,每个区选择婴儿35人在完成百白破疫苗基础免疫3剂次后1~2个月时,采集末梢血,分别检测白喉和百日咳抗体水平。自1996年开始同时监测破伤风抗体。2003年开始每年监测2个区,在城郊(城区和近郊区)和远郊区各选择1个区。2007年及以后改为每两年监测一次。2003年及以前血标本采集方式为末梢血,2014年后所有标本均采集静脉血。
1.3检测方法和判断标准
1.3.1白喉抗体: 2003年及以前,采用间接血凝法检测凝集抗体,判断标准为:≥0.01 IU/mL为阳性,即为保护水平。标准白喉抗毒素、致敏血球与对照血球,均由中国药品生物制品检定所提供。2004年及以后使用ELISA方法检测白喉IgG抗体,判断标准为:≥0.1 IU/mL为阳性,即为保护水平。2004年使用德国IBL公司生产的白喉ELISA试剂盒;2006-2014年,使用德国维润赛润研发有限公司的ELISA classic白喉IgG试剂盒。
1.3.2百日咳抗体: 2004年及以前,采用凝集试验(微量法)检测,血清抗体滴度≥1∶320则判为具有保护水平。百日咳菌液和标准血清由北京生物制品研究所和中国药品生物制品检定所提供。2012年及以后,使用ELISA检测百日咳毒素IgG抗体,2012年使用德国欧盟ELISA百日咳 PT(IgG)试剂盒,判断标准为:≥28 IU/mL为阳性,2014年使用德国维润赛润研发有限公司生产的赛润ELISA classic百日咳毒素IgG试剂盒,判断标准为:≥30 IU/mL为阳性。
1.3.3破伤风抗体: 2007年及以前,采用间接血凝法检测,判断标准为:≥0.01 IU/mL为阳性即达到保护水平。破伤风抗毒素标准品、致敏血球和对照血球分别由中国药品生物制品检定所和北京生物制品研究所提供。2009年及以后,使用ELISA方法检测破伤风IgG抗体,使用德国维润赛润研发有限公司生产的赛润ELISA classic破伤风IgG试剂盒,>0.1 IU/mL为阳性,即为保护水平。以上所有检测均由北京市疾病预防控制中心完成。
1.4统计学方法 百白破疫苗基础免疫后抗体水平监测资料,进行描述性分析。使用WPS Office 2016的WPS表格建立数据库,计算各监测年白喉抗体、百日咳抗体、破伤风抗体的阳性率和平均抗体浓度。
2 结果
2.1白喉抗体水平 白喉基础免疫后抗体水平监测始于自1987年,已进行23次(表1),阳性率均在97%~100%。抗体浓度各次监测波动较大,1987-2001年抗体浓度在0.38~1.07 IU/mL,2002年以后都在1 IU/mL以上,各年抗体监测结果都高于保护水平0.1 IU/mL。
2.2百日咳抗体水平 百日咳基础免疫后抗体水平监测起自1987年,共进行19次(表1)。阳性率波动较大,1990年以前较低,为42.86%~77.13%,1991-2004年阳性率维持较稳定,除1997年为76.83%以外,其余年均在84.03%以上,2012-2016年阳性率波动更大,为8.14%~81.03%。2004年以前抗体水平以几何平均滴度显示,波动在1∶144~1∶3 387;2012年以后为抗体浓度,波动在33.18~72.60 IU/mL。
2.3破伤风抗体水平 破伤风基础免疫后抗体水平监测始自1996年,已进行14次(表1),阳性率都在98%以上。虽然抗体浓度各次监测波动较大,在0.49~9.98 IU/mL,各年抗体监测结果都高于保护水平0.1 IU/mL。
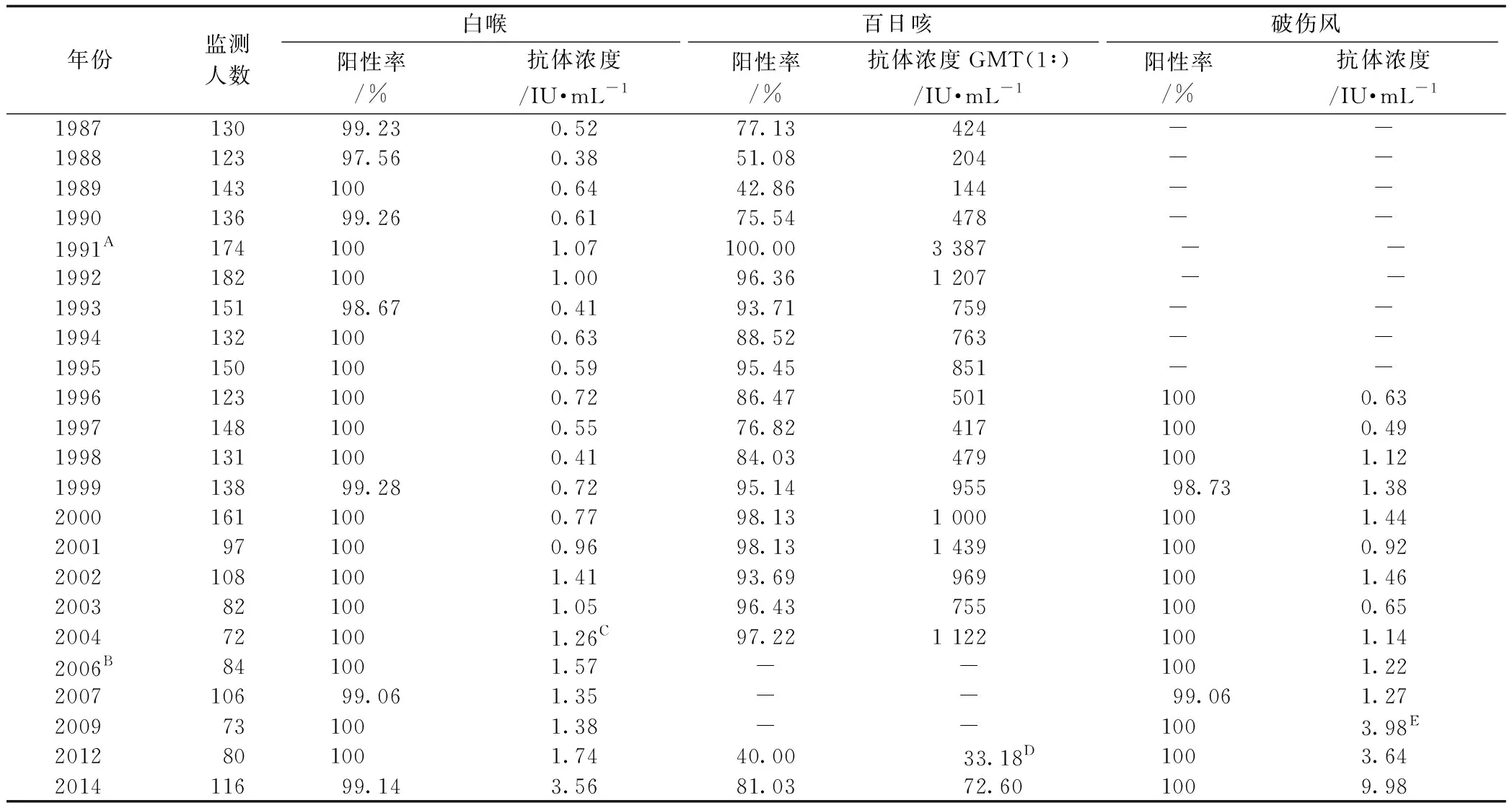
表1 1987-2014年北京市百白破疫苗基础免疫后抗体水平监测结果
注:A为1991年以前使用百日咳、白喉、破伤风混合制剂,1991年及以后使用吸附百白破联合疫苗;B为2006年及以后使用吸附无细胞百白破疫苗;C为2003年及以前采用间接血凝法检测凝集抗体,2004年及以后使用ELISA方法检测白喉IgG抗体;D为2004年及以前采用凝集试验(微量法)检测凝集抗体,2012年及以后使用ELISA检测百日咳毒素IgG抗体;E为2007年及以前采用间接血凝法检测凝集抗体,2009年及以后使用ELISA方法检测破伤风IgG抗体。
2.4抗体波动影响因素 1991年以前使用百日咳、白喉、破伤风混合制剂,1991及以后使用吸附百白破联合疫苗,疫苗转换后白喉、百日咳的抗体浓度和百日咳的阳性率均较前有所升高。使用ELISA检测方法后白喉、破伤风的抗体浓度较凝集法有升高。凝集法和ELISA方法检测的百日咳抗体不同,不能直接比较(表2)。
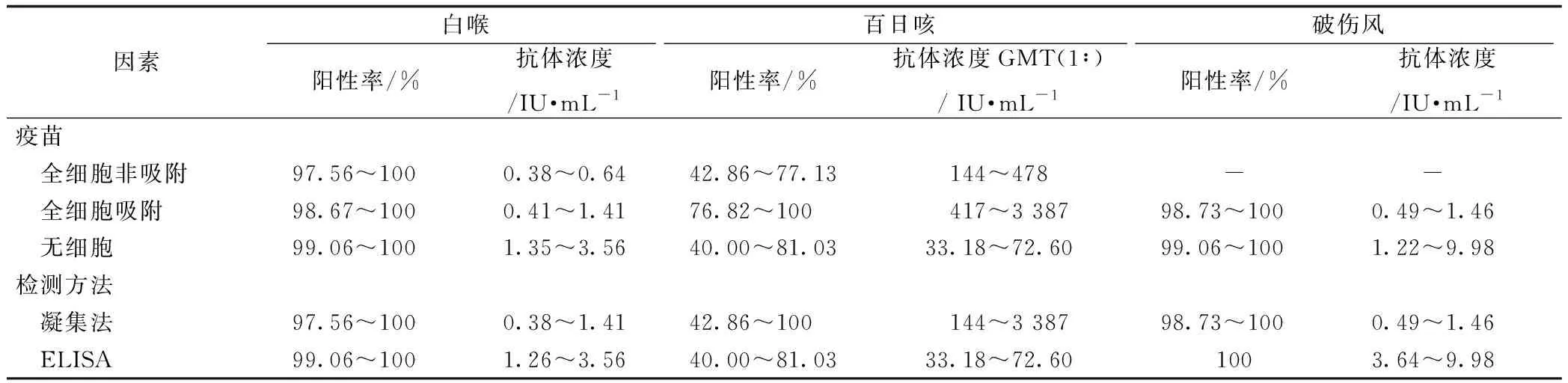
表2 白喉抗体、百日咳、破伤风抗体波动的影响因素
3 讨论
3.1从历次白喉监测结果看,抗体阳性率变化不大,但抗体水平波动较大,分析影响因素有以下几方面。首先,疫苗变化影响抗体水平,如北京市1991年使用吸附百白破疫苗,使用吸附剂可以增强抗原的免疫原性,因此1991年以后白喉抗体水平较20世纪80年代有所提高[2]。其次,检测方法变化可导致抗体水平波动。2003年以前的白喉抗体检测方法采用间接血凝法,间接血凝法使用的致敏血球批次间差异较大,检测结果由人工主观判定,导致这种检测方法的重复性和稳定性较差,另外由于血凝法的单位与国际单位不同,其仅能反映抗体高低的变化趋势[3],2004年以后,北京市逐渐采用ELISA方法检测白喉抗体。检测方法改变导致检测结果的最大值也发生了变化,白喉抗体的最大值从>1.0 IU/mL变为>2.0 IU/mL,抗体平均水平也明显升高。2014年检测最大值白喉抗体为>20.0 IU/mL,其抗体平均值明显高于既往历年监测结果。由此可见,在比较历年监测结果时,除了要考虑接种对象、疫苗变化外,还要考虑检测方法、试剂、阳性标准的变化、检测结果最大值和最小值的处理,这都会直接影响监测结果的分析和利用。
3.2破伤风抗体水平的变化与白喉相似,2007年及以前破伤风抗体的检测方法都采用间接血凝法,也可造成不同监测年度之间结果波动较大[4]。2009年后,采用ELISA方法检测破伤风抗体,检测结果的最大值从>1.0 IU/mL变为>5.0 IU/mL,抗体平均水平也明显升高。2014年检测最大值为40.239 IU/ml,当年的抗体平均值明显高于既往历年监测结果。
3.32006年以前,北京市使用全细胞百白破疫苗,采用微量凝集试验检测百日咳抗凝集原抗体(抗-AGGs)水平[5]。2006年以后,使用无细胞百白破疫苗替代全细胞百白破疫苗,我国自主研发的无细胞百日咳疫苗采用的是共同提取有效组分的共纯化工艺,以百日咳毒素(PT)和丝状血凝素(FHA)为主要有效成分[6]。由于凝集原不是主要成分,微量凝集试验不适用于评价接种无细胞百日咳疫苗产生的抗体水平,检测方法改为ELISA方法检测百日咳毒素的IgG抗体。2012-2014年进行了2次监测,百日咳抗体阳性率和抗体水平波动较大。考虑原因可能由于检测试剂不同、阳性标准不同、疫苗批次间PT含量不一致等有关。2012年使用的德国欧盟ELISA百日咳 PT(IgG)试剂盒,≥28 IU/mL为阳性,而2014年使用德国维润赛润研发有限公司生产的赛润ELISA classic百日咳毒素IgG试剂盒,≥30 IU/ml为阳性,这会造成前后两年结果的差异。我国共纯化工艺生产的无细胞百日咳疫苗不易进行质量控制[6],中国药品生物制品检定所曾对国内几家生产厂家送检的无细胞百日咳疫苗原液进行PT和FHA含量测定,结果显示同一厂家送检的每批原液之间PT和FHA含量不一致[7,8],疫苗抗原含量的差异也可以造成抗体水平的差异。
综上,在评价、利用历史监测数据时,要考虑检测方法、试剂、检测的目标抗体、阳性标准、极值的处理等方面的变化对标本检测结果的干扰后,再评价疫苗、接种质量和免疫效果,而不能简单的仅由抗体水平升高值得出疫苗免疫效果提高的结论,从而提升对历史监测资料的科学利用与评价水平。

