上皮性卵巢恶性肿瘤的预后分析
肖 雪,宋林红,董丹丹,王 巧,陆 欢,谢 兰
(1.四川省医学科学院·四川省人民医院,四川 成都 610072; 2.成都医学院,四川 成都 610500)
上皮性卵巢恶性肿瘤是致死率最高的妇科肿瘤之一,全球每年新发病例近24万,死亡病例超过15万[1]。基于组织病理学和基因变异特征,可分为以下几种主要亚型:高级别浆液型(High grade serous,HGS)、低级别浆液型(Low grade serous,LGS)、子宫内膜样型(Endometrioid,ED)、透明细胞型(Clear Cell,CC),黏液型(Mucinous,MUS)和浆黏液型(Seromucinous,SMC)[2,3]。了解各亚型卵巢癌的临床病理特征对疾病的治疗具有重要的意义。本研究分析在我院进行过手术治疗的卵巢癌病例比较各组织亚型卵巢癌的临床病理特征和预后情况,并探讨影响预后的相关因素。
1 资料和方法
1.1一般资料收集2008年1月至2015年12月在我院接受手术治疗的上皮性卵巢恶性肿瘤病例及其对应的临床相关资料328例,包括病理类型、术前CA125水平、化疗情况、FIGO分期等。
1.2方法提取我院妇科卵巢癌手术病例及对应的病理科存档蜡块,进行重新切片和HE染色。所有切片由高级病理医师复阅片,并依据2014版WHO卵巢上皮性肿瘤分类标准分为HGS、LGS、ED、CC、MUS、SMC以及其他亚型卵巢癌。所有患者随访至2017年7月,中位数随访时间为32个月(1~110月)。
1.3统计学方法应用Graphpad Prism 7.0统计学软件进行统计学分析。组间年龄比较采用Kruskal-Wallis检验,结果以中位数(四分位数)表示。组间FIGO分期、术前CA125值以及化疗情况的比较采用Chi-square检验。生存分析采用Kaplan-Meier法,并用Log-rank检验比较不同因素对生存期的影响。P<0.05为差异有统计学意义。
2 结果
2.1各组织亚型卵巢癌的临床病理特征本组病例共328例,年龄22~80岁,中位年龄54岁。63.4%的患者的年龄在40~59岁。各组织亚型间年龄比较,差异无统计学意义(P>0.05)。78.9%的HGS型卵巢癌FIGO分期为III~IV期,而SMC、ED、CC以及MUS型卵巢癌III~ IV期比例均不超过50%,不同组织亚型卵巢癌分期比较,差异有统计学意义(P<0.0001)。305例(93%)患者进行了术前CA125检测,超过700U/ml(正常指标20倍)的患者占41.2%。HGS型卵巢癌术前CA125高于其他亚型的卵巢癌,差异有统计学意义(P<0.0001)。82.9%的患者术后接受了铂类药物化疗,各组织亚型患者接受化疗的比例比较,差异无统计学意义(P=0.074)。
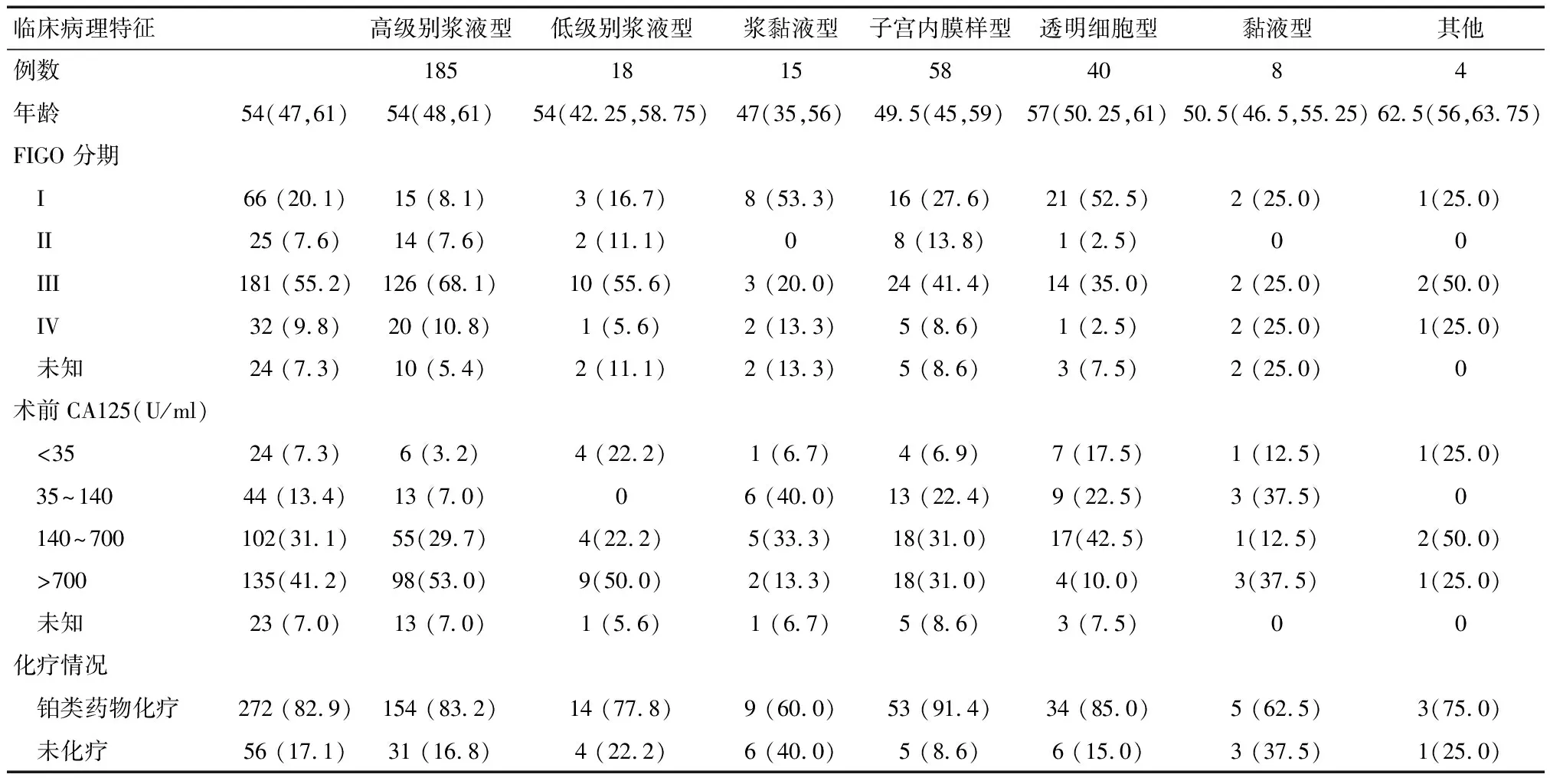
表1 不同组织亚型卵巢癌的临床病理特征 [n(%)]
2.2上皮性卵巢恶性肿瘤的生存分析截止随访日期,328例患者有172例(52.4%)复发,复发的中位数时间为22个月,5年无进展生存率30.5%(图1a)。死亡病例共152例(46.3%),中位数存活时间为53个月,5年存活率为45.8%(图1b)。
2.2.1不同组织分型上皮性卵巢恶性肿瘤的生存分析 不同组织亚型的卵巢癌在无进展生存期(Progression free survival,PFS)和总生存期(Overall survival,OS)比较,差异均有统计学意义(PFS:P=0.0004; OS:P=0.0026)。患者的中位数生存期(Median survival,MS)显示预后最差的是HGS型卵巢癌;CC型卵巢癌的预后也不佳,其复发中位数时间和中位数存活时间均短于LGS、SMC和ED型卵巢癌。见图2a、2b。
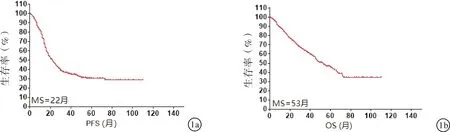
图1 上皮性卵巢恶性肿瘤的生存分析 a:无进展生存期分析;b:总生存期分析
2.2.2不同FIGO分期上皮性卵巢恶性肿瘤的生存分析 不同FIGO分期的卵巢癌预后比较,差异亦有统计学意义(P<0.0001)。近70%的I期卵巢癌患者5年内没有复发(图3a),这些患者的5年存活率接近80%(图3b)。II 期、III期和IV期卵巢癌的中位数复发时间分别为26个月、18个月和14个月(图3a)。超过50%的II 期患者存活时间超过5年;而III期和 IV期患者的5年存活率分别为37%和12%(图3b)。

图2 不同组织亚型卵巢癌的生存分析 a:无进展生存期分析;b:总生存期分析
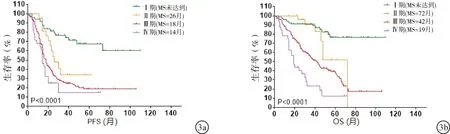
图3 不同FIGO分期卵巢癌的生存分析 a:无进展生存期分析;b:总生存期分析
2.2.3不同CA125水平上皮性卵巢恶性肿瘤的生存分析 术前CA125值正常及<140 U/ml以下者预后显著优于140 U/ml以上者(P<0.0001)。但术前CA125值140~700 U/ml者与>700 U/ml者预后比较,差异无统计学意义(P> 0.05)。见图4a、4b。
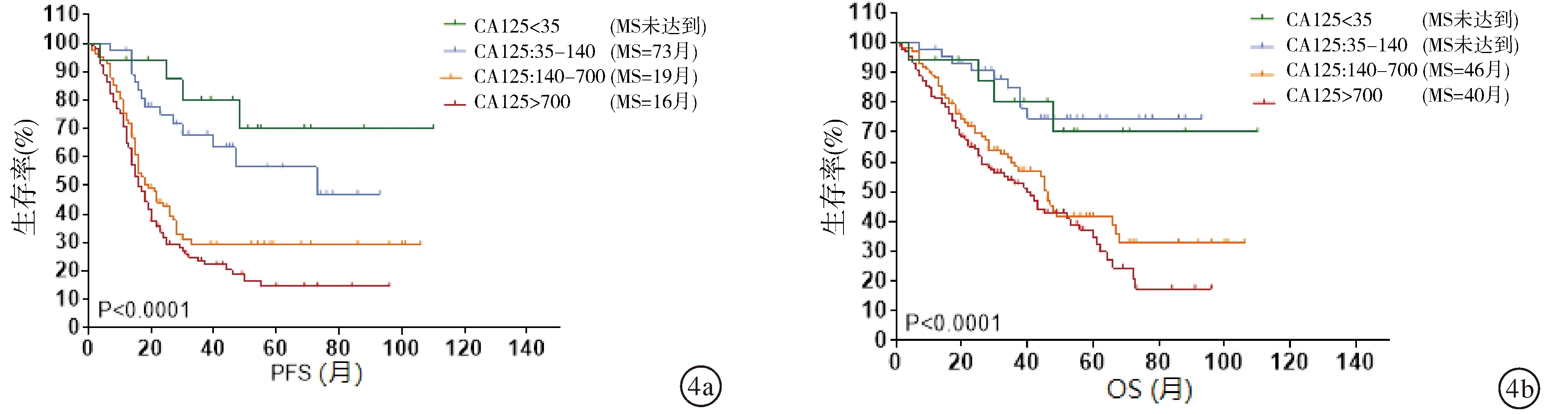
图4 基于术前CA125值的生存期分析 a:无进展生存期分析;b:总生存期分析
3 讨论
卵巢癌异质性强,死亡率高。本研究通过分析在我院接受手术治疗的病例发现不同类型的卵巢癌在FIGO分期和术前CA125水平上具有显著差异。绝大多数浆液型卵巢癌被诊断时已达晚期;SMC型、ED型以及CC型卵巢癌则更容易在早期被发现,该结果与既往报道相符[2]。另外,相比HGS型卵巢癌,其他亚型卵巢癌的术前CA125水平更低。在预后方面,HGS型卵巢癌的PFS和OS都低于其他亚型的卵巢癌。这和HGS型卵巢癌分期晚,术前CA125水平更高有关。此前也有研究报道术前CA125水平较低的卵巢癌患者预后更好[4]。综合看来,不同亚型的卵巢癌具有不同的临床病理特征和临床结局,这与国外的报道一致[2,5]。
不同类型卵巢癌预后不同的重要原因是其在流行病学、驱动突变、组织来源等方面具有不同的特点。因此,“卵巢癌”只是一个通用术语,事实上这是一系列在分子水平和病因上都完全不同的多种疾病在共享一个解剖学位置[6]。很多卵巢癌甚至并不来源于卵巢本身固有组织:CC型和ED型卵巢癌与子宫内膜异位有很强的相关性[7,8]。HGS型卵巢癌起源于输卵管也得到了越来越多的共识[6,9,10]。此外,基于信号通路的激活和基因表达特征,有些亚型的卵巢癌和某些其他器官的肿瘤具有相似之处。比如,HGS型卵巢癌和基底样型乳腺癌具有一些共同的基因组和转录特征[11];CC型卵巢癌与肾透明细胞癌和子宫内膜透明细胞癌具有相似的基因表达特征[12]。另外,在此值得提出的是近期的研究表明SMC型卵巢癌不应该被视作一种独立的亚型。因为结合形态学、免疫表型以及基因型,70%以上的该类肿瘤都可以被重新归类为ED型卵巢癌[13]。
由此可见,每种亚型的卵巢癌都是一种独特的疾病。近年来的研究发现多达50%的HGS型卵巢癌可能具有DNA同源重组修复(homologous recombination repair,HRR)缺陷,引起原因除了BRCA 1/2缺陷以外还包括表观遗传基因沉默以及能影响到HRR功能的其他基因的缺陷[14]。目前已有三种PARP抑制剂(Olaparib、Rucaparib和Niraparib)在国外被批准用于治疗该类基因缺陷的HGS型卵巢癌。此外,抗PD-1的免疫检查点抑制剂Pembrolizumab已经获美国FDA批准治疗具有错配修复(Mismatch repair,MMR)缺陷的实体肿瘤。具有MMR缺陷的卵巢癌多为非浆液性卵巢癌[15,16],但这类患者是否能受益于免疫治疗还需临床试验来验证。总而言之,不同类型的卵巢癌具有不同的生物学特征和对治疗的敏感性。基于分子特征对卵巢癌作进一步分类,并选择个体化的治疗方案将对改善患者生存质量,提高生存期起到非常重要的作用。

