制药企业计算机化系统数据可靠性管理分析
王 丹,周 玲,陈 颖
(云南省食品药品监督管理局食品药品审核查验中心,云南 昆明 650100)
数据可靠性是指在数据生命周期内,数据完整、一致、准确的程度[1],即所采集的数据应该是可归属的、清晰的、同步记录的、原始和准确的。数据可靠性是《药品生产质量管理规范》(GMP)一贯要求,但在以往国内药品GMP认证或飞行检查中,主要关注的是纸质记录的真实性和可追溯性。2015年GMP《计算机化系统》附录的颁布实施中,规定了电子数据运行与管理作,明确要求电子数据的真实性和可追溯性,并具有了强制执行的法规效力。目前多数制药企业计算机化系统数据可靠性管理工作还处于起步阶段,近年来国际及国内GMP检查中,计算机化系统数据可靠性管理方面的缺陷呈上升趋势。
1 调查方法
为进一步了解制药企业计算机化系统数据可靠性管理现状及存在的问题,探索解决控制策略,笔者结合风险评估情况,选取云南省12家制药企业开展了现场调研,约占总制药企业数量的6%。其中,昆明地区8家,州市地区4家,均为高风险产品(注射剂、疫苗)生产企业,总体质量管理要求较普通制剂或中药饮片生产企业更严格,故调研发现的问题更具有代表性。调研采取座谈、查阅文件、实地调查等方式。
2 结果与分析
2.1 调研结果
本次调研针对企业计算机化系统管理文件、数据可靠性管理制度、计算机设备管理操作及数据审核备份等开展调查及汇总,结果见表1。
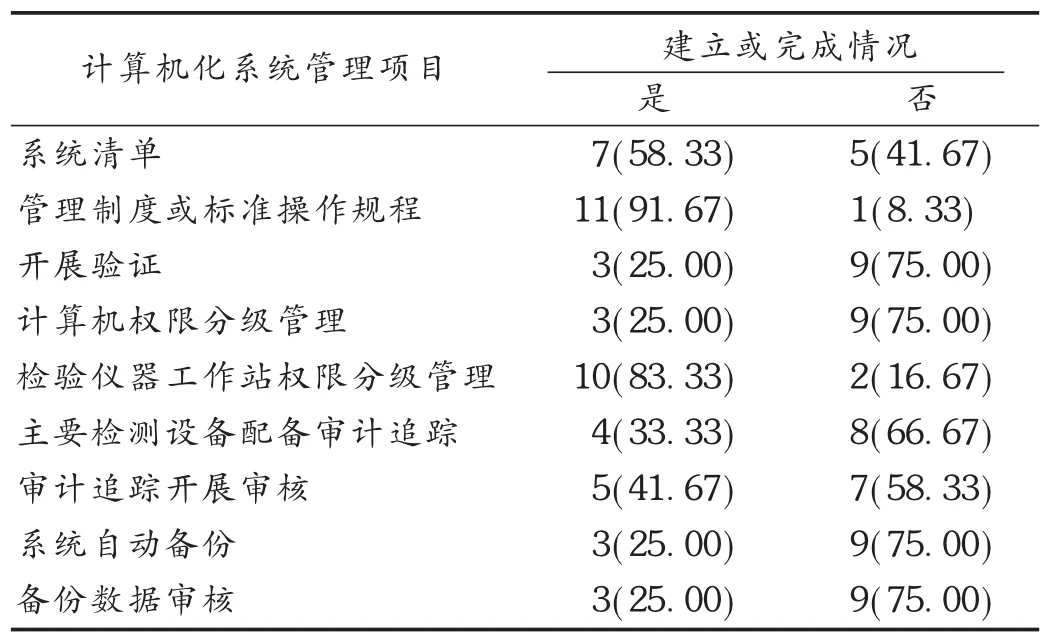
表1 云南省高风险药品生产企业计算机化系统及数据管理情况统计[份(%),n=12]
2.2 问题与分析
企业对计算机化系统管理有基本认识,但推进深度不足:GMP《计算机化系统》附录于2015年12月颁布实施,调研发现,92.00%的企业均已建立计算机化系统管理制度或操作规程,企业对新颁布的法规进行了及时学习,但推进深度不足,41.67%的企业未建立计算机化系统清单,无法有效地开展分级管理;75.00%的企业未开展计算机化系统验证。
多数企业未考虑计算机系统的权限管理,不符合数据可靠性的管理要求:数据归属至人是数据可靠性管理的基本要求,其实现的基础是清晰的用户划分及权限管理。83.33%的企业建立了检验仪器工作站的权限分级管理,有利于对检验数据操作人进行追溯。但对于计算机设备本身(特别是检验仪器工作软件不具备审计追踪或权限分级的计算机设备),仅有25.00%的企业开展了计算机系统权限分级管理;另75.00%的企业存在的主要问题是,共用用户登录计算机系统、对修改系统时间或删除文件等权限未进行限制管理等。这些问题也是国家食品药品监督管理总局开展飞行检查过程中,计算机系统数据可靠性方面的常见问题[2]。
企业对审计追踪的管理不充分,存在理解误区:就计算机化系统而言,审计追踪指安全的、计算机生成的、具有时间标记的电子记录,通过审计追踪可重建有关创建、修改或删除电子记录的时间过程。审计追踪即为记录“何人,何时,做什么,为什么”的时序表[3]。现场调研发现,仅41.67%的企业对审计追踪的内容开展审核。大部分企业更依赖硬件,认为配备审计追踪就符合数据可靠性的要求,未将审计追踪的内容纳入审核与管理。
3 对策与建议
3.1 深入学习法规,结合自身流程全面开展风险评估
多数企业参与的计算机化系统数据可靠性培训不充分,在法规理解和落实方面存在疑问。建议企业着眼于现有法规,在深入学习《GMP》《计算机化系统》附录和《药品数据管理规范(征求意见稿)》要求的基础上,同时参考英国药监机构(MHRA)、世界卫生组织(WHO)、美国食品药物管理局(FDA)等机构关于数据可靠性的指南加深理解。首先,做到心中的概念明晰,然后对照企业自身的生产质量管理流程开展风险评估,确定每个工作环节中数据可靠性的风险等级。企业容易忽视这项工作,因为这需要调动很多熟悉业务流程与法规的人员参与,耗时较长,也不会及时取得成果。但只有真正做好风险评估,企业才能根据书面风险评估的结果确定验证和数据可靠性控制的程度,也才有开展后续工作的基础。
3.2 制订清单,结合风险等级完善管理制度和操作程序
企业应建立包含药品生产质量管理过程涉及的所有计算机化系统的清单[4],清单应根据风险评估的结果,对所涉及的计算机化系统进行分级。如何对系统分级,国内目前没有非常明确的法规要求。部分企业参考GAMP 5的方法进行了系统分级,根据计算机系统定制化程度及故障、缺陷的风险等级,对计算机软件分级[5]。
为了贯彻药品数据归属至人的要求,企业应在计算机化系统清单的基础上,梳理出不同计算机化系统需要的权限分级,授予每一级人员合理的权限,保证人员不越权操作,所有操作追溯性强,设定监督机制确保数据不被随意更改或删除。
根据风险评估和企业的管理需求,尽量对风险高的计算机化系统配备审计追踪功能,并完善审计追踪的审查与管理,使审计追踪功能真正实现数据的溯源与过程控制的效用。针对暂无法满足审计追踪功能的,可采用替代方法加强数据可追溯性的管理,如对计算机系统登录权限进行管控,将电脑日志纳入记录管理,原始电子记录与设备纸质台账相结合等。
3.3 破除理解误区,综合提升数据可靠性
调研发现,很多企业对于数据可靠性的实施都存在仅依赖硬件的想法:一方面,认为计算机化系统数据可靠性管理就是指设备具有审计追踪功能;另一方面,又担心因为不能对所有设备实施审计追踪全覆盖而导致数据可靠性不合规,甚至对个别简单设备(如pH计)没有审计追踪功能感到焦虑。事实上,审计追踪只是一个工具,并不是实现数据可靠性的万能钥匙。即使设备配备了审计追踪,实现数据可靠性控制的基础仍是企业自身的管理。同时,审计追踪的内容也应进行审核,审核频率和内容应当基于风险级别确定,如对于涉及最终产品放行等较高风险环节的,应将审计追踪的内容纳入批记录中审核,而对于某些对产品质量无影响或影响较小的环节,审计追踪则可制订较低的审核频率。
综上所述,计算机化系统数据可靠性管理是系统性问题,除了硬件配置,还需综合考虑质量体系、质量文化、人员培训、GMP规范的持续符合性等多方面。企业要想真正持续符合数据可靠性的管理要求,企业管理者应负责建立良好诚信的质量文化,注重人员培训,建立有效的员工质量教育体系,不断提高员工素质[6]。鼓励员工遵守数据可靠性要求,主动负责地报告数据可靠性问题,尽量避免简单粗暴地以处罚为措施,以避免员工在出现异常情况时不敢报告、甚至违规操作,因掩盖问题避免处罚的情况发生。只有企业上下持续打造诚信的质量文化,坚守诚信这一GMP实施的基石,才能确保数据可靠性真正落实。

