高粱幼嫩叶段愈伤诱导与植株再生
郝艳芳,王良群,刘 勇,张 微,杨 伟,白鸿雁,武 擘
(1高粱遗传与种质创新山西省重点实验室,山西晋中030600;2山西省农业科学院高粱研究所,山西晋中030600)
0 引言
有效的高粱组培和再生体系是利用转基因技术定向改良高粱的基础。从1970年Maseltler等[1]首次以芽原基为外植体培养获得再生植株开始,到现在已可以从多种外植体的培养获得再生植株,如未成熟胚[2-3]、成熟胚[4]、茎尖[5-6]、幼穗[7-8]、花药[9-10]等,其中,未成熟胚和幼穗由于诱导愈伤组织容易,诱导率高和分化率高而被广泛采用,但其取材受生长季节限制,未成熟胚只能在授粉后12~13天,长约1.0 mm的特定时间段内取材[11],幼穗也只能在小穗长度大约为1~3 cm的特定时间段内取材[12],其他外植体存在再生率不高、取材量少、操作复杂、实用性差等缺点,相比之下,来源于幼苗基部的幼嫩叶段能提供较多的材料,而且操作简单易行。Wernicke等[13-14]以8个品种培养10天的无菌苗叶段为外植体,在MS培养基中诱导愈伤组织,经分化得到了7个品种的再生植株。韩福光等[15]以5~8片叶的高粱幼苗叶段为外植体在含盐培养基中培养,得到了再生植株,并观察了后代植株在田间的表现,获得了耐盐系。虽然以高粱叶段为外植体的愈伤诱导与分化培养取得了一定进展,但影响愈伤诱导和分化的因素较多,使得叶段愈伤诱导和分化率低,而且很多基因型材料的叶段培养还未见报道。本研究选取育种上常用的8个恢复系为材料,以它们的幼嫩叶段为外植体诱导愈伤组织,研究愈伤组织诱导和植株分化再生过程,从中筛选出诱导率较高、愈伤形态优良、分化率较高的基因型材料,为建立以叶段为外植体的高粱组培体系提供参考。
1 材料与方法
1.1 试验材料
供试品种为‘三尺三’、‘R111’、‘SR30’、‘8643变’、‘RHMC’、‘1383’、‘10941496’、‘晋梁5号’8个高粱恢复系材料,2015年种植于山西省农业科学院高粱研究所修文试验基地收获后保存。试验于2016年4月—2017年8月在高粱遗传与种质创新山西省重点实验室进行。
1.2 试验方法
选取饱满的高粱种子,先用70%乙醇浸泡灭菌1 min,无菌水冲洗3次,再用0.1%的HgCl2水溶液浸泡灭菌15 min(加入2滴吐温-20),无菌水冲洗6~8次。灭菌后的高粱种子接种于发芽培养基S1(表1)中,于(25±1)℃培养室中培养,每天灯光辅助光照12 h。
待苗长长至3~5 cm(约5天)时,把至叶基向上大约0.5 cm长的叶取下(图1A),用解剖刀切成1~2 mm长的小段(图1B)接种于诱导培养基S2~S8(表1)中,于(25±1)℃培养室中培养,每天光照12 h,3周后观察愈伤组织生长状况,统计愈伤组织诱导率。将诱导出的初级愈伤组织接种于继代培养基S9(表1)中继代培养,每3周继代1次,继代2次后,观察愈伤组织形态,统计胚性愈伤诱导率。然后转入分化培养基S10(表1)中培养,25℃,灯光辅助光照,每天16 h,3周后统计分化率(图1D)。待苗长长至5 cm以上,接种于生根培养基S11(表1)中,当再生苗长出根后(图1E),移栽于花盆中(图1F)。
1.3 试验参数处理
试验数据为3次重复的平均值±标准差,采用Microsoft Excel 2003进行数据计算,采用Duncan’s多重比较法进行差异显著性测验。

2 结果与分析
2.1 2,4-D浓度对初级愈伤组织诱导的影响
设置诱导培养基的2,4-浓度分别为0、0.5、1.0、2.0、3.0、4.0、6.0mg/L,将R111的幼嫩叶段接于其上培养。观察发现,接种3~4天后,有的叶段伸长至1 cm,有的不伸长,6~7天后伸长的叶段一端或两端膨大,长出愈伤,不伸长的叶段褐化变黑,不能长出愈伤,渐渐死亡。3周后形成直径为0.5 cm左右的愈伤组织块,统计愈伤组织诱导率。由表2可知,2,4-D对高粱幼嫩叶段愈伤组织诱导有很大的影响,不添加2,4-D的培养基上叶段全部褐化变黑,最终也不能产生愈伤组织。随着2,4-D浓度的升高,愈伤组织的诱导率先升高后下降,当2,4-D的浓度为2mg/L时,诱导率达最高为80.86%,并且继代后褐化率较低,因此,高粱幼嫩叶段诱导愈伤合适的2,4-D浓度为2mg/L。
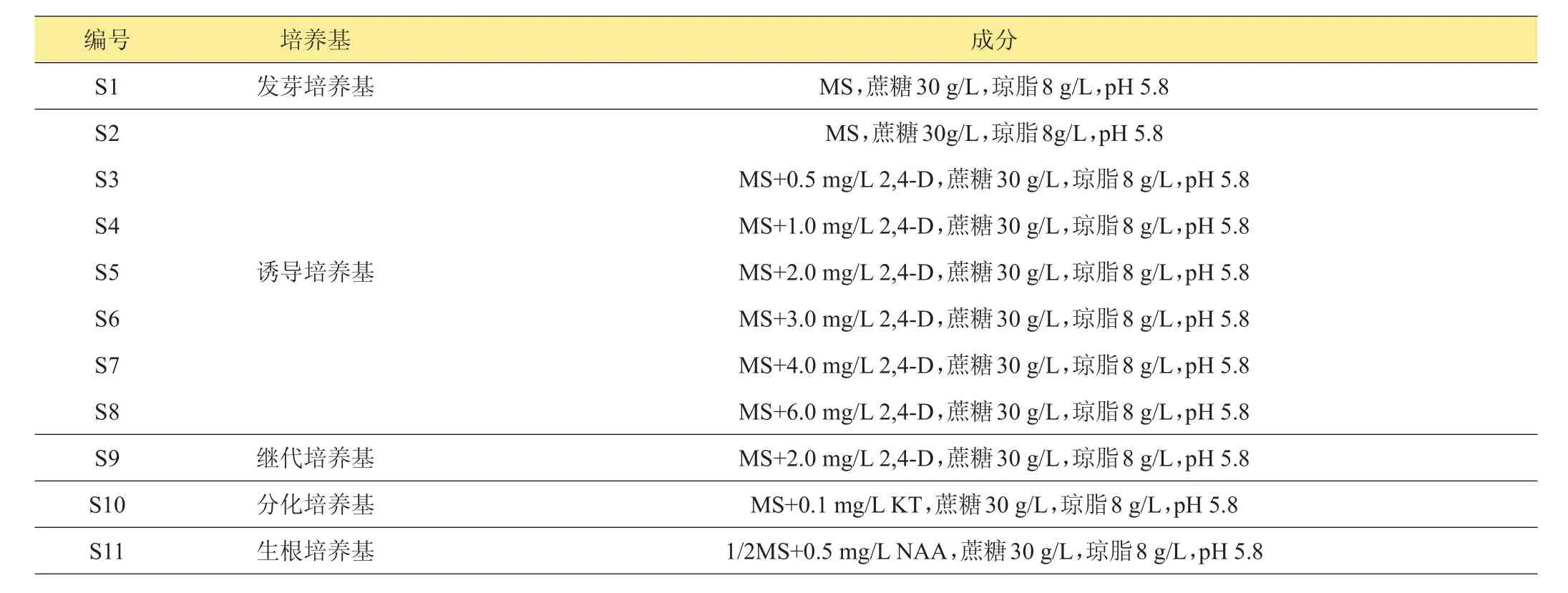
表1 试验所用培养基

图1 高粱幼嫩叶段的再生过程
2.2 基因型对愈伤组织形态的影响
将不同基因型材料诱导产生的初级愈伤组织转接入继代培养基中继续培养,可以发现不同基因型的继代情况不同,有的基因型在继代过程中褐化较少,愈伤胚性较好,而有的基因型褐化较严重,胚性状况比较差。经过2次继代后,可发现形成3种不同类型的愈伤组织。其中‘1383’、‘RHMC’、‘晋梁5号’、‘10941496’的幼嫩叶段形成的愈伤组织多数为白色或浅褐色半透明,含水量高,分泌粘液的Ⅰ型愈伤组织(图2A~D);‘三尺三’、‘R111’、‘8643变’形成的愈伤多数为淡黄色,表面颗粒状突起,结构疏松,生长旺盛的Ⅱ型愈伤组织(图2E~G);‘SR30’形成的愈伤多数为黄绿色,硬质块状,结构致密,生长缓慢的Ⅲ型愈伤组织(图2H)。
2.3 基因型对诱导率和分化率的影响
由表3可知,在适宜的培养基上,8种高粱基因型的幼嫩叶段都能被诱导产生愈伤组织,但诱导率有很大差异,变幅为5.45%~84.65%。其中‘三尺三’、‘R111’、‘8643变’3个基因型材料显著高于其他5个基因型材料。诱导率和分化率最高的基因型为‘三尺三’,分别为84.65%和22.59%,其次为‘R111’,第三为‘8643变’。初级愈伤诱导率较低的‘晋梁5 号’、‘RHMC’、‘1383’3个基因型材料,分化率也低,分别为6.24%、7.34%、10.52%。‘10941496’和‘SR30’2个基因型材料最后没有得到分化苗,是由于‘10941496’所诱导出的初级愈伤组织在继代的过程中全部褐化死亡,而‘SR30’的初级愈伤诱导率很低,诱导出的愈伤为硬质块状,最后未能分化出苗。
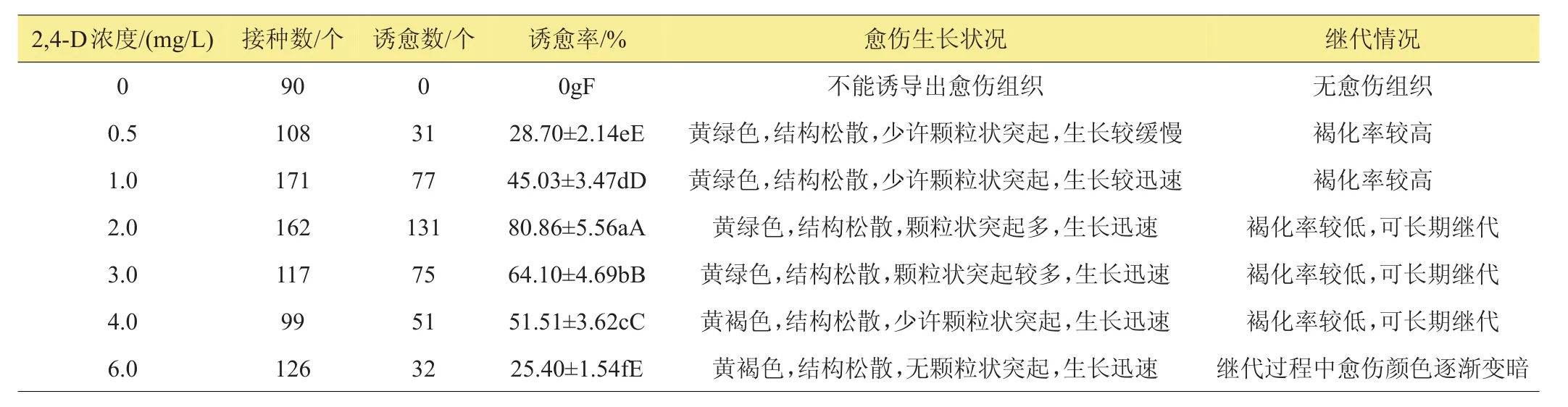
表2 不同2,4-D浓度对高粱幼嫩叶段初级愈伤组织诱导的影响
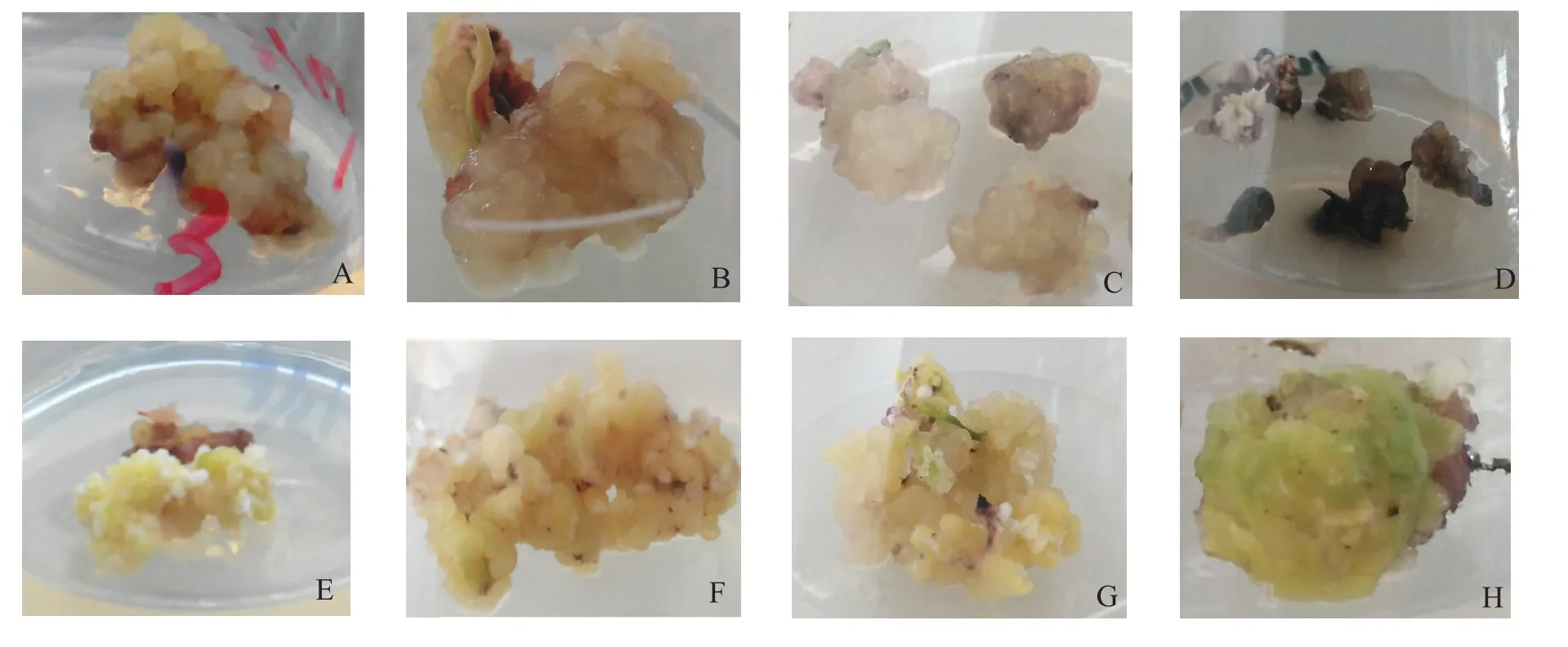
图2 不同基因型高粱幼嫩叶段各自形成的愈伤组织形态
3 结论
(1)2,4-D是影响高粱幼嫩叶段愈伤组织诱导的关键因素,在不添加2,4-D的培养基中不能产生愈伤,随着2,4-D浓度的升高,诱导率先升高后降低,适宜的2,4-D浓度为2 mg/L。
(2)高粱幼嫩叶段愈伤组织诱导与分化受基因型限制。基因型不仅影响愈伤组织的诱导和分化,还影响愈伤组织的形态和质量。
(3)筛选出了3个诱导率高、愈伤形态优良且分化率较高的基因型,分别为‘三尺三’、‘R111’、‘8643变’。
4 讨论
一般认为,禾谷类作物叶片细胞全能性很低,在离体培养条件下较难再生。然而有报道指出,幼苗叶基部细胞具有相对较强的脱分化形成愈伤组织的能力[16-17]。笔者选取8个高粱基因型材料,研究源于无菌苗叶基部的幼嫩叶段愈伤组织诱导和植株再生过程,从其中6个基因型中获得了再生植株。
2,4-D是影响愈伤组织诱导的关键因素。在愈伤组织诱导初期,一般需较高浓度的2,4-D(2~4 mg/L)[18]。黄璐等[19]研究认为,高浓度的2,4-D对外植体及愈伤组织有伤害作用,容易产生无性系变异。林国梁等[20]认为高浓度的2,4-D对愈伤组织的诱导和芽的分化有抑制作用。本研究中,未添加2,4-D的培养基不能诱导产生愈伤组织,诱导愈伤的适宜浓度为2 mg/L,超过适宜浓度时,随着2,4-D浓度的升高,诱导率下降,这与林国梁等的研究一致。
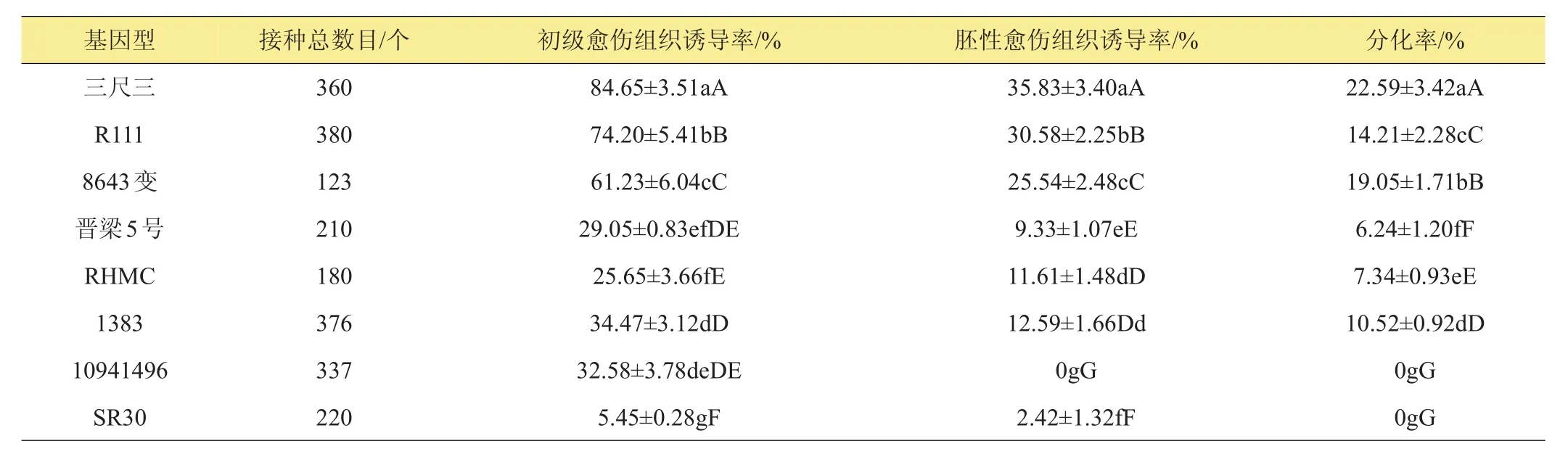
表3 不同基因型高粱幼嫩叶段愈伤组织诱导率和分化率的比较
不同基因型材料的幼嫩叶段在适宜的2,4-D浓度下都能被诱导产生愈伤组织,但是愈伤组织的诱导率有很大的差异,说明基因型是高粱幼嫩叶段组织培养中一个很重要的影响因素。韩福光等[15]研究发现高粱愈伤组织的诱导率,不同基因型间存在差异,这与本研究的结果一致。而王良群等[21]的研究认为基因型对诱导率的影响不大,这可能与试验所选择的基因型种类和数量有关。基因型不仅对幼嫩叶段愈伤诱导率有很大影响,还对愈伤组织的形态和质量有很大影响,笔者所选用的8个基因型材料,经2次继代后产生3种不同类型的愈伤组织,这与陈靖等[22]的研究一致。愈伤组织质量反映的是愈伤组织的胚性状况,是关系到愈伤能否分化的一个重要因素[23-24],本研究中,能产生优良质量愈伤组织的‘三尺三’、‘8643变’、‘R111’这3个基因型材料有较高的分化率,而不能产生优质愈伤的其他5个基因型材料分化率很低,‘10941496’、‘SR30’2个基因型甚至没有得到再生苗。
本研究中,以高粱无菌苗幼嫩叶段为外植体,从6个基因型材料中得到再生植株(图1D~F),说明幼嫩叶段可作为高粱组培研究和利用的一种可供选择的外植体。虽然高粱转化研究工作中,常常选择幼胚或幼穗作为受体材料[25-26],但是在非生长季节,幼嫩叶段不失为一种很好的选择。但不足的是,本研究中胚性愈伤组织的诱导率和分化率偏低,如何提高胚性愈伤诱导率和分化率是今后需要解决的问题。

