环状RNA在孕妇18-三体综合征的鉴定与分析
邹耀霜 晏强 眭维国 欧明林 陈洁晶 汤冬娥 赵鑫 廖秋燕 戴勇*
(1.广西师范大学生命科学学院,广西 桂林541004;2. 解放军第一八一医院 肾脏科、全军器官移植与透析治疗中心、广西代谢性疾病研究重点实验室,广西 桂林 541002;3. 暨南大学第二临床医学院深圳市人民医院 临床医学研究中心,广东 深圳 518020)
环状RNA(circular RNAs, circRNAs)是一类通过反向剪接(backsplice)方式形成的非编码RNA(non-coding RNA, ncRNA),大量存在于生物中[1,2]。1976年首次在类病毒中发现了环状RNA分子的形成[3]。20世纪90年代初期,发现circRNA是由许多基因的转录产生的,如肿瘤抑制基因DCC,原癌基因est-1和睾丸Sry[4,5]。然而,这些circRNA通常被认为是低丰度的,可能代表拼接错误。circRNA在不同物种中具有保守性,而且存在组织表达差异,可以作为竞争性内源RNA(ceRNA)结合miRNA,阻断miRNA对靶基因的抑制作用,具有开发疾病新型诊断与治疗方法的巨大潜力[6,7]。最近,由于高通量RNA测序和新的计算方法的发展,已经在各种细胞系和不同物种中成功鉴定了大量的circRNA。近来人们使用全基因组测序学方法来研究人类三体征(包括13-三体、18-三体和21-三体综合征),以鉴定这些特定非整倍性条件中的每一个的基因表达特征。染色体畸变与产前期和婴儿早期的显著发病率和死亡率有关[8]。18-三体综合征又称为爱德华综合征(Edwards syndrome),是常见的染色体三体征,是由于人类18号染色体增多1条造成的染色体畸变, 此类患儿临床特征差异大,可从重度先天畸形到近似正常,严重的临床特征为神经系统发育受阻、脸部异常、生长较慢、骨骼反常、心脏和肾脏畸形等[9]。由于18-三体综合征患儿在胎儿期即存在较高的自然流产率,故新生儿18-三体综合征的患病率为1/8000~1/6000[10],不能适应社会生活和缺乏正常劳动能力,对家庭及社会造成经济压力。因此,探索新的无创性产前筛查诊断指标和方法具有非常重要的临床意义和商业价值。
1 资料与方法
1.1 一般资料 2016年期间在181医院和深圳市人民医院产前筛查提示胎儿异常高风险,以及就诊于优生遗传门诊具有产前诊断指征为18-三体综合征的2位孕妇的外周血以及脐带血为实验组,对照组为正常的相同孕周的孕妇外周血和脐带血,年龄30~40岁,孕周28周和32周,混合血样提取RNA进行全基因组测序。
1.2 实验方法 孕妇了解穿刺存在的危险后并签署知情同意书,在B超引导下行脐带穿刺抽取胎儿脐血1~2ml,分析血红蛋白成份鉴定为脐血后,按常规方法培养制片,加1ml血液接种于培养基,37℃培养72小时,加秋水仙素,滴低渗液破碎细胞,加固定液固定离心,去上清加1ml成悬浮液,滴片,显微镜下观察进行核型分析。常规计数30个分裂相,手绘分析4个核型。如遇异常核型则分析计数50个核型以上。
1.3 测序方法 取诊断为怀有18-三体综合征胎儿的母亲的外周血用Trizol法提取RNA,每个样品总量为5个样品总量作为RNA样品制备的材料,使用NanoDrop 2000c分光光度计(Nanodrop Technologies,Wilmington,DE)测定分离的RNA样品的纯度和产量。使用HiSeq PE Cluster Kit v4 cBot(Illumina)根据制造商的说明在cBot簇生成系统上进行索引编码样品的聚类。簇生成后,在Illumina Hiseq 2500平台上对文库制备物进行测序。
2 结果
通过对比图1和图2,发现图1第18号多出1条染色体,经染色体核型分析图1诊断为18-三体综合征,图2核型分析母亲的外周血核型图。测序得到的原始数据经过删除、过滤低质量数据之后,获得了有效数据。对比图3和图4可以看出,两组主要的基因类型主要分布在编码蛋白质上,其他的无明显变化。值得注意的是,lincRNA对比正常组有上升0.2%,在唐氏综合征中鉴定出大量lncRNAs差异表达,与蛋白质编码基因相比,lncRNA表达显著增强(Kolmogorov-Smirnov检验,P<0.05),表明lncRNAs在唐氏综合征中发挥更重要的作用[11]。lincRNA的升高(如图4)是否与18-三体综合征的ceRNA的网络调控有关系?值得进一步探索。反义RNA可通过与靶位序列互补而与之结合的RNA,或者直接阻止靶序列功能,或改变靶部位构象而影响其功能[12]。misc-RNA具有多种功能,包括一些类似酶的催化,参与RNA的形成过程,这些小RNA中的一些也可能作为开关,开启和关闭基因,破坏mRNA来沉默基因[13]。
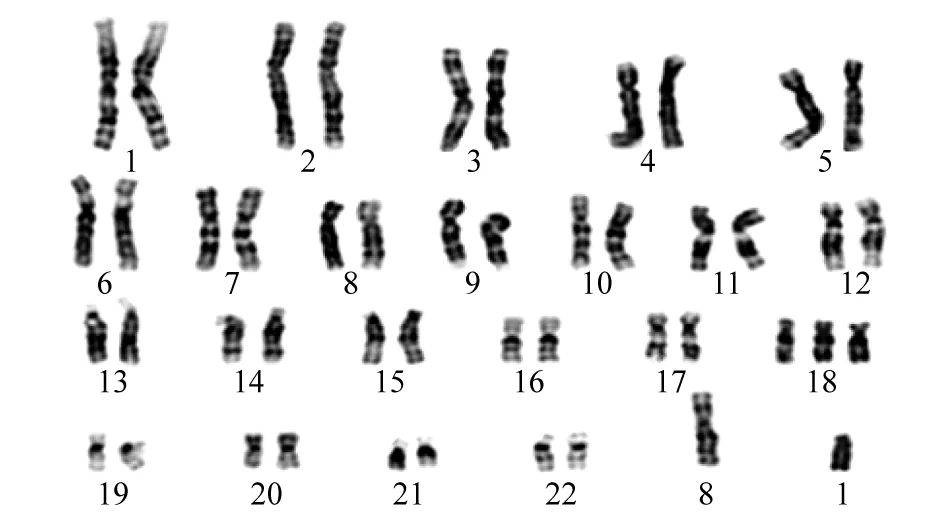
图1 18-三体综合征胎儿脐带血染色体核型分析
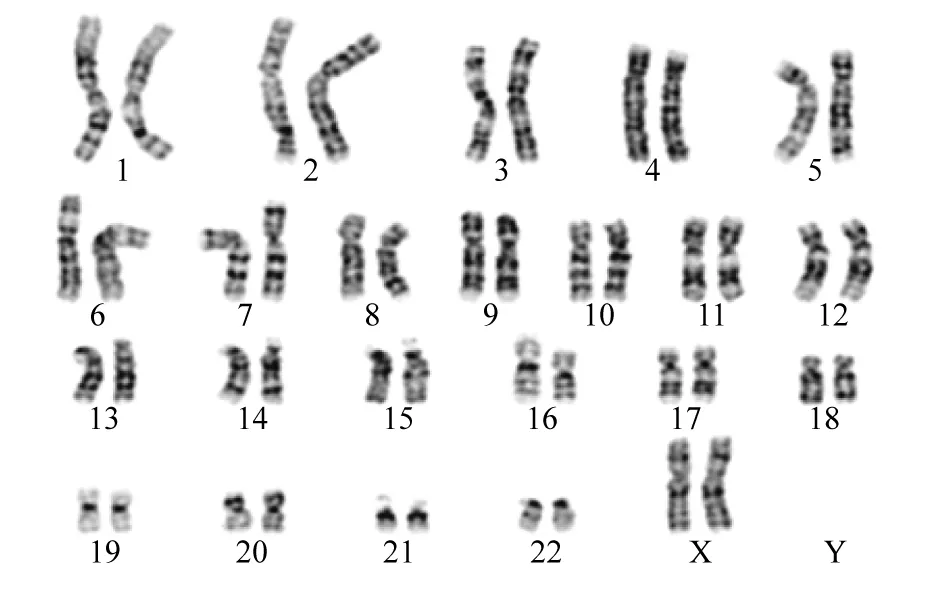
图2 18-三体综合征孕妇外周血染色体核型分析
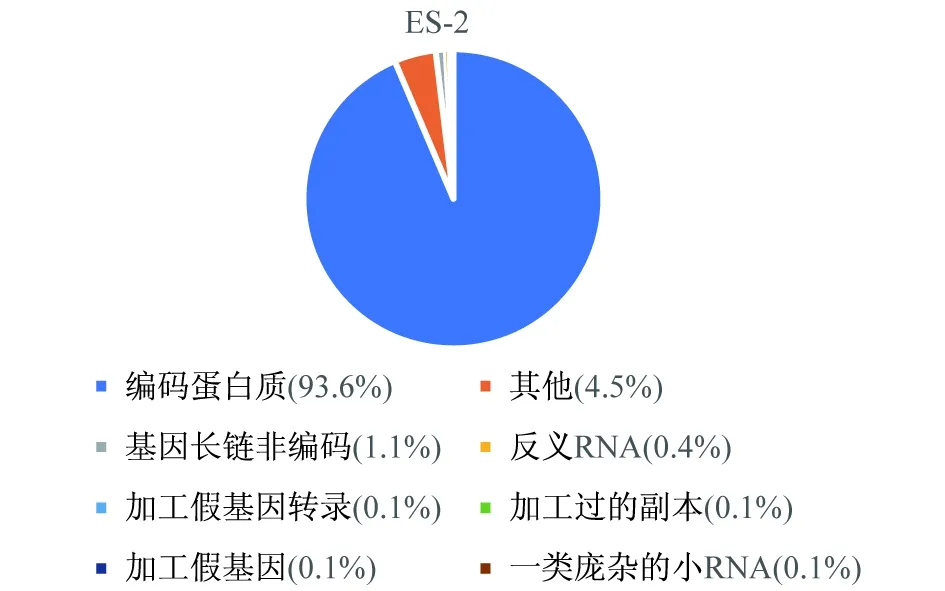
图3 怀有18-三体综合征的孕妇母血在已知基因类型的分布情况图(位图)
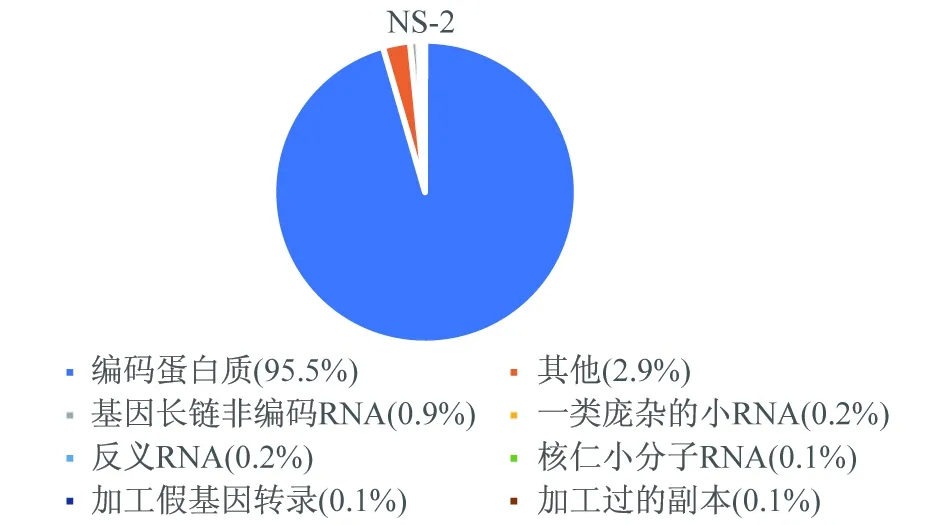
图4 正常孕妇母血在已知基因类型的分布情况图(位图)
图3、图4结果文件说明,在已知基因类型的分布情况。采用HTSeq或Hisat2软件对该物种样品不同已知基因类型进行覆盖度分析,使用的模型为维恩图(union)。根据表达量统计样品中各类型基因的的表达分布,得到reads在已知基因类型上的分布情况。
在circRNA的生物成因中,有几种被提出的模型,包括剪接的依赖循环路径(图5)。18-三体样本的环状RNA的总数比正常对照组多,大概是1.3倍,由图5可知,circRNA来源intergenic占63.20%,比正常人的38.80%多,正常人的circRNA来自外显子占41.90%,而18-三体征样本才占2.30%,这与环状RNA绝大多数来源于外显子,少部分由内含子直接环化形成的特征有关。
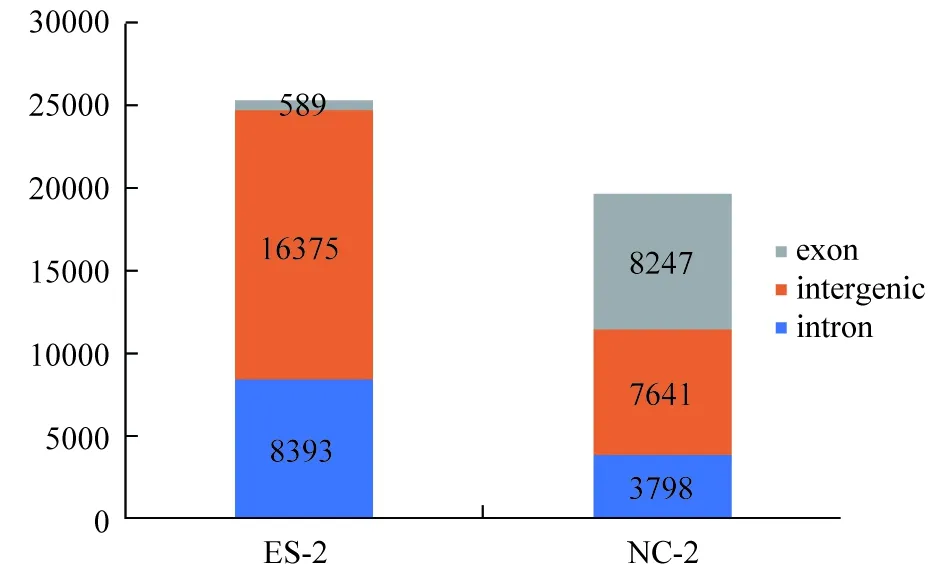
图5 样本的circRNA的来源注: exon:环状RNA位于已知基因的某一个外显子内,其序列由breakpoint之间的所有碱基构成;intergenic:环状RNA位于已知基因的之间,其序列由breakpoint之间的所有碱基构成;intron:环状RNA位于已知基因的某一个内含子内,其序列由breakpoint之间的所有碱基构成
图5统计了样本的circRNA的来源: circRNA可以来源于 exon 或 intron 的剪接。
所有circRNA的差异分析结果显示(图6),样本和对照组circRNA差异性表达共有13 278个,其中包括5007个上调,8271个下调。从中筛选出log2(Fold_change)差异系数大于或者等于5的共有7718个,差异系数最大(10.826)的为hg38_circ_0028679,以及hsa_circ_0005152、hg38_circ_0028661、 hsa_circ_0001649与hsa_circ_0003570等也有明显的差异表达。
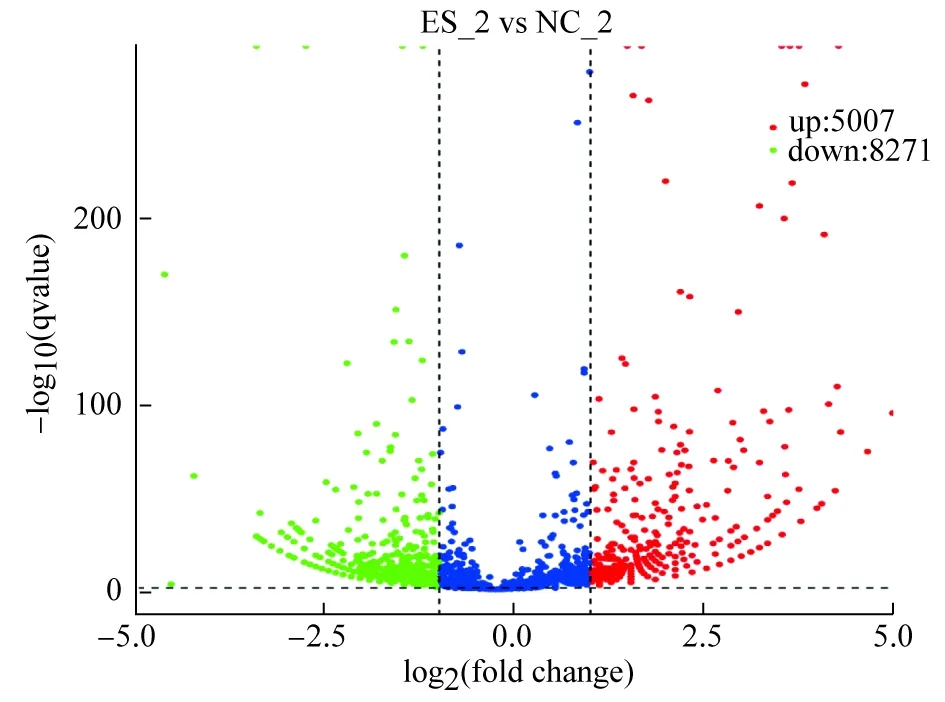
图6 实验组与对照组的差异表达的circRNA
3 讨论
研究表明hsacirc 0001649在胃癌(GC)、肝癌(HCC)中显著差异表达,并可能成为诊断GC的新的潜在生物标志物[14-16]。hsa_circ_0001649在18-三体综合征与对照组中的显着差异性表达上调具有非常重要的意义,极有可能为18-三体产前诊断的潜在生物标记物。此外,hsa_circ_0001649被认为可能具有包含miR-1283、miR-4310、miR-182-3p、miR-888-3p、miR-4502、miR-6811-5p、miR-6511b-5p和miR-1972的作用[17]。值得注意的是,18-三体细胞(包括干细胞和祖细胞)的增殖速率受损[18,19],这可能部分与怀孕早期的流产有关,18-三体征胎儿的流产率高达72%[20,21]。大鼠差异表达基因的比较分析,基于通路的富集分析显示,18-三体性显示PI3K / AKT途径失调,细胞周期G2/M DNA损伤检查点调节以及细胞死亡和存活,如以及抑制上游调节剂TP53[22]。通过基因组富集分析和双聚类,我们还发现大多数差异表达lncRNA与线粒体功能密切相关。目前对环状RNA功能的研究主要集中在竞争性内源性RNA (ceRNA)上。circRNA影响转录后调控的功能主要通过被当做海绵吸附miRNA来实现的[23]。
我们使用了全基因组测序的方法选择性分析了怀有18-三体综合征的孕妇的外周血中circRNA的差异性表达,对18-三体综合征和正常细胞增殖控制中的作用,涉及增殖控制和细胞凋亡的过程对三体征息息相关。值得注意的是,hsa_circ_0001649的表达在18-三体与对照组的比对显著上升,极有可能是18-三体综合征的产前诊断标记物,可能与18-三体综合征的激活体系相关,为无创性的18-三体产前诊断提供一定的依据。Koide K等[24]比较了孕18-三体母细胞和整倍体胎儿的羊水中的无细胞胎儿RNA的全球GE(基因表达),并发现在18-三体样品中与细胞死亡网络相关的基因被下调。越来越多的证据表明组蛋白乙酰化参与染色质重塑,进而影响生物学过程,包括细胞凋亡[25]。
18-三体综合征的检测仍然是产前筛查的主要目的,circRNA是一个长期被忽略的RNA种类,最近在新兴的非编码RNA家族中得到了关注。新一代测序和生物信息学技术的进步已经揭示了人类细胞中的一万多个circRNAs。虽然大多数这些circRNA的调节和功能仍然难以捉摸,但是研究开始探索它们的作用以及某些circRNA的临床意义。此外,许多circRNA在癌症和正常组织之间差异表达,表明这些circRNA可能在癌症中具有潜在功能和临床相关性。然而,circRNA在产前诊断中的研究尚处于起步阶段,关于它们的生物发生,调节和功能还有许多尚未解答的问题。而circRNA的作用机制还远未完全了解。circRNA可能在多个水平上调节基因表达。由于大部分的circRNA是由前体mRNAs产生的,主要被加工成成熟的mRNA,因此circRNAs与其宿主基因之间是否存在不同的调控和功能是一个值得探讨的课题。此外,这一领域为产前诊断和环状RNA治疗开辟了新的可能性。
参考文献
[1] 邓齐文, 许晔琼, 王书奎. 长链非编码RNA多态性与肿瘤相关性的研究[J]. 医学研究生学报, 2014, 27(3): 303-306.
[2] 张腾飞, 黄修燕. 环状RNA在肿瘤中的研究近况[J]. 世界肿瘤研究, 2017, 7(4): 99-104.
[3] Sanger HL, Klotz G, Riesner D, et al. Viroids are single-stranded covalently closed circular RNA molecules existing as highly base-paired rod-like structures[J]. Proc Natl Acad Sci USA, 1976, 73(11): 3852-3856.
[4] Nigro JM, Cho KR, Fearon ER, et al . Scrambled exons[J].Cell,1991,64(3):607-613.
[5] Capel B, Swain A, Nicolis S. Circular transcripts of the testis-determining gene Sry in adult mouse testis[J]. Cell, 1993, 73(5): 1019-1030.
[6] 刘军强, 吴慧, 朱诗琪, 等. 环状RNA研究进展[J]. 江苏师范大学学报(自然科学版), 2016, 34(01): 47-52.
[7] Chen B. Circular RNA: An emerging non-coding RNA as a regulator and biomarker in cancer[J]. Cancer Lett, 2018,1(418):41-50.
[8] Torres EM, Williams BR, Amon A. Aneuploidy: Cells losing their balance[J]. Genetics , 2008, 179(2), 737-746.
[9] 王培林. 遗传病学[M]. 北京: 人民卫生出版社, 2000:771-772.
[10] 吴梓梁. 小儿内科学[M].郑州:郑州大学出版社, 2003, 1183-1190.
[11] Qiu JJ, Liu YN, Ren ZR, et al. Dysfunctions of mitochondria in close association with strong perturbation of long noncoding RNAs expression in down syndrome[J]. Int J Biochem Cell Biol, 2017, 92: 115-120.
[12] 潘正军, 孟广红. 生物体内RNA的种类和功能概述[J]. 济南职业学院学报, 2005, 6: 51-53.
[13] Umu SU, Langseth H, Bucher-Johannessen C, et al.A comprehensive profile of circulating RNAs in human serum[J].RNA Biol, 2017, 8: 1-9.
[14] Li P, Chen S, Chen H, et al. Using circular RNA as a novel type of biomarker in the screening of gastric cancer[J] . Clin Chim Acta, 2015, 444: 132-136.
[15] Li WH. Decreased expression of hsa_circ_00001649 in gastric cancer and its clinical significance[J]. Dis Markers, 2017,2017:4587698.
[16] Yao T, Chen Q, Fu L, et al.Circular RNAs: Biogenesis, properties, roles, and their relationships with liver diseases[J]. Hepatol Res, 2017, 47(6): 497-504.
[17] Qin M,Liu G,Huo X, et al.Hsa_circ_0001649: A circular RNA and potential novel biomarker for hepatocellular carcinoma[J]. Cancer Biomark, 2016, 16(1): 161-169.
[18] Hibaoui Y, Grad I, Letourneau A, et al. Modelling and rescuing neurodevelopmental defect of Down syndrome using induced pluripotent stem cells from monozygotic twins discordant for trisomy 21[J]. EMBO Mol Med , 2014, 6(2):259-277.
[19] Liu B, Filippi S, Roy A, et al. Stem and progenitor cell dysfunction in human trisomies[J]. EMBO Rep, 2015, 16(1): 44-62.
[20] Morris JK, Savva GM. The risk of fetal loss following a prenatal diagnosis of trisomy 13 or trisomy 18[J]. Am J Med Genet A , 2008, 146A(7): 827-832.
[21] Witters G, Van Robays J, Willekes C, et al. Trisomy 13, 18, 21, Triploidy and Turner syndrome: The 5T’s.Look at the hands[J]. Facts Views Vis Obgyn, 2011, 3(1): 15-21.
[23] Kartha RV, Subramanian S. Competing endogenous RNAs (ceRNAs): new entrants to the intricacies of generegulation[J]. Frontiers in genetics, 2014, 5: 8.
[24] Koide K, Slonim DK, Johnson KL, et al. Transcriptomic analysis of cell-free fetal RNA suggests a specific molecular phenotype in trisomy 18[J]. Hum Genet, 2011 , 129(3): 295-305.
[25] Fullgrabe J, Hajji N, Joseph B. Cracking the death code: apoptosis-related histone modifications [J]. Cell Death Differ, 2010, 17(8):1238-1243.

