犬急性阈上迷走神经刺激介导型心房纤颤模型心房重构的变化
叶 坤, 芦颜美, 张 玲, 周贤惠, 李耀东, 张疆华, 邢 强, 祖克拉·吐尔洪,张银玲, 布阿杰尔·古丽, 汤宝鹏
(新疆医科大学第一附属医院心脏起搏电生理科, 乌鲁木齐 830054)
心房纤颤是危害人类健康、严重影响生活质量的重要心血管疾患之一,随着人口老龄化,房颤的发生率逐渐增高[1-2]。对房颤发病机制的理解有助于指导临床建立更有效的治疗方案[3]。而稳定的实验动物疾病模型的建立是研究发病机制的基础。上个世纪开始,出现了构建房颤的各种动物模型以供临床研究[4-6]。目前最经典的房颤电重构模型为心房快速起搏(rapid atria pacing,RAP),可以模拟房颤时各项电生理数据的变化[7]。本研究在此基础上建立阈上迷走神经刺激介导型的心房纤颤模型,模型制作成功后,检测房颤模型中电重构的电生理指标变化、结构重构的心肌纤维化以及糖原累积的变化、自主神经重构中心房神经节丛的神经指标变化,最终通过这些客观指标评价模型的优劣。
1 资料与方法
1.1实验对象成年健康比格犬13只,雌雄不限,体质量(12.0±1.5)kg,年龄1~2岁,由新疆医科大学第一附属医院动物中心提供。实验通过新疆医科大学第一附属医院伦理委员会审核批准,审批号:IACUC-20121122005。实验遵守美国国立卫生研究院实验动物研究指南指导实施,犬年龄、健康状况、以及后期犬的营养饲养、监护等,均由中级职称兽医师(新疆医科大学第一附属医院动物中心)评定、专业饲养员负责。
1.2方法
1.2.1 动物准备和电生理测量标准 13只比格犬,随机分为2组,GroupI为心房快速起搏(rapid atria pacing,RAP)6 h组(n=6),GroupII为RAP+迷走神经刺激(vagal nerve stimulation,VNS)6 h组(n=7)。欲行手术前动物禁食、水12 h。常规消毒手术器械、手术服、手术环境。严格按照无菌技术规范要求操作。专职兽医给予犬戊巴比妥钠20 mg/kg麻醉,并建立通畅静脉通道,给予持续滴注麻醉镇痛复合液(具体成份包含:0.9%氯化钠注射液250 mL,氯化琥珀胆碱注射液300 mg,枸橼酸芬太尼注射液0.1 mg),维持手术中肌松状态。待犬的状况稳定后行气管插管,呼吸机辅助呼吸,调节氧流量4~6 L/min,潮气量计算为20 mL/kg,在空气流通的房间内给予呼吸机正压通气、保温毯保持体温(36.5±1.5)℃上下。按照标准导联连接心电图导线,应用LEAD-7000多导电生理记录仪-动态记录犬正常肢体导联心电图。犬胸部剪除犬毛,用碘酒、酒精消毒切口后,选择左、右两侧按顺序先后分别第4肋间开胸。多极电极分别缝制在左右心房、左右心耳,用于起搏以及记录单相动作电位(monophasic action potential,MAP),各个部位程序刺激以及MAP记录均由电极连接心脏程序刺激仪完成(Lead-7000 EP Control,Sichuan Jinjiang,China)。电极缝制完毕,逐层关胸。监测血氧饱和度、动脉血压等犬的基础生命体征及症状。左心耳缝制的多极电极,起搏频率设定为1 200次/min,起搏电压为2倍起搏阈值(threshold,TH)。房颤诱发率测量应用LEAD-7000电生理仪,采用S1S1刺激30 s,观察房颤是否维持5 s以上,若有则定义为成功诱发1次,每个部位重复测量3次,同一区域多个部位诱发率的平均值为最终区域诱发率。房颤定义为心房无序的电活动,心电图表现为P波消失,代之以大小不等、间隔不均,形态不一的f波,频率450~600次/min,RR间期不等,持续5 s以上。
1.2.2 颈部迷走神经干刺激 分离犬颈部右侧迷走神经干,给予采用一对自制镀钨银丝(直径0.1 mm)平行插入颈部迷走交感神经干,间距2~3 mm,通过Grass刺激仪(S88X,Astro-Med Inc.,Warwick,RI,USA)高频电刺激迷走神经干(high-frequency stimulation,HFS;20 Hz,间隔0.1 ms,方波)进行迷走刺激(vagal nerve stimulation,VNS),产生效应。为避免神经干燥,给予液体石蜡浸润。能延缓窦性心率的VNS最低电压值即被定义为阈值,选择高于阈值、引起窦性心率下降50%或者出现二度房室传导阻滞的电压为刺激电压,所需的电压范围为2.0~3.5 V,称为阈上迷走神经刺激。
1.2.3 马松染色(MASSON染色)、糖原染色(PAS染色)心房肌形态学观察 取冷盐水冲洗各部位标本。分别取GroupI和GroupII左、右心房肌组织进行病理形态学观察,组织(1 mm×3~5 mm)用4%多聚甲醛液体固定,经过石蜡包埋切片,室温下放置备用。切片常规脱蜡,行MASSON和PAS染色。
1.2.4 免疫组化法半定量检测右上神经节(anterior right ganglionated plexi,ARGP)中酪氨酸羟化酶(Tyrosine hydroxylase,TH)、胆碱乙酰转氨酶(Choline acetyl transaminase,CHAT)的表达 一抗孵育:滴加多克隆抗体50 μL,4℃冰箱过液,次日晨37℃复温30 min。PBS冲洗3次,每次3 min;二抗孵育:滴加兔二步法检测盒二抗工作液50 μL,37℃孵育20 min,PBS冲洗3次,每次3 min;DAB显色5~10 min,在显微镜下掌握染色程度;苏木素复染5 min,盐酸乙醇中分化,自来水冲洗15 min。脱水,透明,封片,镜检。
本实验选用计算机辅助形态计量分析系统(Image-Pro Plus 6.0)测定密度,计算机自动识别显色后的自主神经,并计算出显色神经的像素面积,神经密度定义为神经的面积除以总的检测面积(μm2/mm2)。每张切片于40倍目镜下观察,并选取神经密度最大的3个视野,其平均值为每张切片的神经密度[6]。

2 结果
2.1模型制作完成情况在整个实验过程中,动物血氧饱和度持续维持在95%以上、血压平稳,未出现因快速起搏造成的心力衰竭征象。起搏6 h后,2组制作犬急性房颤模型成功率可达到100%。
2.2电重构指标在不同房颤模型中的变化水平
2.2.1 心房肌单相动作电位变化 GroupI与GroupII左、右心房肌MAP变化的组间比较显示, 随着起搏时间的延长,MAP形态变化明显,振幅减小、时限缩短,诱发房颤时心动周期不规则,MAP呈现多形性,连续的MAP间舒张间期消失,且2组APD90比较差异有统计学意义(P<0.05)(表1)。
2.2.2 左右房区域房颤诱发率的比较 2组组间比较差异有统计学意义(P<0.05)。组内比较可见,各组随着电重构时间的延长,左、右心耳房颤诱发率和基线水平比较差异均有统计学意义(P<0.05),每小时末诱发率显著增加,2组均在6 h诱发率达到最高。其中,GroupII左心耳AF诱发率在6 h达到100%(表2)。
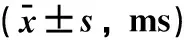
表1 左右心房肌MAP(APD90)的比较
注:与基线比较,*P<0.05。
表2 房颤诱发率的比较/%
注:与基线比较,*P<0.05。
2.3结构重构指标在不同房颤模型中的变化水平
2.3.1 马松染色(MASSON染色)的比较 MASSON染色显示左、右心房均可见胶原纤维呈现蓝色,心肌纤维呈现红色,胶原纤维相互连接成网状。2组均可见胶原纤维分布紊乱,心肌束被胶原纤维包绕分隔。但是组间比较差异无统计学意义(P>0.05)。2组左心房分别为(24.60±2.47)×1 000 μm2/mm2和(22.54±5.21)×1 000 μm2/mm2;2组右心房分别为(26.34±3.12)×1 000 μm2/mm2和(27.55±4.63)×1 000 μm2/mm2(图1)。
A: GroupI左心房MASSON染色 B:GroupII左心房MASSON染色,均可见胶原纤维分布紊乱,心肌束被胶原纤维包绕分隔
图12组左心房肌MASSON染色观察
2.3.2 PAS染色的比较 PAS染色显示2组左心房心肌细胞结构完整,排列整齐,被少量的间质组织包绕;细胞核大而清晰,但2组心肌细胞均有糖原异常累积聚集,累积糖原显示为紫红色聚集。2组左心房分别为(35.42±5.26)×1 000 μm2/mm2和(41.25±4.32)×1 000 μm2/mm2,差异有统计学意义(P<0.05);2组右心房分别为(29.34±6.18)×1 000 μm2/mm2和(36.25±4.67)×1 000 μm2/mm2,差异有统计学意义(P<0.05)(图2)。

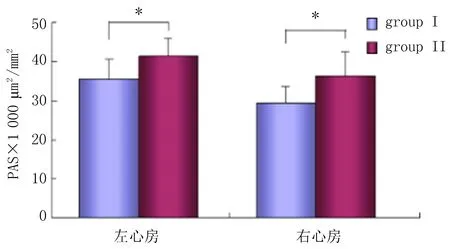
图2 左、右心房肌PAS染色
2.4神经重构指标在不同房颤模型中的变化水平心外膜神经网络在房颤起源和维持中担任重要角色,神经节丛为重要组成部分,本实验选取ARGP进行TH和CHAT的免疫组化染色,半定量对比不同情况下蛋白表达的区别。免疫组化显示神经节中数个阳性细胞呈深棕色,形状不一,核呈蓝染。2组心外膜神经节丛均显示了以CHAT染色为主的特点,且胆碱能和肾上腺素能神经元共存。2组ARGP中TH分别为(10.85±3.24)×1 000 μm2/mm2和(25.63±1.20)×1 000 μm2/mm2,差异有统计学意义(P<0.05)。2组ARGP中CHAT分别为(33.36±5.24)×1 000 μm2/mm2和(72.35±4.65)×1 000 μm2/mm2,差异有统计学意义(P<0.05)(图3)。
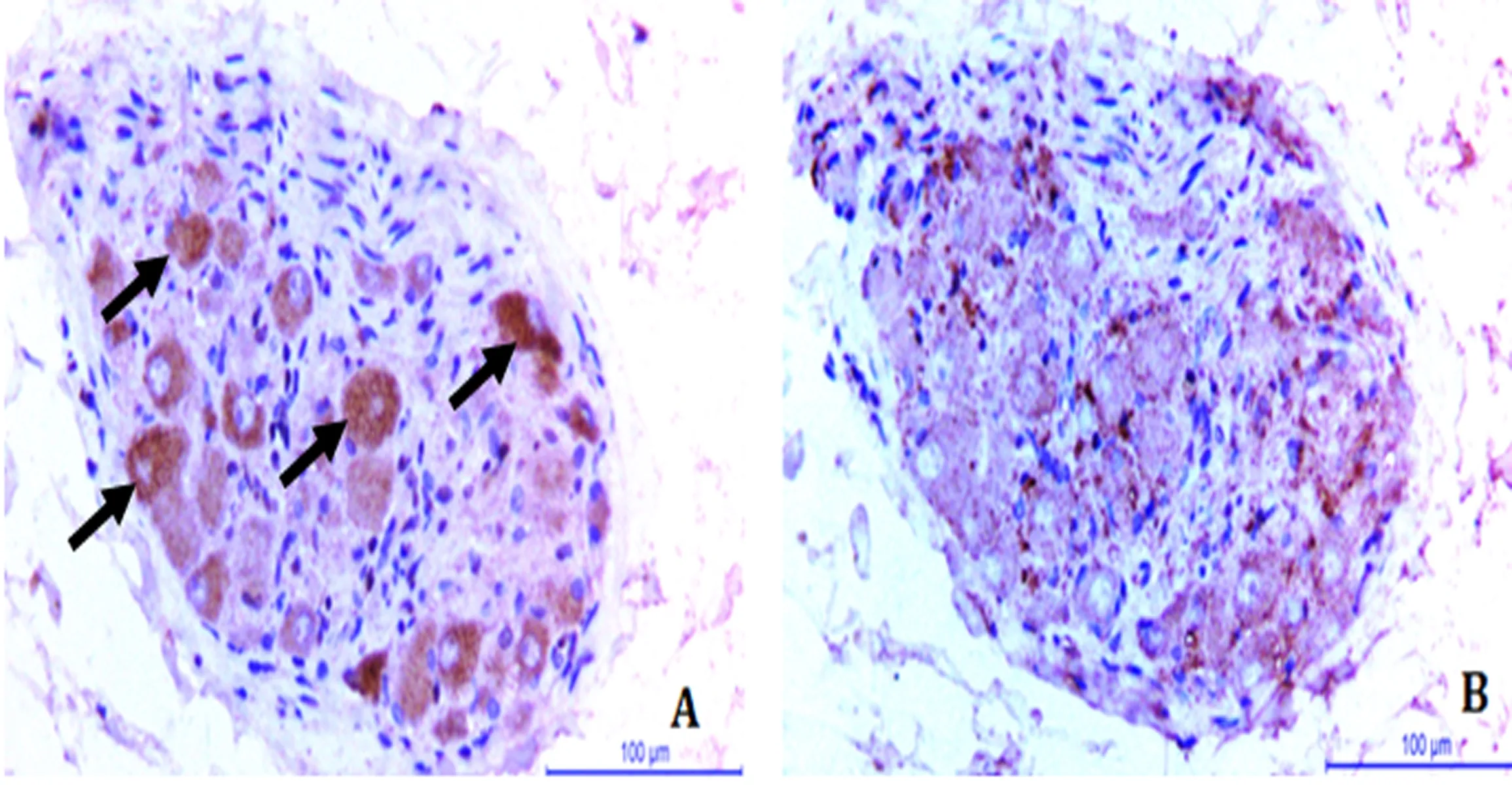
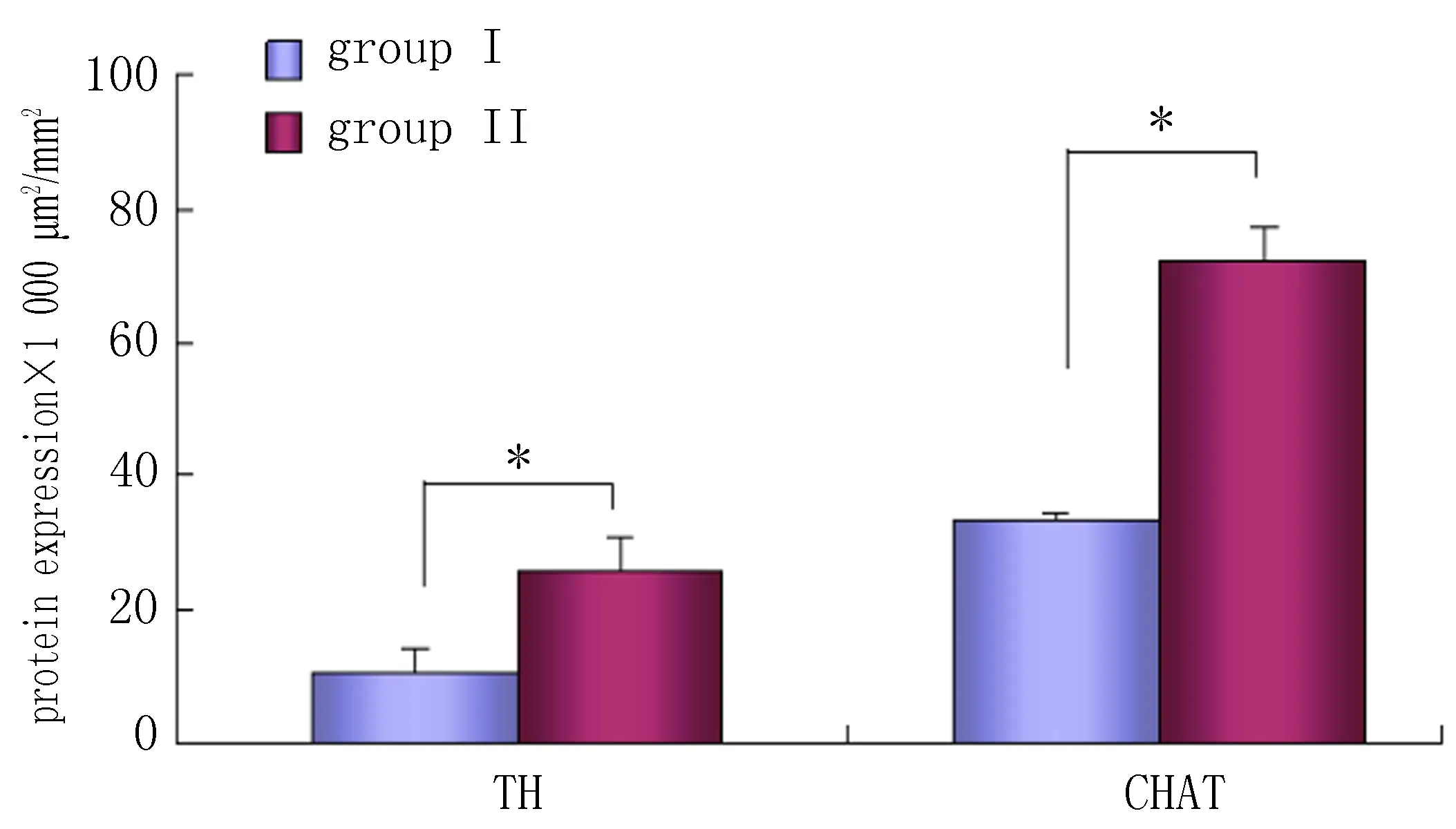
图3 ARGP中TH、CHAT的表达
3 讨论
本研究中RAP引起的电生理变化和人类房颤及其他动物房颤模型的电生理改变一致。RAP模型很适合被应用于研究房颤的发生和相关电生理、分子生物学等机制。大量实验已经证实,与临床房颤接近,房颤诱发率高,制作简单可靠的动物模型是RAP模型[8]。但是,本研究在迷走神经兴奋可诱发房颤的理论依据下,通过颈部迷走神经干阈上刺激加心房不同部位快速心房起搏的方法成功制作了阈上迷走神经刺激介导的犬急性房颤模型。结果检测心房组织各项电生理指标可见代表电重构的电生理指标MAP缩短明显,提示迷走神经介导的急性房颤模型电重构更加容易发生;检测心房组织结构重构的心肌纤维化指标中,既往研究对于犬房颤模型中结构重构的研究是有限的,只有少数研究提及在犬房颤模型制作1周后代表心房组织学的心房纤维化并无明显改变[9-10]。这和本实验研究结果一致,虽然MASSON染色片未见心肌胶原纤维表达有差异,但是心房组织糖原染色中提示迷走神经刺激状态下糖原累计更加严重,说明早期急性房颤模型中结构重构虽然没有发生,但是糖原累积这一特异性标志改变已经开始。检测心外膜神经节丛代表自主神经重构的TH、CHAT表达可见,叠加迷走神经刺激的心外膜神经节丛TH、CHAT表达均上调,并且同一神经节丛中以CHAT表达为主。总而言之,阈上迷走神经刺激介导急性房颤模型的成功主要建立在形成电重构和自主神经重构基础之上。
与既往实验研究相比,本实验还显示,经典的RAP模型制作不仅是在长时间后才能逐渐出现诱发房颤的现象,而且虽然在6 h达到顶峰,但房颤诱发率也没有超过50%;给予阈上迷走神经刺激的房颤模型组,显示出从基础值开始,各个时间点均易于诱发房颤,于6 h到达顶峰,所有部位房颤诱发率>60%,左心耳区域可达到100%诱发。故本研究还显示出在RAP基础上叠加阈上迷走神经刺激,更加易于成功构建犬房颤模型。对于需要制作周期短、模型稳定、成功率高的动物模型,选择VNS+RAP将更为适合。
国内外研究者探究各种模型房颤发生、维持和终止可能的机制[11-15],但是临床上房颤的发生机制不应是单一的,不能用一种房颤模型模拟出临床上种类众多的房颤。我们可对不同房颤模型进行关于房颤共性的研究,同时也可对相应原因的房颤作一些个性的研究。随着实验模型的建立朝着符合人体病理生理学方向的发展,以及新的房颤致病基因的发现,我们对房颤机制的认知必定大大改进,从而可能有更有效的治疗策略应用于临床。
本模型制作方法相对简单,房颤诱发率高、重复性好、持续时间长,病理生理基础与临床状况较为相似,一次实验即可完成模型制作,同时也为研究迷走神经在房颤发病及治疗中的地位和作用提供了重要的研究基础。

