思维建模视角下的热化学方程式书写
福建
洪兹田 陈珍胜
思维建模是借助于一些特定的工具(如思维导图)和方法将知识内在的思维过程建立模型,进行可视化表征的认知方法。本文对热化学方程式书写(含ΔH的计算)常见的考查视角进行归纳,并基于模型建构的视角对各种考查类型建立思维模型。
一、直接描述型热化学方程式书写
1.解题关键
根据题给信息换算成与热化学方程式相应物质的物质的量一致的ΔH。
2.思维建模

3.例题剖析
0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为________________________________________。


二、利用燃烧热书写热化学方程式
1.解题关键
准确理解“燃烧热”的概念:
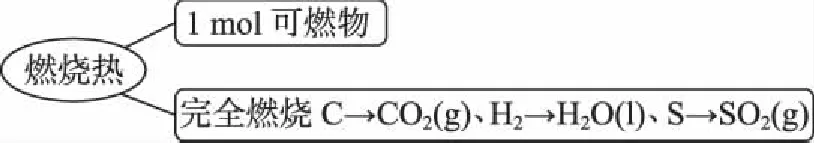
2.思维建模
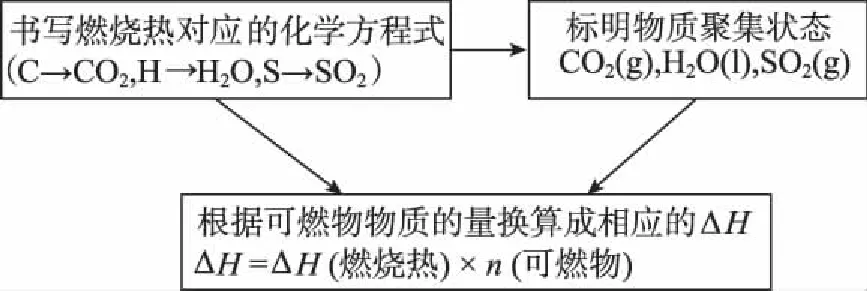
3.例题剖析
已知CH4的燃烧热数值为890 kJ·mol-1。下列热化学方程式正确的是
( )




解析:选项A中ΔH应为负号,故选项A错误;选项B中H2O的状态错误,应为H2O(l),故选项B错误;选项C中由于CH4为2 mol,故ΔH=-890 kJ·mol-1×2=-1 780 kJ·mol-1,故选项C正确;选项D中,生成物CO(g)错误,应为CO2(g)。
答案:C
三、根据反应热测定实验计算中和热ΔH
1.解题关键
中和热是指在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热。故先计算反应热Q,然后由Q=ΔH(中和热)×n(H2O)计算ΔH(中和热)。
2.思维建模

3.例题剖析
分别取100 mL 0.50 mol·L-1盐酸与100 mL 0.55 mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为 24.9℃,则实验测得的中和热ΔH=___________(保留1位小数)。
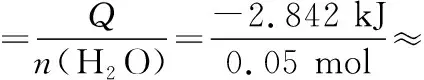
答案:-56.8 kJ·mol-1
四、利用活化能计算ΔH
1.解题关键

理清活化能(Ea)与焓变(ΔH)的关系。活化能是指活化分子的平均能量与反应物分子平均能量的差值。从反应物至最高点的能量数值表示正反应的活化能Ea(正);从最高点至生成物的能量数值表示逆反应的活化能Ea(逆)。ΔH=Ea(正)-Ea(逆)。加入催化剂能降低反应的活化能,但不影响ΔH的大小。
2.思维建模
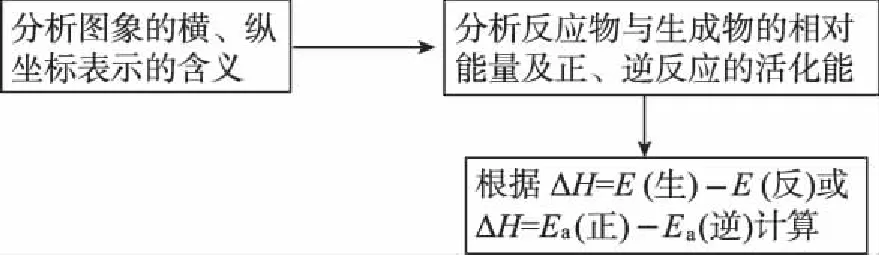
3.例题剖析
某化学反应的能量变化如图所示。下列有关叙述正确的是
( )

A.该反应的反应热ΔH=E2-E1
B.a曲线的条件是加入催化剂
C.催化剂能降低反应的活化能
D.通过催化剂能改变反应的ΔH
解析:该反应的ΔH=E1-E2,故A错误;加入催化剂后使反应的活化能降低,b曲线的条件是加入催化剂,故B错误;催化剂能降低反应的活化能,故C正确;催化剂未改变反应物和生成物的能量,也未改变反应的焓变,故D错误。
答案:C
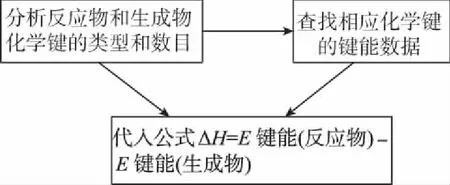
五、利用键能计算ΔH(或书写热化学方程式)
1.解题关键
准确分析反应物和生成物化学键的类型和数目,应用公式ΔH=E键能(反应物)-E键能(生成物)。中学阶段常见物质中所含共价键的数目(以1 mol物质为例):
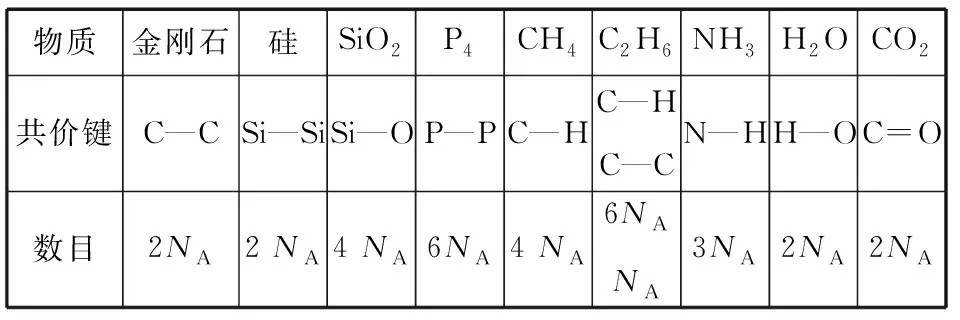
物质金刚石硅SiO2P4CH4C2H6NH3H2OCO2共价键C—CSi—SiSi—OP—PC—HC—HC—CN—HH—OC=O数目2NA2 NA4 NA6NA4 NA6NANA3NA2NA2NA
2.思维建模
3.例题剖析
解析:设1 mol HI(g)分子中化学键断裂时需吸收的能量为x,根据ΔH=E(反应物)-E(生成物)=2 mol·x-436 kJ-151 kJ=+11 kJ,解得x=299 kJ·mol-1。
答案:299
六、利用物质的能量计算ΔH
1.解题关键ΔH=E(生成物)-E(反应物)
2.思维建模
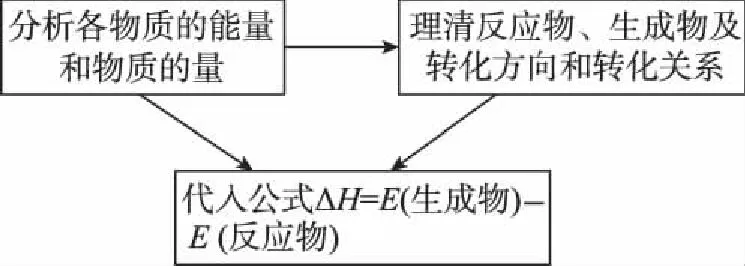
3.例题剖析


物质H2(g)CO2(g)CH2=CH2(g)H2O(g)能量/kJ·mol—10-39452-242
则ΔH=________。
解析:ΔH=E(生成物)-E(反应物)=[(-242)×4+52-(-394)×2-0×6)]kJ·mol-1=-128 kJ·mol-1
答案:-128 kJ·mol-1
七、利用盖斯定律书写热化学方程式
(一)分步加和法
1.解题关键
对已知热化学方程式进行叠加,得到目标(或待求)的热化学方程式。
2.思维建模
先确定
待求的
反应方
程式 ⟹找出待求方
程式中各物
质在已知方
程式中的位置⟹根据待求方程式中
各物质的计量数和
位置对已知方程式
进行处理,得到变
形后的新方程式 ⟹将新得到的方程式
进行加减(反应热
也需要相应加减)⟹写出待求
的热化学
方程式
3.例题剖析
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H2所需能量较少的是_________________。
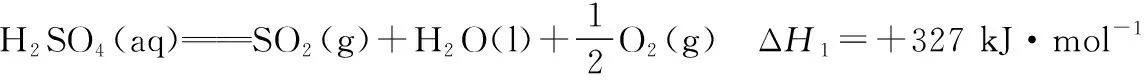



根据系统Ⅰ、系统Ⅱ的热化学方程式可知,每反应产生1 mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统Ⅱ。

(二)途径分析法
1.解题关键
途径设计分析,建立物质、能量的“转化模型”,使反应物经过一些中间步骤最后回到产物。
2.思维建模
设某反应为“反应物→生成物”,有如下几种转化途径:

途径Ⅰ、Ⅱ、Ⅲ的焓变ΔH(Ⅰ)、ΔH(Ⅱ)、ΔH(Ⅲ)依次为ΔH1+ΔH2、ΔH、ΔH3+ΔH4+ΔH5,且ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
3.例题剖析
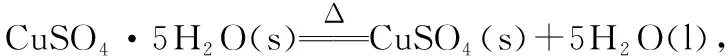
( )
A.ΔH2>ΔH3B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2>ΔH3
解析:可设计如下“转化模型”:
据题意ΔH2<0、ΔH3>0,可知ΔH3>ΔH2,选故项A错;根据上述转化过程,根据盖斯定律可知ΔH2=ΔH1-ΔH3,即ΔH2+ΔH3=ΔH1,故选项CD错误;又ΔH2=ΔH1-ΔH3<0(ΔH2<0),所以ΔH1<ΔH3,故选项B正确。


