归纳类型 找准方法——例谈高考试题中的化学综合计算
江苏
王建华
高考试题中的化学综合计算,已不再局限于教材,而是以具有实际应用的科研实验背景为素材。这也体现了化学核心素养的要求,是高中化学的核心之一,也是每年高考必考的内容。它在近年高考中具有较强的稳定性和延续性,在考试中有较好的区分度。该题型主要以滴定形式出现,能有效地考查学生对氧化还原反应滴定、酸碱中和滴定、沉淀滴定等基本操作方法的掌握程度和答题规范性。本文对近几年高考化学试题进行归纳和梳理,总结出解答此类题的常用方法,以供同仁参考。
一、理清思路,归纳类型
高考化学实验综合题从实验目的来看主要有两种:(1)测定物质的组成,(2)测定物质的含量(包括物质纯度的测定以及多组分成分的分析);从实验方法来看,主要有三种:(1)测气体体积,(2)测固体质量(重量分析、热重分析),(3)测液体体积(滴定法)。滴定法又包括酸碱滴定法、氧化还原滴定法、配位滴定法、沉淀滴定法等;从计算所用的方法来看,主要也有三种:(1)守恒法(电荷守恒、质量守恒、得失电子守恒),(2)关系式法,(3)方程组法。
高考试题中的化学综合计算,主要以滴定形式出现,其中有三大类型滴定方式:
(1)一步滴定:“A→B” 型,(2)连续滴定:“A→B→C” 型,(3)返滴定:“A→B(过量),B(剩余)→C” 型。
二、找准方法,典例剖析
1. 一步滴定:“A→B”型
通过一次单向滴定恰好反应,就可测定出未知粒子的物质的量。方法为列出反应方程式或关系式,然后计算。
【例1】(2017年江苏卷·18节选)碱式氯化铜是重要的无机杀菌剂。

【解题思路】用EDTA(Na2H2Y·2H2O)标准溶液滴定未知的Cu2+,为一步滴定“A→B”型,据反应方程式计算即可。关于未知物质化学式的确定一般步骤为(1)根据题给信息,计算出测定离子的物质的量;(2)根据电荷守恒,求出未测定离子的物质的量;(3)根据质量守恒,求出结晶水的物质的量;(4)求出各离子和结晶水的物质的量之比;(5)写出正确的化学式。
对于该题组成样品的四种微粒分别是Cu2+、OH-、Cl-、H2O,确定物质的量和测定方法如表所示:

物质的量测定方法或计量依据Cl-重量法Cu2+滴定法OH-电荷守恒H2O质量守恒

【答案】Cu2(OH)3Cl·H2O
2.连续滴定:“A→B→C”型
第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量。一般通过列总反应比例关系来计算,不需每一步滴定都要计算。
【例2】(2017年全国卷Ⅱ·26节选)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:

【解题思路】CaC2O4与H2SO4反应生成H2C2O4,然后再被KMnO4溶液滴定,这是典型的连续滴定类型“A→B→C”。对于连续滴定类型,关键是依据多步反应列出总的比例关系(据方程式或得失电子守恒等方法)。该题总反应比例关系为“5Ca2+~5H2C2O4~2KMnO4”,然后计算即可。
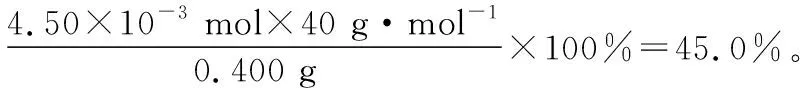
【答案】45.0%
3.返滴定:“A→B(过量),B(剩余)→C”型
第一步滴定剂是过量的,第二步再用另一滴定剂返滴定在第一步中剩余的滴定剂。根据第二步滴定计算出在第一步滴定中剩余的滴定剂的量,再根据第一步加入的滴定剂的总量减去在第二步中剩余的滴定剂的量,即可得出第一步所消耗滴定剂的量,然后据反应求出相关物质的量。

【解题思路】饮料中糖类以葡萄糖计算,第一次滴定剂I2标准溶液是过量的,第二次滴定剂Na2S2O3标准溶液与第一次I2标准溶液过剩的恰好反应,即C6H12O6→I2(过量),I2(剩余)→Na2S2O3。由第二次滴定剂Na2S2O3标准溶液据反应比例计算出第一次I2标准溶液过剩的量,再由第一次滴定剂I2标准溶液总量减去第一次I2标准溶液过剩的量,据C6H12O6与I2反应比例计算出C6H12O6的量。注意计算时量的关系(如稀释至100.00 mL,取10.00 mL)。

【答案】27.00 mg·mL-1


