浅析硝酸性质中的几个“反常”
河北
韩万中
硝酸,俗称硝镪水,自然界中的硝酸主要由雷雨天气生成的NO或微生物生命活动放出的NO2形成,在工业上以氨的催化氧化、进一步氧化、最后在吸收塔中用水吸收制备。
硝酸的知识是高一上学期的内容,那时学生年龄小,视野狭窄,思维单一,对硝酸的性质只形成一些粗浅、零碎的认识。进入一轮复习后,硝酸经常出现在一些复杂的物质转化、综合实验以及工业生产流程等问题中,并冒出一些“反常”表现,令学生困惑不解。本文欲对学生提出的几个问题进行释疑,初步建立硝酸的物化性质与物质结构、化学反应原理之间的内在联系,以期清除“硝酸”复习过程中的障碍。
一、HNO3和金属反应一定产生NOx?
初学硝酸的氧化性时,教材中以不活泼金属Cu为代表物给出了铜与浓、稀硝酸的反应方程式,硝酸的还原产物NO2或NO在师生头脑中形成了深刻的印象,在遇到其他情况下往往形成思维定式,套用致错,在一轮复习时需要老师帮助学生纠正认识上的肤浅或定式。
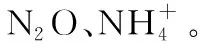
至此,可能有人会问HNO3的还原产物为什么没有N2呢?从热力学上说HNO3被还原生成N2是可行的,但由于反应活化能较高,化学反应速率慢,所以不具有动力学上的现实性。
【例1】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理。回答下列问题:
(1)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是___________________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入___________________(写化学式)。

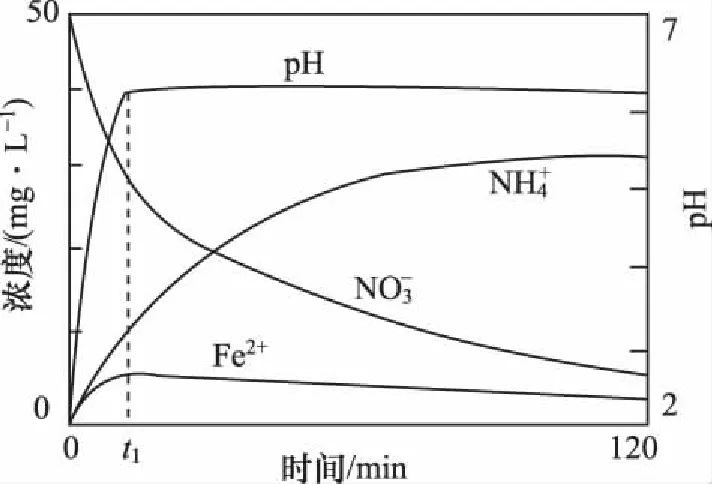
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:___________________;
假设三:___________________。
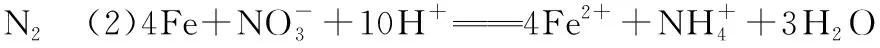
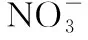
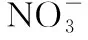

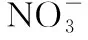
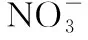
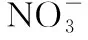
二、与NH3反应时,HNO3为什么表现酸性而非氧化性呢?
【例3】某兴趣小组用下图装置探究氨的催化氧化。
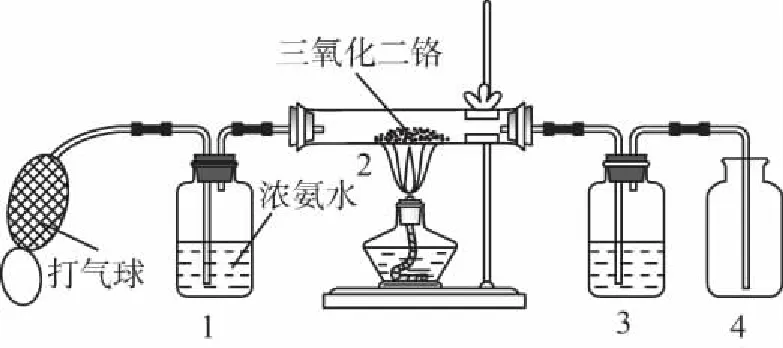
为保证在装置4中观察到红棕色气体,装置3应装入________;若取消3,在4中仅观察到大量白烟,原因是___________________。
参考答案:浓H2SO4生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
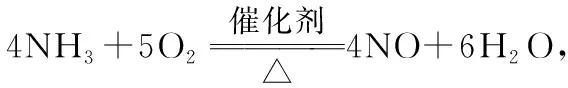
这种解释无疑是合理的,也是广大同学能够接受的。掩卷之后,有学生来问,硝酸是大名鼎鼎的氧化剂,NH3中的N元素的化合价为-3价有还原性,HNO3为什么不氧化NH3呢?
原来,NH3既有碱性又有还原性,与之相对应HNO3则表现酸性和强氧化性,它们之间无论发生非氧化还原反应还是发生氧化还原反应,在热力学上都是可行的。但是它们之间发生氧化还原反应的活化能要比发生非氧化还原反应的活化能高得多,也就是说NH3结合HNO3中的质子的能量壁垒低,反应速率快,所以它们在通常状况下不再发生氧化还原反应。(注:以反应速率为标志的化学动力学因素影响了物质氧化性或还原性的发挥。)
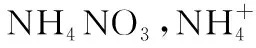
【例4】(2015年海南,16节选)硝酸铵加热分解可得到N2O和H2O。250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为___________________,平衡常数表达式为__________。
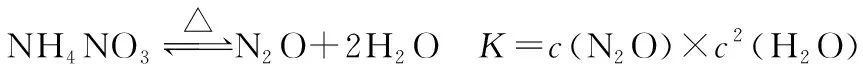
分析:根据题目给出的产物信息,很容易写出NH4NO3的分解反应方程式。在体系密闭条件下的化学反应几乎全是可逆的。
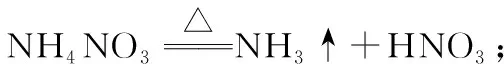
三、硝酸受热易分解吗?
人教版《必修1》中,明确指出了HClO在光照条件下的不稳定性,未涉及HNO3的稳定性与否,而苏教版《化学1》先说浓硝酸“常因溶有少量NO2而略显黄色”,后直截了当地说明“硝酸不稳定,在常温下见光或受热就会发生分解”。
硝酸的稳定性我们可以通过计算标准状态下硝酸分解反应的ΔG=ΔH-ΔS来说明。

ΔfG(kJ·mol-1) -80.79 51.31 0 -237.129
ΔG=ΔGf(生成物)-ΔGf(反应物)=[2×(-237.129)+4×51.31-4×(-80.79)]kJ·mol-1=54.142 kJ·mol-1>0,说明在标准状态下硝酸分解反应是不自发的,HNO3是一个稳定的热力学体系。实验证明,将市售浓硝酸(密度1.4 g·cm-3,含HNO369%,浓度约为15 mol·L-1),在无光照条件下加热至沸腾,只能加剧挥发,而无红棕色气体产生。
实验事实和文献中的计算结果表明温度大于375.3 K时纯硝酸是可以分解的,如有光照且加热时硝酸分解得更快。
【例5】(2017年北京,12)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )

①②③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
参考答案:D
分析:解答本题的前提必须明确浓硝酸的不稳定性,硝酸的热分解会给碳与浓硝酸反应产物的验证造成干扰。
A项,①中灼热碎玻璃起到加热作用,浓HNO3受热分解生成红棕色气体NO2,由化合价升降规律可知一定有O2产生,A正确;B项,对比实验①可知,浓硝酸受热分解可生成红棕色气体NO2,所以“产生红棕色气体”不能说明②中木炭能与浓硝酸发生反应,B正确;C项,浓硝酸具有挥发性,挥发的HNO3与上方红热木炭接触反应,生成的NO2为还原产物,C正确;D项,红热的木炭可与空气中的O2反应生成CO2,所以不能通过检验CO2来验证木炭能与浓硝酸发生了反应。
四、为什么硝酸易挥发?
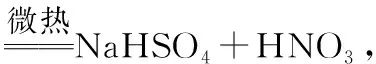
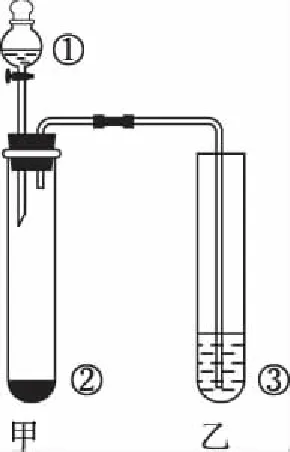
【例6】(2014年全国Ⅰ,13改编)利用下图所示装置进行下列实验,能否得出“酸性:硝酸>碳酸>硅酸”的实验结论?
参考答案:否
分析:反应发生后,甲试管中产生大量气泡,乙试管内逐渐变浑浊,很多同学根据强酸制弱酸的经验规律认为题目中所述的实验结论是正确的。他们犯了思维不严密的错误,忽视了硝酸的挥发性,挥发出来的硝酸蒸气也能与Na2SiO3溶液反应生成白色沉淀,干扰碳酸与硅酸酸性大小的比较,如果在甲、乙两试管之间增加一个可用盛有饱和NaHCO3溶液的洗气瓶除去挥发的HNO3蒸气,实验结论的可信度就会大大增强。


