氧化还原反应方程式书写的“软肋”及重难点突破
广东
杨铁初
经过长期的教学实践,发现学生在氧化还原反应方程式的书写上存在两个软肋:一是物质的判断(包括生成物和反应物),二是方程式的配平。要真正解决这两个问题,在氧化还原反应方程式的书写教学中,教师必须密切关注反应介质对反应物、生成物的影响,并始终坚持定性分析与定量判断相结合的原则。
一、问题的提出
氧化还原反应方程式的书写既是高中化学教学的重点,也是高考化学命题的热点,同时又是不少学生高考的失分点。当我们把现行的《普通高中课程标准实验教科书化学1(必修)》与高考题进行对比分析后就会发现,高考氧化还原反应方程式书写相关知识、能力的要求远高于《化学1》(必修)所学内容,但由于必修课时的限制及此时文理没分科等诸多因素,高一在进行“氧化还原反应”教学时,一般都按照教材的要求进行,因而高中初期的教学与高考要求不能无缝对接,导致学生在氧化还原反应方程式的书写上存在两个软肋:一是物质的判断(最主要是生成物是什么,有些也会涉及反应物有哪些),这是定性方面的问题;二是方程式的配平,这是定量方面的问题。
究其原因,一方面是高中教科书中没有提及氧化还原反应中的介质(即氧化剂、还原剂相互反应时的环境,通常为酸性、碱性或中性)概念,教师在平时的教学过程中也没有很好地贯彻“氧化还原反应的介质不同,产物也不同”的理念,导致学生在判断物质和配平时出现错误。另一方面是教师在教学时,忽视了从微观的角度将反应的过程展现在学生的面前,忽视了将反应物、生成物的分析推测过程与定性定量相结合的方法展示出来,而只是告诉学生像背诵英语单词一样去记忆反应的产物,没有学生的主动思考、自主探究的过程,没有学生的学科思维与学科方法的训练。
根据上述分析不难看出,氧化还原反应方程式书写教学的重难点是:
1.反应介质对反应物、生成物的影响。
2.定性分析与定量判断相结合配平方程式。
二、重难点突破
1.典型例题分析
【例1】写出次氯酸钠溶液与硫酸亚铁溶液反应的化学方程式。
(1)【定性分析】
【教师引领】次氯酸钠具有较强的氧化性,硫酸亚铁具有较强的还原性,它们反应会得到什么产物?
【学生分析】根据氧化还原反应规律,硫酸亚铁会被氧化为硫酸铁;次氯酸钠会被还原为氯化钠。
【教师引领】次氯酸钠变成氯化钠后,剩下的氧离子会发生怎样的变化?
【学生分析】在水溶液中,氧离子可能会与水分子结合形成氢氧根离子。
【教师引领】形成的氢氧根离子还会发生什么变化?
【学生分析】氢氧根离子会与硫酸铁电离产生的铁离子反应生成氢氧化铁。
【教师引领】分析至此,你认为反应物有哪些?生成物是什么?
【学生分析】反应物有:次氯酸钠、硫酸亚铁、水。反应的产物一定有:氯化钠、氢氧化铁;如果铁离子没有被完全沉淀,还有硫酸铁;如果铁离子完全沉淀,还有硫酸钠。最终的产物有两种可能:氯化钠、氢氧化铁、硫酸铁;氯化钠、氢氧化铁、硫酸钠。
(2)【定量分析1】
【教师引领】要确立产物是哪种情况,必须进行定量分析。请同学们根据氧化还原反应中得失电子守恒的规律进行分析推断。

(3)【定量分析2】
【教师引领】确定了反应物和生成物以后,就是配平的问题。怎样确定各物质的化学计量数呢?
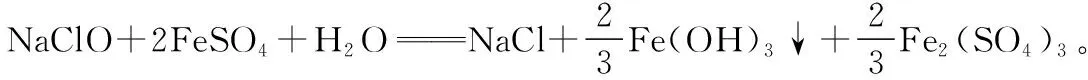

【例2】写出次氯酸钠溶液与用硫酸酸化的硫酸亚铁溶液反应的化学方程式。
(1)【定性分析】
【教师引领】变式例题与例题有什么不一样的地方?
【学生分析】不同的是反应物溶液为酸性。
【教师引领】当溶液为酸性后,次氯酸钠变成氯化钠后剩下的氧离子会有什么变化?反应物和产物会有什么不同?
【学生分析】氧离子不再与水分子结合形成氢氧根离子,而是与氢离子结合生成水。所以,反应物有:次氯酸钠、硫酸亚铁、硫酸;生成物有:氯化钠、硫酸铁、水。
NaClO+FeSO4+H2SO4——NaCl+Fe2(SO4)3+H2O
(2)【定量分析】
【教师引领】请同学们根据例题的分析思路,确定各物质的化学计量数。


【例3】写出过氧化氢溶液与碘化钾溶液反应的化学方程式。
(1)【定性分析】
【教师引领】过氧化氢具有氧化性,碘化钾具有还原性,它们反应会得到什么产物?
【学生分析】根据氧化还原反应规律,过氧化氢中-1价氧会被还原为-2价氧;碘化钾中-1价碘会被氧化为0价碘,即产物中会有碘单质。
【教师引领】氧离子不可能在溶液中存在,过氧化氢中被还原得到的-2价氧离子会发生什么变化?分析时请注意过氧化氢分子中氢、氧原子的个数比。
【学生分析】过氧化氢分子中氢、氧原子的个数比为1∶1,因此氧离子与过氧化氢还原后与剩下的氢结合形成氢氧根离子。
【教师引领】分析至此,你认为反应的生成物是什么?
【学生分析】反应物就是过氧化氢和碘化钾;生成物是碘单质和氢氧化钾。
H2O2+KI——I2+KOH
(2)【定量分析】
【教师引领】请同学们根据氧化还原反应中得失电子守恒的规律配平方程式。
【学生分析】过氧化氢作氧化剂时,每摩尔H2O2得到2摩尔电子,碘化钾作还原剂时,每摩尔KI失去1摩尔电子,因此反应中过氧化氢与碘化钾的物质的量之比应为1∶2。若参加反应的过氧化氢为1摩尔,则参加反应的碘化钾为2摩尔;生成的氢氧根离子为2摩尔,即氢氧化钾为2摩尔,碘单质为1摩尔。

【例4】写出高锰酸钾溶液与二氧化硫反应的化学方程式。
(1)【定性分析】
【教师引领】高锰酸钾具有较强的氧化性,二氧化硫具有较强的还原性,它们反应会得到什么产物?
【学生分析】根据氧化还原反应规律,高锰酸钾中+7价锰往往被还原为+2价锰;二氧化硫中+4价硫会被氧化为+6价硫。
【教师引领】+6价硫在溶液中会以什么形式存在?高锰酸钾中+7价锰被还原为+2价锰后剩下的-2价氧离子会发生什么变化?
【学生分析】+6价硫在溶液中往往以硫酸根离子形式存在,高锰酸钾中+7价锰被还原为+2价锰后剩下的-2价氧离子与二氧化硫结合形成硫酸根离子。
(2)【定量分析1】
【教师引领】接下来的问题就是:二氧化硫能否将高锰酸钾中+7价锰被还原为+2价锰后剩下的-2价氧离子全部结合?这有三种可能,一是能刚好全部结合;二是不能全部结合,还有-2价氧离子剩余;三是高锰酸钾中+7价锰被还原为+2价锰后剩下的-2价氧离子不能满足二氧化硫转化为硫酸根离子的需要。到底是哪种情况,必须进行定量分析。请同学们根据氧化还原反应中得失电子守恒的规律进行分析判断。

【教师引领】分析至此,同学们知道反应物和产物分别有哪些了吗?
【学生分析】很明显,反应物有高锰酸钾、二氧化硫和水。水提供氧离子后剩余氢离子,因此产物有硫酸锰、硫酸钾以及硫酸。
KMnO4+SO2+H2O——MnSO4+K2SO4+H2SO4
(3)【定量分析2】
【教师引领】确定了反应物和生成物以后,就是配平的问题。怎样确定各物质的化学计量数呢?
【学生分析】根据上述分析,若参加反应的高锰酸钾为2摩尔,则参加反应的二氧化硫为5摩尔,参加反应的水为2摩尔;根据质量守恒定律,生成的硫酸锰、硫酸的物质的量分别为2摩尔,硫酸钾的物质的量为1摩尔。

2.方法总结与思维框架构建
(1)密切关注反应介质对反应物、生成物的影响
实际上,氧化还原反应的介质不同,产物也往往不同。教师必须引导学生清醒地认识到这一点。如氧气、过氧化物、高锰酸钾、次氯酸及其盐等含氧氧化剂反应后都会有-2价的氧离子生成,而-2价的氧离子在水溶液中不可能存在,它到底以什么产物存在,就与介质有关:当介质为酸性溶液时,-2价的氧离子与氢离子结合生成水;当介质为中性或碱性时,-2价的氧离子与溶液中的水结合生成氢氧根离子。值得注意的是,当氧化剂中的氢、氧原子个数比为1∶1时(如过氧化氢、次氯酸),则氧化剂自身的氢和氧结合成氢氧根离子;当介质为酸性时,氢氧根与氢离子反应生成水;如,二氧化硫、亚硫酸及其盐等还原剂反应后会有硫酸根离子生成,从二氧化硫、亚硫酸及其盐变成硫酸根离子,显然需要从氧化剂中夺取氧,若氧化剂中无氧或氧不足,那就只能从介质中夺取氧。当介质为中性或酸性时,则由水提供氧,同时还生成氢离子;当介质为碱性时,则由氢氧根离子提供氧,同时还生成水(氢氧根可以认为是水合氧离子)。
现将相对较难判断的常见氧化(还原)剂在不同介质中的还原(氧化)产物列于下表中。

常见氧化(还原)剂在不同介质中的还原(氧化)产物
(2)始终坚持定性分析与定量判断相结合
氧化还原反应产物以及反应物的判断,要利用氧化还原反应的基本规律,从定性或定性与定量相结合的角度加以分析;氧化还原反应方程式的配平,要利用反应中的守恒规律(得失电子守恒、质量守恒),从定量的角度加以分析。使学生从定性与定量的角度认识化学反应的本质。
三、结语


