运动性心房损伤和纤维化发生过程中基质金属蛋白酶及其抑制剂表达变化
王世强 常芸 李丹 何艳群 饶志坚
1湖南工业大学体育学院(湖南株洲 412008)
2国家体育总局体育科学研究所(北京 100061)
运动性心律失常是体育科学和运动医学备受关注的问题。心房纤颤是最常见的运动性心律失常,制约了运动员比赛成绩的提高,影响运动员的身体健康和生命安全[1]。研究证实,运动性心房纤颤的发生与运动的剧烈程度以及累积时间有关[2]。最新研究表明,长期反复大强度运动导致心房纤维化发生,可能是运动性心房纤颤的主要病理改变[3]。本课题组前期研究也证实了16周大强度跑台运动造成大鼠心房损伤,胶原蛋白过度增加、Ⅰ和Ⅲ型胶原比例失调,最终导致心房纤维化的发生[4]。然而,运动性心房损伤和纤维化的发生机制尚不清楚,需要进一步研究。
基质金属蛋白酶-1(matrix metalloproteinase,MMP-1)能够降解心肌间质中胶原蛋白,是调节胶原蛋白降解过程的关键酶。基质金属蛋白酶抑制剂-1(matrix metalloproteinase tissue inhibitor-1,TIMP-1)是MMP-1的特异性抑制剂,能与MMP-1特异性结合,抑制其活性。MMP-1/TIMP-1的比例失调是造成心肌胶原蛋白重塑、心房发生纤维化的重要原因。以往研究证实,在容量负荷过载[5]、心肌梗死[6]和高血压[7]等因素诱导的心肌肥厚发病过程中,均发现MMP-1/TIMP-1的比例失调。本课题组前期研究曾发现,在长期大强度运动导致的右心室损伤和纤维化发生过程中,MMP-1/TIMP-1具有重要调节作用[8,9]。而长期大强度运动导致的心房损伤和纤维化发生过程中,MMP-1/TIMP-1的变化规律如何尚不清楚。因此,本研究通过观察长期大强度运动对大鼠心房MMP-1和TIMP-1的影响,探讨运动性心房纤维化的发生机制,为筛选安全有效的预防和治疗运动性心房纤颤的有效治疗靶点和干预措施提供科学依据。
1 材料与方法
1.1 实验对象
8周龄SPF级SD大鼠购置于北京维通利华实验动物技术有限公司,在国家体育总局体育科学研究所ABSL-3级实验动物房饲养,普通啮齿类动物饲料喂养,恒温恒湿,每天光照12小时。
1.2 动物分组与运动方案
经过1周的适应性跑台训练(15 m/min,每天15 min)后,将48只SD大鼠随机分为安静对照组和大强度运动组,每组24只。每组又分为8周组、12周组和16周组。安静组在笼内给予普通饲料喂养,大强度运动组分别进行8周、12周和16周的运动。大强度运动组先以15 m/min的速度运动5 min,随后在5分钟内达到28 m/min,坡度为10°(相当于81.0% ±3.5%VO2max的负荷强度)的运动强度。运动强度方案参照Bedford研究[10]。每周运动5天,每天1小时。
1.3 取材
8周、12周和16周运动结束后第二天,分别对安静组和大强度运动组的大鼠腹腔注射水合氯醛麻醉后摘心脏,分离出右心房,每份心房组织分为两份,经液氮速冻后存于-80℃超低温冰箱,一份用于RT-PCR检测,一份用于Western Blot检测。
1.4 荧光定量PCRPCR检测mRNAmRNA的表达
取右心房放入液氮预冷的研钵中,研磨成粉末后加入Trizol裂解,加入氯仿抽提,离心后加入氯丙醇,再次离心后经75%的酒精洗涤,离心后晾干加入去离子水,测量RNA的浓度和纯度。每个样本按0.5 μg总RNA 10 μl的反应体系,采用cDNA反转试剂盒(RR370A,购于Takara生物公司)反转成cDNA后,-20℃保存。以合成的cDNA为模板,加入上下游引物,采用试剂盒(RR820A,购于Takara生物公司)在ABI7300荧光定量检测系统进行检测。反应条件为:预变性95℃ 30 s,PCR反应95℃ 5 s,60℃ 31 s,40个循环。数据导出后,用Excel分析处理,通过2-△△CT公式计算样本中mRNA的相对含量,其中△△CT=(CT实验组目的基因-CT实验组内参基因)-(CT对照组目的基因-CT对照组内参基因)。计算MMP-1/TIMP-1的比值时,TIMP-1作为内参基因进行计算。所有引物均通过经GeneBank数据库查询设计,由上海生工生物有限公司合成。引物序列如下:
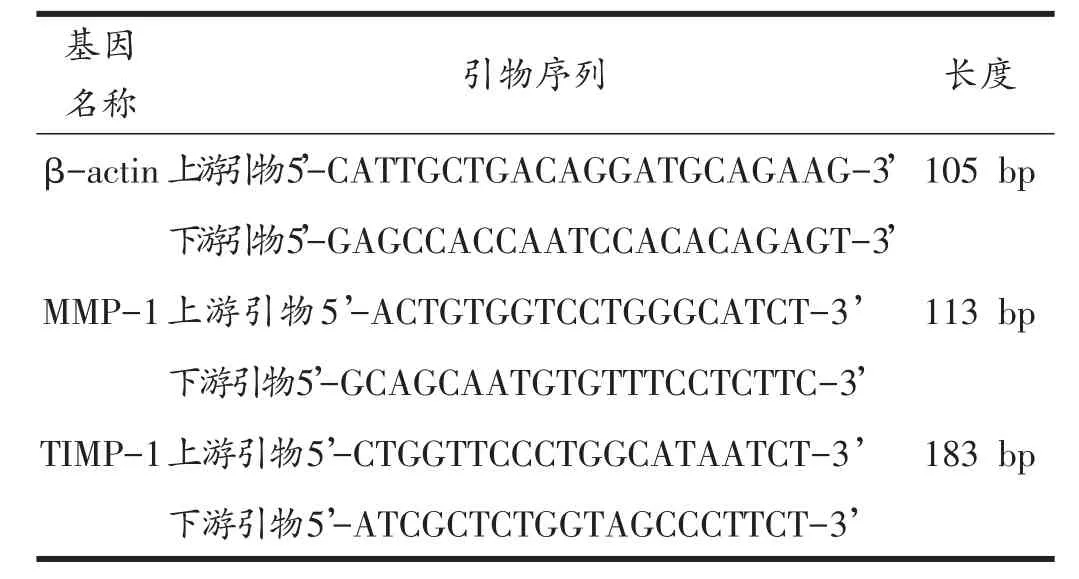
表1 Real-time PCR基因引物序列
1.5 Western Bern Blotlot检测蛋白的表达
右心房经液氮研磨后,加入蛋白裂解液(RIPA,碧云天)和蛋白酶抑制剂(PMSF,碧云天)。离心后采用BCA法测其浓度,通过加入不同量的去离子水使所有样本蛋白总量一致,按5∶1加入上样缓冲液(碧云天),最终使总蛋白浓度为4 μg/μl。水浴锅内沸腾水煮10 min使蛋白变性。采用浓度为10%的SDS-PAGE下层胶进行分离电泳,120V恒压电泳1.5小时,200 mA恒流湿转1小时。脱脂奶粉封闭PVDF膜(美国Millipore)1小时,加入一级抗体(β-actin 浓度为1∶5000;MMP-1浓度为1∶500,美国SantaCruz公司;TIMP-1浓度为1∶1000,美国Abcam公司)。二级抗体(1∶5000,美国Abcam)4℃摇床过夜。PBST洗膜后,加入发光液(美国Millipore),放入暗匣,在暗室内X光片曝光数十秒。显影数秒,定影液定影。条带在Quantiy One软件下分析。计算目的蛋白条带和内参条带灰度值的比值,通过MMP-1和TIMP-1的条带灰度值计算MMP-1/TIMP-1蛋白比例。
1.6 数据采集与统计学处理
所得数据用 GraghPad Prism 6.0软件转换作图。所有数据均用SPSS18.0进行分析处理,结果采用平均数±标准差表示,采用双因素方差分析组间差异。显著性差异选择P<0.05或P<0.01水平。
2 实验结果
2.1 大鼠心房MMP-MMP-1 1基因和蛋白的表达
如图1所示,与安静组相比,8周大强度运动组MMP-1 mRNA的表达显著增加(P<0.05),12周大强度运动组MMP-1 mRNA的表达具有增加趋势,16周大强度运动组MMP-1 mRNA的表达具有降低趋势,但无显著性差异。比较不同时间点的表达发现,随着运动时间的延长,MMP-1 mRNA的表达逐渐降低,16周大强度运动组显著低于8周大强度运动组(P<0.05)。
与基因的表达趋势一致,MMP-1蛋白的表达如图2所示。8周大强度运动组MMP-1蛋白的表达显著高于安静组(P<0.05);12周大强度运动组MMP-1蛋白的表达略有增加,而16周组略有降低,但均无显著性差异。
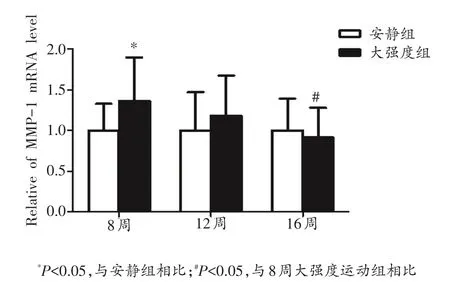
图1 各组大鼠心肌MMP-1 mRNA的表达
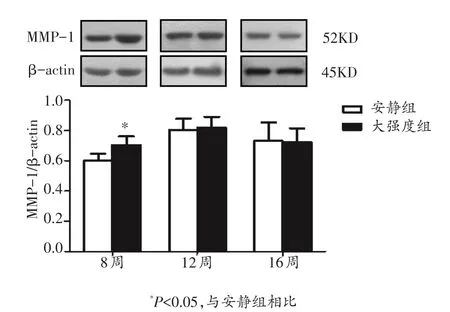
图2 各组大鼠心肌MMP-1蛋白的表达
2.2 大鼠心房TIMP-TIMP-1 1基因和蛋白的表达
如图3所示,与安静组相比,8周大强度运动组TIMP-1 mRNA的表达略有增加,但无显著性差异;12周和16周大强度运动组TIMP-1 mRNA的表达均显著增加(P<0.01、P<0.05)。比较不同时间点的表达发现,随着运动时间的延长,TIMP-1 mRNA的表达逐渐增加,16周大强度运动组TIMP-1的表达显著高于8周大强度运动组(P<0.05)。
与基因的表达趋势一致,TIMP-1蛋白的表达如图4所示。与安静组相比,8周大强度运动组TIMP-1蛋白的表达略有增加,但无明显差异,12周和16周大强度运动组TIMP-1蛋白的表达均显著增加(P<0.05)。

图3 各组大鼠心肌TIMP-1 mRNA的表达

图4 各组大鼠心肌TIMP-1蛋白的表达
2.3 大鼠心房MMP-MMP-1 1/TIMP-TIMP-1 1比值的变化
通过计算得出,MMP-1和TIMP-1 mRNA的比值如图5所示。与安静组相比,8周大强度运动组比值略有增加,12周大强度运动组比值略有降低,但均无显著性差异。16周大强度运动组MMP-1/TIMP-1 mRNA的比值则显著小于安静组(P<0.05)。不同时间点之间进行比较发现,随着运动时间的延长,MMP-1/TIMP-1 mRNA的比值逐渐降低,16周大强度运动组显著低于8周大强度运动组(P<0.05)。
MMP-1和TIMP-1蛋白的比值如图6所示。与安静组相比,8周大强度运动组比值略有增加,12和16周大强度运动组比值降低,但均无显著性差异。
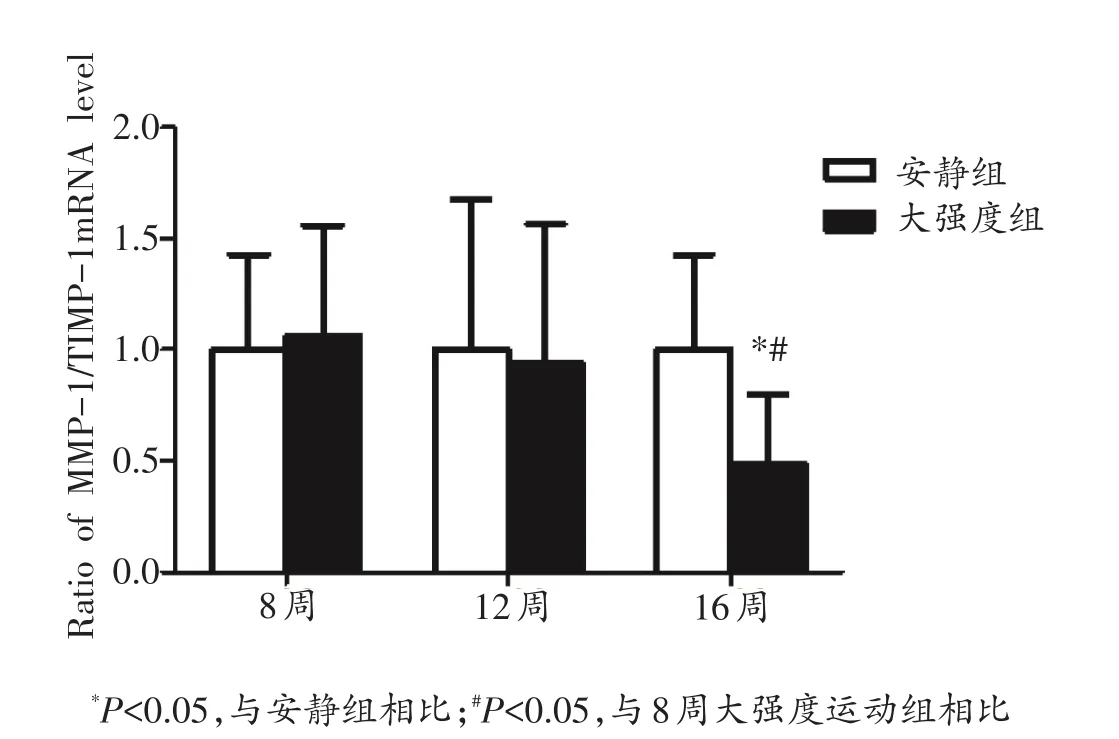
图5 MMP-1和TIMP-1 mRNA的比值变化

图6 MMP-1和TIMP-1蛋白的比值变化
3 讨论
前期研究发现,16周大强度运动导致大鼠心房损伤和纤维化[4,9]。然而,其发生机制尚不清楚。心房纤维化是指细胞外基质过度增加的现象。胶原蛋白的过度增加会影响心肌舒缩性能和心肌细胞间的电传导,导致传导阻滞,诱发心律失常,可能是运动性心律失常发生的重要病理基础[11]。作为调节细胞外基质降解过程的主要酶系,基质金属蛋白酶及其抑制剂在心房纤维化的发生过程中具有重要调控作用。前期研究结果也证实了基质金属蛋白酶及其抑制剂在长期大强度运动诱导的右心室损伤和纤维化过程中的重要作用[8]。然而,在运动性心房损伤和纤维化发生过程中作用如何尚不清楚。因此,本研究观察了MMP-1及其抑制剂TIMP-1在运动性心房损伤和纤维化过程中的变化规律。
本研究结果表明,8周的大强度运动使大鼠心房MMP-1 mRNA和蛋白的表达均增加。与本研究结果一致,Goetzenich等发现在心肌症发生过程中,MMP-1的转录显著增加[12]。而与此结果相反,Dong等研究表明,在血管紧张素诱导的心肌纤维化模型中,MMP-1的表达显著降低[13]。本研究还发现12周和16周大强度运动后,心房MMP-1 mRNA和蛋白的表达均略低于安静组。对比8周、12周和16周大强度运动组MMP-1的mRNA的变化,发现随着大强度运动时间的延长,MMP-1的表达逐渐降低,16周大强度运动组MMP-1的表达显著低于8周大强度运动组。与本研究一致,Gonzá lez等研究发现,心脏衰竭但射血分数正常的高血压病人I型胶原蛋白合成增加并致心肌纤维化的发生,但MMP-1的变化不明显[14]。也有研究显示,在阿霉素诱导的心肌症和心肌纤维化过程中,MMP-1呈现高表达[12]。而Dong等研究证实,在血管紧张素诱导的心肌纤维化过程中,MMP-1的表达显著降低。MMP-1的表达变化趋势不一致,这可能由于MMP-1的表达于纤维化的发生进程有关。有研究认为,在心肌纤维化初期,MMP-1的变化升高或者不变,而后期随着纤维化的发展,MMP-1的表达逐渐降低[15]。因此,本研究中MMP-1的表达先增加,而后逐渐降低,呈现出先增加后降低的趋势,可能是由于运动性心房损伤和纤维化的不同阶段造成的。
TIMP-1可通过抑制MMP-1的活性,抑制胶原蛋白的降解,促进纤维化的形成。有研究指出,血浆中TIMP-1的含量对和心肌功能指标显著相关,TIMP-1的表达作为胶原合成代谢的生物标志物,可作为心脏疾病患者检测是否发生心肌纤维化的有效的外周检测标志物[16,17]。本研究发现,8周运动后,大强度运动组TIMP-1 mRNA和蛋白的表达均有增高趋势,但无显著性差异。12周和16周运动后,大强度运动组TIMP-1 mRNA和蛋白的表达均显著高于安静组。与本研究结果一致,Lindsay在耐力运动员血浆中发现,胶原合成标志物PICP和TIMP-1的表达显著高于正常对照组[18]。Olah等研究证实,急性力竭运动后,大鼠心肌TIMP-1 mRNA的表达显著升高,可能介导了力竭运动导致的细胞外基质重塑的过程[19]。在众多疾病诱导的心肌纤维化过程中,TIMP-1的表达明显增加。有研究证实,慢性压力负荷过载的病人心脏心肌纤维化和心脏舒张功能障碍和TIMP-1的持续高表达显著相关[20]。在高血压诱导的心肌纤维化发生过程中,TIMP-1的表达显著增加,与心肌射血功能下降关系密切[21]。在钙调磷酸酶诱导的心肌纤维化发生过程中,Ⅰ型、Ⅲ型胶原显著增加伴随TIMP-1的持续高表达[22]。
8周、12周和16周大强度运动组之间进行比较,结果发现随着运动时间的延长,大强度运动组TIMP-1 mRNA呈现出逐渐增加的变化趋势,16周大强度运动组TIMP-1的表达显著高于8周大强度运动组。有研究显示,TIMP-1的表达随着疾病的进展表现出逐渐增高的态势[23-25],与本研究一致。Rullman等[25]则发现每次45分钟、每周4次、持续5周的大强度运动后,人股外侧肌TIMP-1的含量升高,且具有逐渐增加的趋势,一直持续到结束后第10天。Sangaralingham等[23]则发现,增龄诱导的心肌纤维化发生过程中,TIMP-1的表达逐渐增加,呈现时间依赖性。Kram等[24]研究也显示,高血压诱导的心肌纤维化发生过程中,大鼠血浆中TIMP-1的浓度表现出逐渐增加的趋势。因此推测,本研究中发现的长期大强度运动导致大鼠心房TIMP-1持续高表达,抑制了MMP-1的活性,造成Ⅰ型、Ⅲ型胶原蛋白的降解受到抑制,引起心肌细胞外胶原蛋白的大量堆积,最终导致心肌纤维化的发生。
TIMP-1的表达受炎症因子的调控。肥厚性心肌病人炎症的持续存在是诱发心肌纤维化发生的重要因素[26]。有研究显示,炎性细胞受到刺激后分泌释放大量TGF-β1、TNF-α、IL-1β和IL-1等炎症因子,可诱导心肌细胞或者心肌中的成纤维细胞分泌TIMP-1[27]。通过药物抑制TNF-α的表达,可降低心肌缺血大鼠心肌中TIMP-1的表达,有效降低心肌纤维化的程度[28]。研究发现,人体内单核细胞通过分泌释放TGF-β1因子,增加了心肌组织中成肌纤维细胞的活性,使细胞外基质重构[29]。Ikonomidi等[21]发现,在高血压诱导的心肌纤维化发生过程中,TGF-β1和TIMP-1等胶原合成标志物均呈高表达表征。Park等[30]研究证实,主动脉狭窄病人TIMP-1和IL-1β的含量呈正相关。人体研究证实,大强度耐力运动后促炎因子表达显著上升伴随心肌功能下降[31]。长期大强度运动或反复力竭运动可诱导心肌TGF-β1、TNF-α、IL-1β等炎症因子的表达,这可能会进一步诱导TIMP-1因子的表达,参与心肌纤维化的发生和发展[32,33]。而通过外源性抑制剂抑制TNF-α表达,可有效缓解大强度运动造成的小鼠心房纤维化的程度,降低心房纤颤的易感性[3]。因此可以推测,TIMP-1的高表达可能与长期高强度运动引起的体内TNF-α、IL-1β等炎性因子的增高有关。
计算MMP-1/TIMP-1的比值,结果发现,16周大强度运动后,心房MMP-1/TIMP-1 mRNA和蛋白的比值均显著小于安静对照组。与本研究一致,Huerta等研究老年高血压病人群发现,心脏衰竭但是射血分数正常的病人血液中Ⅰ型胶原蛋白的合成标志物和TMP-1的含量呈正相关,与MMP-1的变化关系不明显,与MMP-1/TIMP-1的比值呈负相关[34]。研究表明,在糖尿病和慢性压力负荷过载的大鼠心肌细胞外基质增多,具有明显的心肌纤维化,心肌舒张功能异常,可能与MMP-1/TIMP-1的比值显著降低有关[35]。在主动脉狭窄诱导的大鼠心肌纤维化模型中,TIMP-1的表达显著升高,MMP-1/TIMP-1的比值显著降低[36]。心肌梗死后大鼠心肌重塑和纤维化发生的过程中,MMP-1的表达无显著差异,TIMP-1的表达显著增加,MMP-1/TIMP-1的比值显著下降。运动降低了TIMP-1的表达,使MMP-1/TIMP-1增加,MMPs和TIMPs趋于平衡,缓解了心肌纤维化,改善了心脏功能[37]。
综上,本研究发现长期大强度运动导致大鼠心房MMP-1的表达先增高后降低,TIMP-1的表达逐渐增加,MMP-1/TIMP-1的比值显著降低,MMP-1和TIMP-1比例失调,可能是运动性心房损伤和纤维化发生的分子机制。
4 结论
长期大强度运导致大鼠心房MMP-1的表达先增高后降低,而TIMP-1的表达逐渐增加,MMP-1/TIMP-1的比例失调,可能是运动性心房损伤和纤维化发生的分子病理机制。

