2型糖尿病患者血清铁蛋白与周围血管病变的关系
张琳琪
大血管病变是2型糖尿病(T2DM)患者慢性并发症中的一种,其病理基础是动脉粥样硬化(atherosclerosis,AS),可致冠状动脉粥样硬化性心脏病、脑卒中和糖尿病足等大血管事件。在糖尿病的早期阶段,动脉粥样硬化病变可能已经存在[1]。铁是人体的必须金属元素,1981年Sullivan[2]初次提出“铁假说”,铁通过诱导活化氧自由基的生成,参与低密度脂蛋白胆固醇(LDL-C)的过氧化,从而与动脉粥样硬化存在相关性。本研究通过观察T2DM患者SF水平变化及颈动脉粥样硬化情况,寻找颈动脉粥样硬化发生的高危因子,探讨是否可将血清SF纳入T2DM周围血管病变的预测指标。
1 材料与方法
1.1研究对象 选择2017年1月~2018年1月我科住院T2DM患者88例,男57例,女31例,平均年龄(63.01±13.33)岁。纳入患者均符合1999年WHO糖尿病诊断标准。排除标准:近1年内有铁剂使用史;近6个月有严重出血;感染、血色病、贫血以及肿瘤等;肝肾功能不全;罹患其他内分泌疾病。颈动脉内膜中层厚度的测定采用颈动脉彩超。根据CIMT将患者分为非颈动脉粥样硬化组(NCAS组)22例,CIMT<1.0mm;颈动脉粥样硬化组(CAS组)66例,CIMT≥1.0mm或发生局部斑块。
1.2研究方法
1.2.1一般情况及代谢参数 记录患者的年龄、血压、性别及病程。患者禁食10h,于次日空腹抽取静脉血,测定C反应蛋白(CRP)、血常规、SF、空腹血糖(FPG)、肝肾功能、血脂、尿酸(UA)、糖基化血红蛋白(HbA1c)、C 肽(C-Peptide)及胰岛素(insulin)等。其中SF正常参考值为16.4~293.9ng/ml,SF>293.9ng/ml为升高。留取晨尿行尿微量白蛋白测定。
1.2.2超声测定CIMT 测定方法:患者取平卧位,暴露颈部,头偏向对侧,沿血管长轴方向测定两侧颈总动脉后壁。颈动脉内膜中层厚度是指颈动脉内膜内表面到中层外表面之间的垂直距离。测定部位:在颈总动脉交叉处及前后1cm处,测量3次,注意避开粥样硬化斑块,取3次测定的平均值作为CIMT。
1.3统计学分析 采用SPSS 20.0软件进行统计学分析。定量资料中呈正态分布者以均数±标准差(±s) 表示,组间比较采用独立样本t检验;呈偏态分布者以中位数(四分位间距)[M(P25,P75)]表示,组间比较采用独立样本非参数检验Mann-Whitney U法。定性资料用率(%)表示,组间比较采用卡方检验;采用Logistic回归模型对影响因素进行分析,计算其OR值及95%可信区间。P<0.05表示差异有统计学意义。
2 结果
2.1两组临床资料比较 与NCAS组相比,CAS组年龄大,病程长,甘油三酯、收缩压、尿微量白蛋白、UA和SF水平均显著增高,差异有统计学意义(P<0.05),其他指标两组间无统计学差异(P>0.05),见表1。
2.2血清铁蛋白水平与各指标的关系 T2DM患者血清SF水平与各变量Spearman相关分析显示,SF与总胆固醇、甘油三酯、空腹血糖、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、低密度脂蛋白胆固醇呈正相关(P<0.05),相关性分析见表2。

表1 NCAS组及CAS组患者一般情况比较
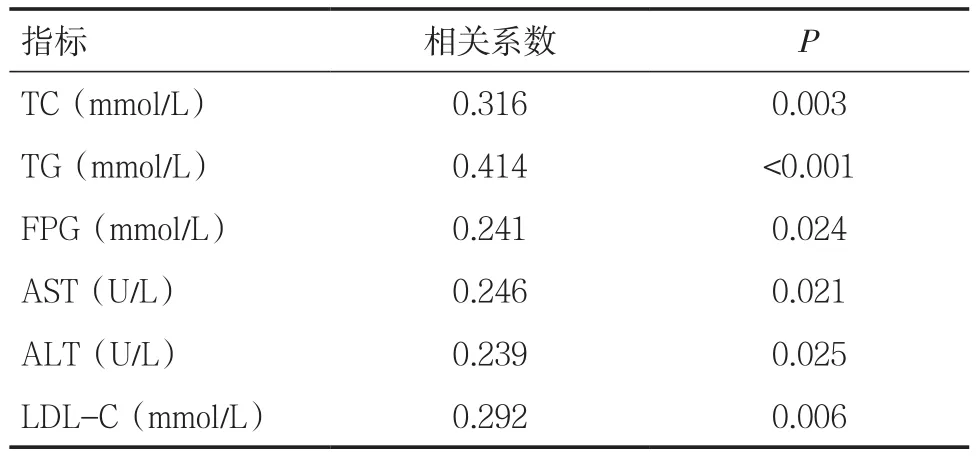
表2 血清SF与各指标之间相关性分析
2.3Logistic回归分析 以年龄、病程、TG、收缩压、SF、尿微量白蛋白和UA为自变量,以是否合并颈动脉粥样硬化为因变量行Logistic回归分析。结果显示,铁蛋白、TG、病程、年龄是合并颈动脉粥样硬化的独立相关因素(P<0.05),SF、TG 水平越高,病程越长,年龄越大,合并颈动脉粥样硬化的概率越大,见表3。

表3 Logistic回归分析
3 讨论
研究显示,与非糖尿病患者相比,T2DM患者合并AS风险明显升高,且早期就可能出现,预后相对较差[3]。颈动脉是T2DM大血管病变的检测窗口,CIMT是无症状动脉硬化无创、有效的检测方法[4]。
SF是人体中铁储存的主要形式,SF水平相对平稳,能够客观地体现人体中铁储存的状态。近年研究表明,体内铁代谢紊乱(主要为铁过多引起的铁超负荷)与糖代谢、脂代谢异常、血管内皮功能障碍和AS等关系密切[5]。本研究中CAS组患者血清SF水平显著高于NCAS组,推测血清SF水平上升可能与T2DM患者颈动脉粥样硬化相关。进一步分析发现,T2DM患者血清SF水平与FPG、ALT、AST、TG、TC和LDL-C呈正相关。短期血糖水平增高可能会使动脉管壁中过氧化物增多,诱导铁代谢失调,而长期高血糖使2型糖尿病患者体内氧化应激及脂质过氧化增加。目前认为,血脂异常是导致AS的首要危险因素。脂质在局部集聚致斑块形成,是一种慢性炎症的演变过程,最终可诱发动脉粥样硬化斑块破裂、血栓形成。有研究认为,铁诱导的受损能够削弱T2DM患者胰岛β细胞自身的储备功能,增加血糖控制难度,加重T2DM及其并发症[6]。铁储备过高导致糖代谢紊乱,从而影响患者的脂质代谢,提示T2DM患者血清SF水平升高可能通过糖脂代谢紊乱加速AS的发生和发展。
Logistic回归分析显示,铁蛋白、TG、病程、年龄是T2DM合并CAS的高危因素。年龄越大、T2DM病程越长,CAS的发生率越高,本研究所得结论与既往文献相符[7,8]。同时,血清SF水平升高与2型糖尿病患者CAS发生关系密切。体内铁储存过多引起AS的可能机制包括:过量铁进入细胞,在内皮细胞、平滑肌细胞、淋巴细胞及巨噬细胞内,经铁催化的Haber-Weiss反应,诱导LDL-C氧化,氧化的LDL-C被组织巨噬细胞上的清道夫受体识别、吞噬,泡沫细胞形成,出现最早的粥样硬化病变脂质条纹。另外,氧化后的LDL-C可以趋化白细胞,同时减少巨噬细胞释放出血管壁,诱导血管内皮受损,刺激血管平滑肌细胞增殖[9],且铁超负荷引起的氧化应激,因损害氧化亚氮介导的内皮舒张机制,削弱了血管内皮依赖性舒张功能[10~12],促进AS进展。另外,Pratico等[13]发现血清SF能够活化血小板,促血小板聚集,使AS的进展加快。Li等[14]研究显示,在动脉粥样硬化斑块内,转铁蛋白受体1的表达与铁蛋白累积和巨噬细胞浸润有关,进而诱导动脉粥样硬化的形成甚至斑块破裂。本研究未提示FPG、HbA1c、TC、LDL-C是CAS的独立危险因素,与既往研究结果不一致,可能由于本研究样本量较小,且入选患者均为住院患者,大多存在近期血糖控制不佳,而CAS的形成是一个缓慢的过程,两者存在病情的不平行之处。高血脂是致CAS的危险因素,在本研究中CAS组患者TG水平显著高于NCAS组,与CAS密切相关,而TC、LDL-C两组间无统计学差异,可能与T2DM患者大多合并血脂紊乱,且相较于贝特类药物,较多地选用了他汀类药物有关。
综上所述,本研究证实了血清铁蛋白与T2DM动脉粥样硬化两者间的相关性。检测SF水平对评估T2DM外周血管粥样硬化有一定临床意义。针对超标者,需限制铁元素的摄入,防止铁过负荷状态加剧,已有研究者提出,通过增加铁的消耗,可预防大血管病变的发生[8]。但对于以上两者间的相关性,目前仅止于临床观察,尚缺乏进一步的基础研究阐明,如寻找铁和LDL-C彼此作用位点及具有催化活性的铁的来源,为临床治疗提供帮助。

