结直肠锯齿状息肉的临床、内镜及病理特征分析
张珊妍,刘岚,吴洪磊,辛玉,肖娟,朱孔锡,郭建强
(山东大学第二医院 1.消化内科,2.循证医学中心,山东 济南 250033)
结直肠癌(colorectal cancer, CRC)是严重威胁人类健康的消化道恶性肿瘤之一,发病率位居世界恶性肿瘤的第3位[1]。自1975年MUTO[2]提出经典的“腺瘤-腺癌”途径,腺瘤曾被认为是唯一具有恶变潜能的息肉类型。但近二十年的研究发现,除腺瘤外,锯齿状息肉(serrated polyp, SP)也具有癌变倾向,约20%~35%的CRC通过“增生性息肉→锯齿状腺瘤→锯齿状腺癌”这一锯齿状途径发展而来的[3]。SP是一组隐窝上皮存在锯齿状形态结构,具有异质性的病变,包括增生性息肉(hyperplastic polyp, HP)、无蒂锯齿状腺瘤/息肉(sessile serrated adenoma/polyp, SSA/P)和传统锯齿状腺瘤(traditional serrated adenoma, TSA)[4]。相比于HP,TSA和SSA/P更具有向恶性转化的细胞学特性,尤其是SSA/P[5]。
及时切除结直肠腺瘤可降低CRC的发病率,因此早期发现并切除SSA/P也是一种有效阻断其进展及癌变的重要措施[6]。目前国内对SP报道相对较少,特别在临床实践中对SSA/P的识别缺乏经验。本文旨在探究SP的临床、内镜及病理特征,并对不同亚型的内镜特点进行比较,为临床相关诊疗工作提供参考。
1 资料与方法
1.1 研究对象
选取2013年9月-2016年5月于山东大学第二医院内镜中心行结肠镜检查的患者共7 332例,收集其中诊断为结直肠SP患者的临床、内镜及病理资料。纳入标准:①年龄≥18岁;②无任何与遗传相关的胃肠道息肉综合征;③无CRC或炎性肠病病史;④肠道准备良好,不影响结肠黏膜的观察;⑤结肠镜达到回盲部;⑥结肠镜检查资料完整、准确。
1.2 检查仪器和方法
标准单人结肠镜操作法,采用CF-H260AI、CFQ260AI及GIF-H260 电子结肠镜(日本奥林巴斯公司)。活检标本经10%甲醛固定,石蜡包埋,常规HE染色,显微镜下观察。所有标本由2位有经验的病理医师会诊后确定病理诊断,病理诊断依据2010年最新的WHO标准[7]。
1.3 相关定义
SP的检出率定义为进行结肠镜检查的所有患者中,至少发现一个组织病理学证实为SP的患者数所占的比例[8]。息肉的所在部位以脾曲为界分为近端结肠(盲肠、升结肠、肝曲、横结肠及脾曲)和远端结肠(降结肠、乙状结肠及直肠)。息肉的大小根据活检钳张开口径大小(5 mm)或通过测量切除标本最大直径来衡量。息肉的形态根据巴黎分型(Paris classification)[9]进行分类,浅表型病变中直径>10 mm的称为侧向发育型肿瘤(LST)。符合以下标准之一的腺瘤称为高危腺瘤:直径≥10 mm,伴有高级别上皮内瘤变,绒毛状腺瘤[10]。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,正态分布的计量资料以均数±标准差(±s)表示,偏态分布的计量资料以M(P25,P75)表示,计数资料组间比较采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 一般临床结果
SP患者共232例,在同期结肠镜中的检出率为3.2%(232/7 332)。232例SP患者,男性153例,女性79例;年龄18~86岁,平均(52.38±12.67)岁;不同年龄性别差异无统计学意义(χ2=2.75,P=0.432)(见表1)。单发型214例(92.2%),多发型(发现2枚及以上SP)18例(7.8%)。SP患者中,HP患者154例,平均(52.21±12.91)岁,SSA/P患者77例,平均(52.83±12.29)岁,TSA患者1例。HP与SSA/P患者年龄及性别差异无统计学意义(χ2=1.69和0.62,P=0.640和0.433)(见表2)。
2.2 内镜特征
232例SP患者中共检出251枚SPs,HP、SSA/P和TSA分别为165枚(65.7%)、85枚(33.9%)和1枚(0.4%)。85枚SSA/P中,伴和未伴细胞异型增生型分别为66枚(77.6%)和19枚(22.4%)。
2.2.1 HP和SSA/P的内镜特征及比较 HP多位于远端结肠(72.7% vs 27.3%),直径≤5 mm(94.6%vs 5.4%),浅表型多见(90.9% vs 9.1%)。SSA/P多位于近端结肠(51.8% vs 48.2%),直径≤5 mm(64.7%vs 35.3%),隆起型多见(60.0% vs 40.0%)(见图1)。HP和SSA/P在息肉分布部位、形态及大小方面的差异均有统计学意义(χ2=14.68、74.83和37.98,均P=0.000) (见表3)。按照息肉的大小及所在部位分组,HP和SSA/P在每组所占的比例见图2。
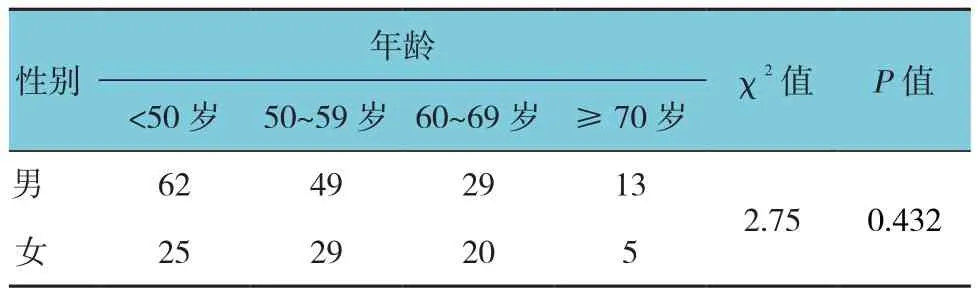
表1 SP患者年龄与性别的关系 例
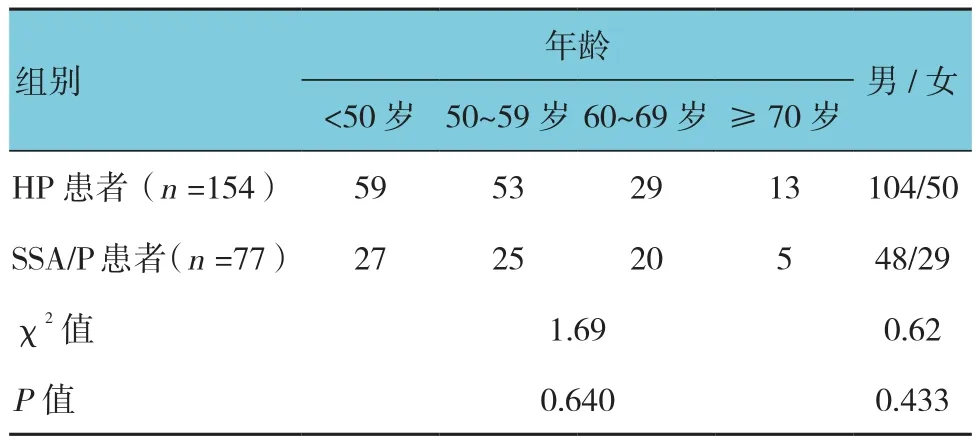
表2 HP和SSA/P患者人口学特征的比较 例
2.2.2 伴和未伴细胞异型增生型SSA/P的内镜特征及比较 伴细胞异型增生型SSA/P多位于近端(51.5% vs 48.5%),直径≤5 mm(68.2% vs 31.8%),隆起型多见(53.0% vs 47.0%)。未伴细胞异型增生型SSA/P多位于近端(52.6% vs 47.4%),直径≤5 mm(52.6% vs 47.4%),隆起型多见(84.2% vs 15.8%)。伴和未伴细胞异型增生型SSA/P在息肉形态方面的差异有统计学意义(χ2=5.98,P=0.015),而息肉部位及大小差异无统计学意义(χ2=0.07和1.56,P=0.932和0.211),见表4。
2.3 伴与未伴高危腺瘤的SP患者临床病理特征
232例SP患者中,伴有高危腺瘤的5例,平均年龄(64.8±11.03)岁,未伴有高危腺瘤的227例,平均年龄(52.11±12.58)岁。SP患者中高危腺瘤与直径≥10 mm的SSA/P之间有相关性(P=0.019),与直径≥10 mm的HP(P=1.000)及位于近端的SSA/P和HP之间均无相关性(P=0.215和1.000),见表5。
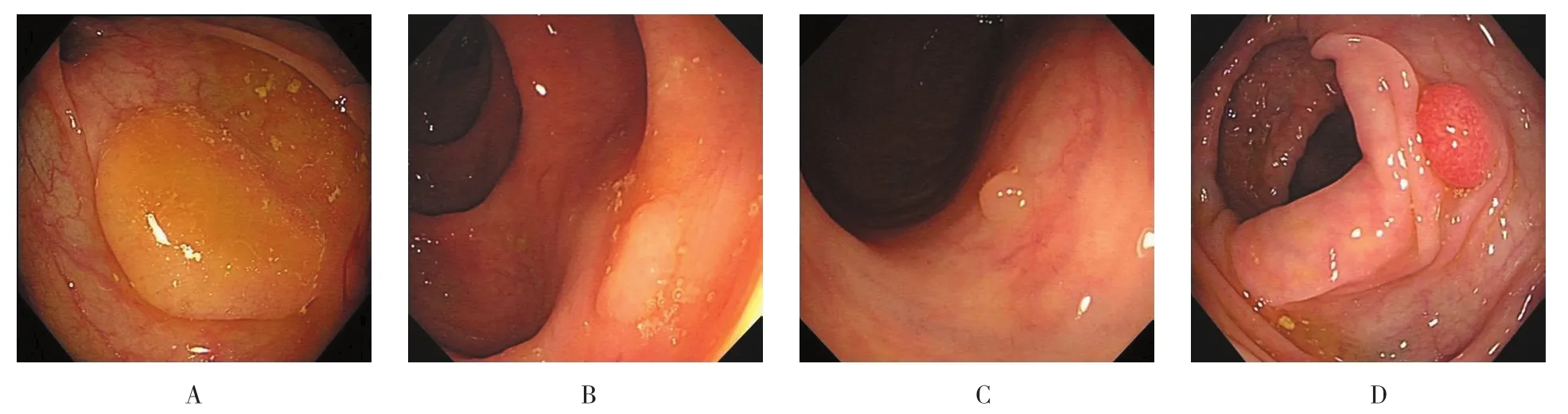
图1 结直肠SSA/P及HP内镜下形态
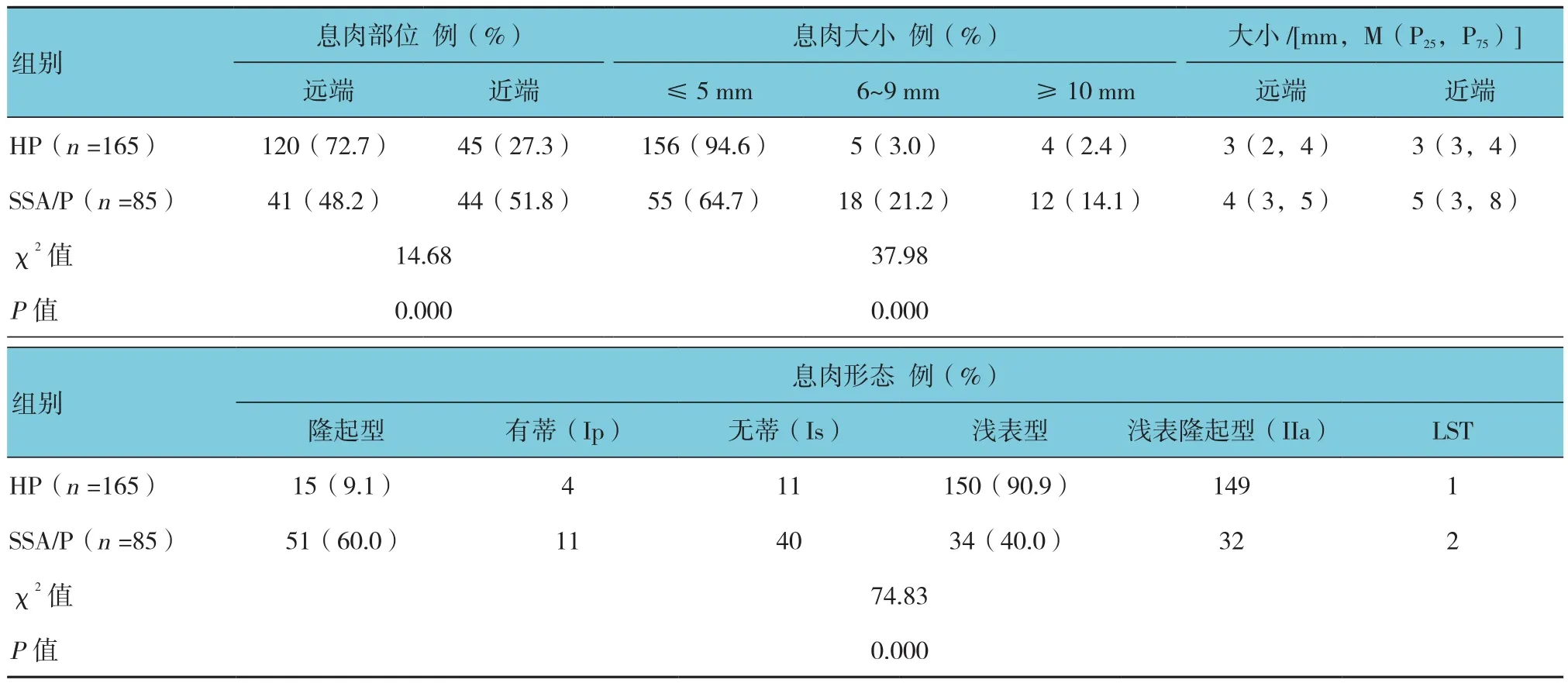
表3 HP和SSA/P内镜特征的比较
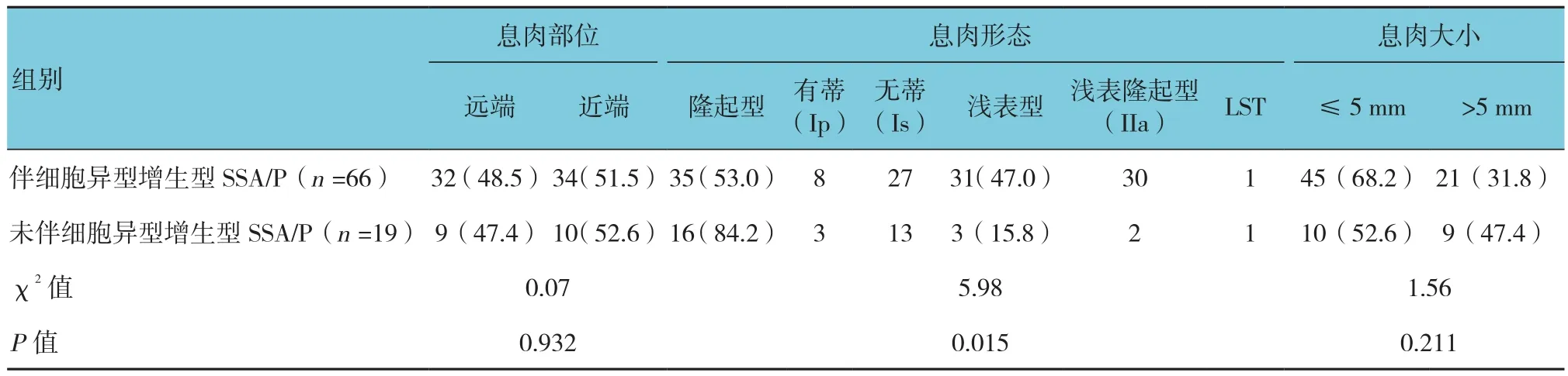
表4 伴和未伴细胞异型增生型SSA/P内镜特征的比较 例(%)
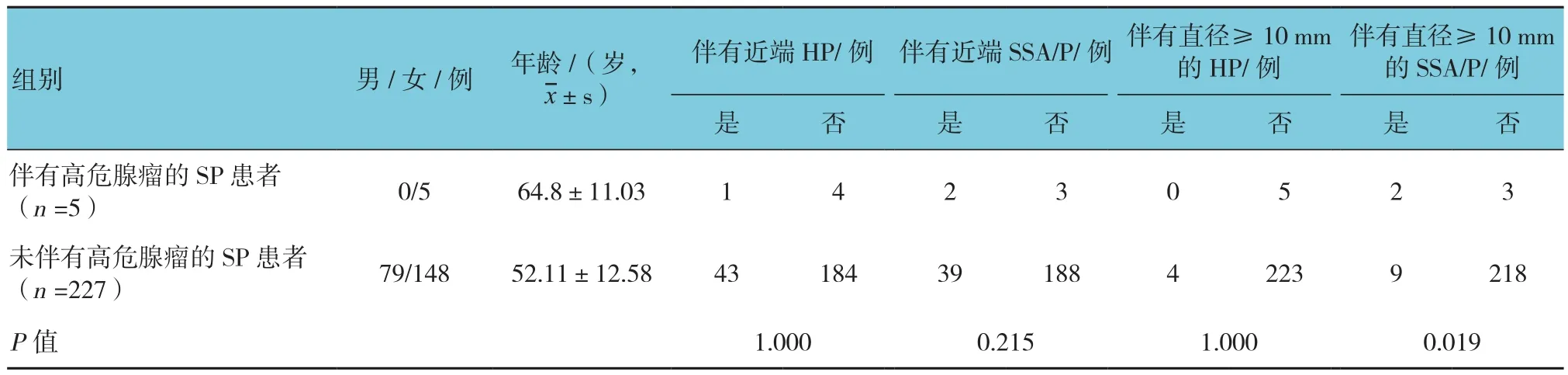
表5 伴与未伴高危腺瘤的SP患者的临床病理特征
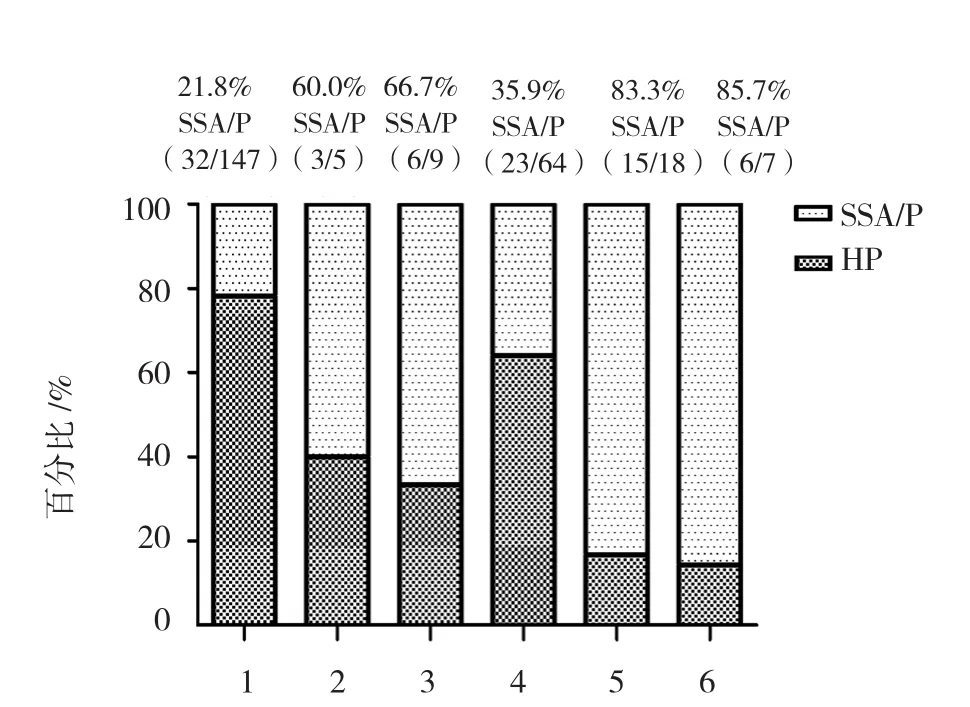
图2 HP和SSA/P根据息肉大小及部位分组所占比例
3 讨论
过去,结直肠息肉常分为肿瘤性(腺瘤)及非肿瘤性两大类。同时因为腺瘤常伴异型增生,人们普遍认为其是CRC的癌前病变[11]。现如今伴随内镜技术的发展、分子遗传学技术的进步及病理学诊断标准的改变,SP在CRC发病中的重要性得到了越来越多的重视。不同于经典途径,SP是通过锯齿状途径发展为CRC,其发生过程主要涉及CpG岛甲基化、微卫星不稳定性、BRAF及KRAS基因突变等分子机制[5]。不同亚型的SP具有其独特的分子特征,SSA/P具有更高的CIMP及MSI表达,被认为是间期CRC癌前病变的重要组成部分。因此,充分了解该类病变的内镜特点,有助于进一步提高其检出率,而及时完全切除具有高风险的SSA/P,对预防CRC的发生有着重要的意义[12]。
本研究中SP的检出率为3.2%,高于国内0.5%~2.1%的检出率,却远低于国外14.0%~27.2%的检出率[8,10,13-17]。IJSPEERT[8]的最新研究评估并比较来自5个欧洲国家的队列研究,发现SSA/P的检出率在2.2%~4.8%之间,高于本研究1.1%(77/7 332)的检出率。由于国外相关文献多为多中心前瞻性研究,而本研究为单中心回顾性研究,数据量及数据的完整性都不及前者,所以检出率偏低。此外,国外对SP研究开展较早,内镜及病理医师对其识别能力及诊断水平远高于国内,虽然国内近几年开始重视SP,但内镜及病理医师水平的提高仍需要时间,这也是检出率偏低的原因。另有证据表明西方的饮食习惯能够增加左半结肠高危SP的发病风险,这说明不同的饮食习惯也可能造成检出率不同[18]。
本研究中,SP的分布由高比例的HP、SSA/P和低比例的TSA构成,与国外大多文献报道一致[10,15]。国内学者CAO[17]的回顾性研究得出SP的分布由高比例的TSA(51.6%)和相对低比例的HP(41.2%)、SSA/P(7.2%)构成,这一结果与本研究存在差异,其可能原因在于病理诊断标准的不同。本研究中病理的诊断是由两名病理医师共同完成,依据为2010版最新WHO诊断标准,而前者的研究是将疑似SP的病理切片进行重新评估,并由一位病理医师进行诊断分型。仅根据一位病理医师的诊断就进行确诊,主观性太强,并且忽略了病理医师间对SP及不同亚型识别能力的差异,这可能会造成一定偏倚。
就HP的内镜特点而言,相关文献报道基本一致,即HP体积较小,直径常≤5 mm,一般位于远端结肠,以乙状结肠和直肠多见,形态上浅表型多见,本研究符合以上结论。而SSA/P的内镜特点,目前大多学者仅对其分布及形态上的特点达成一致观点,即多位于近端结肠,形态上以无蒂和浅表型多见,对其体积上的特点尚未达成共识[13,19-22]。本研究认为相比于HP,SSA/P体积较大,但其大小不均,以体积小者居多,这一观点与HAZEWINKEL[20]和BUDA[21]的研究结果相近,不同于 ROTONDANO[13]和国内学者魏振军[22]的研究。ROTONDANO的研究并未具体区分SSA/P和TSA,而是将其作为一个整体即锯齿状腺瘤(serrated adenoma, SA)来进行研究,不能完全代表SSA/P的特点,同时样本检出量小,仅33枚SA,代表性不足。而魏振军收集的资料时间跨度长(2009.01-2015.01),其中经历了2010年前后SP及不同亚型病理诊断标准的改变,可能对SSA/P的检出造成一定影响。由于早期国内对SP的认识缺乏了解,内镜及病理医师更容易检出体积偏大或者伴有异型增生等具有镜下易识别特点的SSA/P,也会对其体积特点的研究造成一定偏倚。普通白光内镜下HP和SSA/P IIa型均多见,因此单纯从息肉形态上区分HP和SSA/P比较困难,但结合息肉大小及所在部位则有助于上述诊断[23]。位于近端结肠直径>5mm的SP中,大约有50%的可能为SSA/P[20]。而本研究发现在近端直径6~9 mm与≥10 mm组,SSA/P的比例均超过80%。另外,本研究发现,在近端直径1~5 mm组,SSA/P的比例高达35.9%,这提示内镜医师在行肠镜检查时应尽量达到回盲部,缓慢退镜、充分冲洗并仔细观察,若在近端结肠发现小息肉需重视,警惕SSA/P的可能,不能因为病变微小而不予处理。
区分SSA/P的意义在于其具有高恶性潜能,尤其伴细胞异型增生型SSA/P进展为癌的速度相对较快[16]。在本研究中,伴和未伴细胞异型增生型SSA/P分别占77.6%和22.4%,前者比例高于后者。两者内镜特点相近,均多位于近端结肠,直径常≤5 mm,但前者IIa型多见,后者Is型多见。由于目前对SSA/P不同分型的相关研究不多,两种分型的内镜特点及其占比构成,尚未得出统一结论[24-25]。鉴于本研究检出的SSA/P数量有限,仍需要扩大样本量进一步研究其比例构成及内镜特点。本研究还发现SP患者中高危腺瘤与直径≥10 mm的SSA/P之间有相关性,而与直径≥10 mm的HP及位于近端的SSA/P和HP之间均无相关性,即直径≥10 mm的SSA/P患者,更易同时伴有高危腺瘤。若在临床上遇到此类患者,需考虑到SSA/P及高危腺瘤的高恶变潜能,应尽可能完全切除病灶,密切随访,及时安排复查。
近年来国内对SP的重视程度不断提高,而本研究纳入分析的数据多源于近两年,检出率会更贴近实际。同时为减少漏诊率,本研究对结肠镜检查条件进行了严格限制,保证了纳入的结肠镜检查是高质量的。但本研究仍存在一些不足:就内镜特点而言,仅就息肉的大小、部位及形态进行了研究,而没有对息肉的边界情况及微血管结构进行研究。同时由于本研究是回顾性研究,并不是每例患者都会行放大内镜观察,所以腺管开口资料不全,也未对其相关特点进行总结。
本研究中,结直肠SP检出率偏低,其分布由高比例的HP、SSA/P和低比例的TSA构成。HP和SSA/P有其自身的内镜特点,结合息肉部位、大小及形态有助于区分。而SSA/P不同病理分型的内镜特点,仍需要扩大样本量进一步研究。

