转BpCHS基因过量表达白桦叶片和韧皮部色素含量及植株表型分析1)
范志勇
(黑龙江省大庆市第四中学,大庆,163711)
姜晶 王芳 吕东林 顾宸瑞 李腾 姜静
(林木遗传育种国家重点实验室(东北林业大学)) (辽宁林业职业技术学院) (林木遗传育种国家重点实验室(东北林业大学))
类黄酮化合物(flavonoids)普遍存在于高等植物的叶、茎、花、果实等各种器官组织中,是果实和花的主要色素。查耳酮合酶(chalcone synthase,CHS)是黄酮类物质合成的第一个限速酶,该酶催化丙二酰CoA与对羟基苯丙烯酰CoA缩合生成四羟基查耳酮,查尔酮在查尔酮异构酶的作用下生成许多黄烷酮类物质,再由黄烷酮衍生出各种黄酮类、醇类、花色素苷类等次级代谢产物[1]。由此可知,CHS的作用非常重要,CHS基因的沉默、超表达或突变都将直接或间接影响花色素苷等黄酮类化合物的合成,进而导致植物花色或果实颜色变异[2-6]。迄今为止,已从桂花(Osmanthusfragrans)、葡萄(Vitisvinifera)、向日葵(HelianthusannuusL.)、越橘(Vacciniumspp.)等700多种植物中克隆获得CHS基因[7-11]并在烟草(Nicotianabenthamiana)[9,12]、甘蓝型油菜(BrassicanapusL.)[11]、洋桔梗(Eustomagrandiflorum)[13]、猕猴桃(Actinidiasinensis)[14]等植物中采用转基因技术已获得花色、果色变异的转基因品种。
白桦(BetulaplatyphyllaSuk.)是我国东北及内蒙古四省区主要分布的树种之一,其姿态优美、树皮洁白,具有独特的观赏价值,被广泛应用于庭院观赏和园林绿化[15],人们采用基因工程育种的方法相继对白桦进行了遗传改良,分别获得了同期缩短、木质素含量降低、抗虫及耐盐性提高的转基因白桦[16-19]。然而,有关BpCHS基因研究却鲜见报道,本实验以白桦合子胚为受体采用农杆菌介导法将BpCHS3导入白桦基因组中,通过对转基因株系的生长表型观察以及色素含量测定,探讨白桦CHS3基因的功能。
1 材料与方法
转基因受体为白桦(Betulaplatyphylla×B.pendula)种子,种子采自东北林业大学白桦强化种子园内自由授粉的优树,将采摘的种子晾干,去除苞片及果梗等杂质,分成若干小份,塑料袋塑封后置于冰箱-20 ℃保存备用。
EHA105(pBpCH3)菌株为本实验室保存。TaqDNA polymerase购自Fermentas公司;潮霉素(Hygromycin B)购自amresco公司;利福平(rifampicin,Rif)购自Sigma公司;头孢霉素(Cefotaxime)购自Phyto Technology Laboratories公司。
白桦的遗传转化:采用农杆菌介导的合子胚法进行遗传转化[17]。即将纵切后并经过工程菌液侵染的白桦合子胚置于共培养基上(WPM+2.0 mg/L 6-BA+0.2 mg/L NAA)暗培养48 h,随后转接至含选择剂和抑菌剂的固体平板培养基上(WPM+2.0 mg/L 6-BA+0.2 mg/L NAA+200 mg/L Cef+50 mg/L Hyg),(25±2)℃光照条件下进行选择培养,20 d后在合子胚切口处可见陆续产生Hyg抗性愈伤组织,待抗性愈伤组织直径为0.2 mm左右时将其切下,置于分化培养基上(WPM+0.8 mg/L 6-BA+0.02 mg/L NAA+0.5 mg/L GA3+200 mg/L Cef+50 mg/L Hyg)诱导分化不定芽,待不定芽长成丛生苗后选取生长健壮的无根苗接种于生根培养基(WPM+0.4 mg/L IBA+200 mg/Lcef)中进行生根培养。
PCR检测:采用植物DNA提取试剂盒(天根生化科技(北京)有限公司)提取参试株系总DNA,根据BpCHS3 ORF两端序列设计引物:
上游引物为:5′-CACCATGGTGTCCCCTGGAAACGCG-3′;下游引物为:5′-CGCAACTGGTGGGTGGAGCAC-3′,PCR反应体系参考文献[20],PCR产物用1.0%的琼脂糖凝胶检测。
qRT-PCR检测:采用植物总RNA提取试剂盒(北京百泰克生物技术有限公司)分别提取参试株系总RNA,RNA经DNaseI(RNase free)消化后用Rever Tre Ace®qPCR RT Kit(东洋纺(上海)生物科技有限公司)进行逆转录。逆转录体系为RNA 1 μg、5×RT Buffer 2 μL、Primer Mix 0.5 μL、Enzyme Mix 0.5 μL,去离子水补足体积至10 μL。反应程序为37 ℃ 15 min;98 ℃ 5 min。将反转录产物稀释10倍,用作定量PCR的模板,同时以18S rRNA和tublin为内参基因,对参试基因进行qRT-PCR分析。PCR反应体系为2×SYBR Green Realtime PCR Master mix 10 μL(东洋纺(上海)生物科技有限公司)、模板2.5 μL、上游引物和下游引物(10 μmol·L-1)各0.5 μL、用去离子水补足体积20 μL。反应程序为94 ℃ 30 s,94 ℃ 12 s、54 ℃ 30 s、72 ℃ 30 s,循环45次,80.0 ℃读板1 s,收集荧光,绘制熔解曲线,温度由55 ℃开始至99 ℃终止。在DNA Engine OpticonTM 2型实时定量PCR仪(Bio-Rad,USA)上完成qRT-PCR,各反应均设3次重复,用2-ΔΔCt方法对试验结果进行分析(表1)。

表1 qRT-PCR引物序列
转基因植株生长性状调查:将获得的转基因白桦继代苗及WT苗接种于生根培养基中进行生根培养,待生根苗高在2~3 cm左右时开盖炼苗,按文献[20]进行炼苗及移栽,每个株系扩繁50株左右,待苗木1年生时,参试株系均选取高度一致的苗木30株,移至直径25 cm、高度30 cm的营养钵中,2年生时进行苗高、地径及侧枝数等性状的调查。
转基因白桦树皮颜色的调查:利用英国皇家园艺学会第6版比色卡(RHS2015)鉴定参试株系的茎杆颜色。
叶绿素与类胡萝卜素的质量分数测定:于7月中旬分别摘取参试株系的第4~5叶片,每个株系取3株树的叶片,混样后备用;同时截取第4叶开始至下方10 cm处的茎杆,每个株系也是截取3株树的茎杆,用刀片轻轻刮取韧皮组织,混样后备用。
将上述试材分别放于研钵中液氮研磨后,取0.1 g放于含有10 mLV(丙酮)∶V(乙醇)=2∶1混和液的三角瓶中浸提,三角瓶置于避光处室温浸泡至无色,过滤后获得提取液(各样品重复3次)。
将上述提取液用V(丙酮)∶V(乙醇)=2∶1混合液稀释5倍,置于比色皿中,采用722S可见分光光度计测定其在663、645、470 nm波长处的吸光值,根据公式求算色素质量浓度:
叶绿素a=12.7DO663-2.69DO645;
叶绿素b=22.9DO645-4.68DO663;
总叶绿素(a+b)=20.2DO645+8.02DO663;
类胡萝卜素=8.73DO470+2.11DO663-9.06DO645。
根据公式求算色素质量分数=[色素质量浓度×提取液体积×稀释倍数]/样品鲜质量。公式中DO663、DO645和DO470分别为叶绿素提取液在663、645和470 nm下的吸光值。提取方法参照文献[21]和[22]。
花青素质量分数测定:根据文献[23]方法称取1 g待测试材,剪碎后置于烧杯中,加入10 mL的0.1 mol/L HCL,将烧杯口封好后置于温箱32 ℃浸提4 h后过滤,即为待测溶液。用1 mL比色皿,在721分光光度计上于530 nm处读取吸光度(A),以0.1 mol/L HCL溶液为空白对照。
取纯度95%的花青素样品20 mg及0.1 mol/L HCl溶液20 mL配制0.95 g/L的0.1 mol/L HCL标准溶液。在721分光光度计上于530 nm处读取标准溶液吸光度,以吸光度(A)=0.1时的花青素为1个单位进行单位换算,标准溶液花青素质量分数为平均20个单位,则每单位对应花青素0.475 mg,将上述测定的花青素单位乘以0.475,即为测定的花青素质量分数。
2 结果与分析
2.1 过表达BpCHS3白桦的获得与分子检测
采用农杆菌介导目的基因载体转化白桦成熟合子胚,经50 mg/L Hyg筛选获得抗性继代苗,将继代苗分别接种于生根培养基中,待长出3~4片叶时,切取叶片继续在50 mg/L Hyg培养基中进行二次筛选,试验共计获得15个转化子,分别命名为OE1、OE2、…、OE15(图1)。
分别对获得的抗性株系进行PCR检测,即以转基因白桦总DNA为模板,以pBpCHS3质粒载体为阳性对照,野生型白桦(WT)为阴性对照,采用BpCHS3基因ORF两端序列为引物进行PCR扩增(图2),结果显示:阳性pBpCHS3质粒及4个转基因株系在1 100 bp左右处有扩增谱带,该条带为白桦基因组整合的1 170 bp的BpCHS3cDNA,而WT及4个转基因株系在2 000 bp左右处也出现一条扩增谱带,该谱带是白桦基因组中具有535 bp内含子的1 705 bpBpCHS3基因序列,检测结果说明,35S启动子驱动的BpCHS3 cDNA序列已整合到白桦基因中。

M.DL2000;泳道1为pBpCHS3质粒;泳道2为水;泳道3为WT株系;泳道4~7为转基因株系(OE1、OE2、OE4、OE6)。
分别选择5个转基因株系进行qRT-PCR检测,结果显示:5个转基因株系的BpCHS3基因表达量相对WT株系均呈现上调表达,但BpCHS3上调幅度不尽相同(表2),虽然OE10株系BpCHS3上调表达量最低,但BpCHS3的表达量也高于WT株系的15倍;试验表明,转基因株系中BpCHS3基因在mRNA水平能够过量表达。
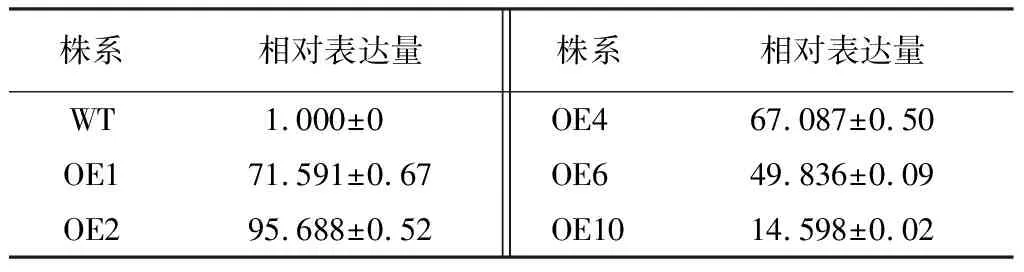
表2 转基因株系BpCHS3基因qRT-PCR分析
注:表中数据为“平均值±标准差”。
2.2 过表达BpCHS3白桦表型观察及生长特性
分别对1年生及2年生移栽的苗木观察发现(图3、图4):与野生型WT株系比较,转基因白桦叶片绿色变浅,树皮颜色也发生明显变化,BpCHS3过表达株系的茎杆呈现浅黄绿(RHS2015 199B),将树皮剥离后发现,树皮为灰白色(RHS2015 156A),且透光(图4中D),因此,茎杆的浅黄绿是韧皮组织透过灰白色树皮而呈现的颜色(图4中E);WT株系树皮为褐色(RHS2015 165A),由于其不透光,故此,WT的茎杆也为褐色(图4中B、C)。

A.生长发育中的白桦;B.停止生长的白桦;C.WT(左)及转基因白桦茎杆(右);D.WT茎的颜色为Moderate Brown(RHS2015 165A);E.BpCHS3过表达株系茎杆的颜色为Light Olive Brown(RHS2015 199 B)。
苗高及地径调查显示,转基因株系与WT的生长量差异不显著,而在侧枝生长方面表现不同,1年生的转基因白桦各株系均有侧枝生长,而WT株系未见侧枝形成(图3中B),2年生时WT株系虽然出现侧枝(表3),但在侧枝数量方面显著少于转基因株系(p<0.01),调查的5个转基因株系平均侧枝数为22.87个,而WT仅为18.63个。
2.3 转基因白桦光合色素及花青素质量分数的比较
为了探明BpCHS3过表达白桦组织细胞中花青素含量发生怎样变化?明确转基因白桦叶片绿色变浅,树皮茎杆呈现浅黄绿色与光合色素的关系。试验选取OE1、OE2、OE4等3个转基因株系及WT株系,分别测定叶片及韧皮组织的叶绿素、类胡萝卜素和花青素质量分数,结果显示:叶片组织中转基因株系的光合色素及花青素质量分数均显著低于WT株系(P<0.01),转基因株系总叶绿素质量分数均值低于WT的13.68%(表4),花青素相对质量分数均值低于WT的45.99%;韧皮组织中转基因株系的光合色素质量分数均高于WT,但只有OE1和OE2株系达到显著水平(P<0.01),3个转基因株系总叶绿素质量分数均值高于WT株系的88.16%(表5),而转基因株系韧皮组织中的花青素相对质量分数与WT株系差异不显著(表6)。

表3 2年生转基因白桦苗高、地径及侧枝数比较
注:表中数据为“平均值±标准差”;WT为对照株系,OE为BpCHS3过表达株系;同列不同字母表示差异极显著(P<0.01)。

A.WT及转基因白桦茎杆;B.剥离的树皮(实体显微镜拍照,×0.8)(greyed-white group)(RHS2015 156A);C.箭头标记的上方为剥离树皮后露出的韧皮部、下方为没有剥离树皮茎杆;D.剥离的树皮(实体显微镜拍照,×0.8)(greyed-white group)(RHS2015 156A);E.箭头标记的上方为剥离树皮后露出的韧皮部、下方为没有剥离树皮茎杆。
2.4 转基因株系的BpCHS基因的表达特性
为了明确转白桦CHS3过量表达株系中BpCHS家族成员的表达特性,试验根据前期紫雨桦转录组分析,以拟南芥查耳酮合酶(CHS,AT5G13930.1)作为输入序列,与白桦基因组进行BLASTP比对,在白桦基因组中找到BpCHS1、BpCHS2、BpCHS3等3条CHS基因全长序列[24-25],转基因白桦的qRT-PCR分析发现,相对WT株系3个转基因株系中的BpCHS1基因均呈下调表达,3个转基因株系的表达量均值仅为WT的64.59%,而BpCHS2基因除OE1株系外,其他2个转基因株系也呈现下调表达(表7)。

表4 转基因株系韧叶片组织中叶绿素及类胡萝卜素质量分数比较mg·g-1
注:表中数据为“平均值±标准差”;同列不同字母表示差异极显著(P<0.01)。

表5 转基因株系韧皮部叶绿素及类胡萝卜素质量分数比较 mg·g-1
注:表中数据为“平均值±标准差”;同列不同字母表示差异极显著(P<0.01)。

表6 转基因株系叶片与韧皮部中花青素质量分数比较 mg·g-1
注:表中数据为“平均值±标准差”;同列不同字母表示差异极显著(P<0.01)。

表7 BpCHS3过表达白桦叶片中CHS1及CHS2的相对表达量
注:表中数据为“平均值±标准差”。
3 结论与讨论
利用花色素代谢的结构基因和调节基因,对观赏植物的色彩进行改良具有十分广泛的前景,其中查耳酮合酶基因(CHS)在植物花色分子设计育种方面报道较多,例如运用RNAi技术抑制烟草、紫色矮牵牛等植物的CHS基因的表达,可导致花青素含量不同程度的降低,花色产生变异,甚至产生白色花朵[26]。白桦为高大乔木,童期较长,野外条件下17~20 a才能开花结实[27],白桦CHS3过表达能否影响花色需要后续观察。因此,试验仅对转基因白桦表型、花青素及光合色素质量分数进行分析,结果发现,转基因白桦树皮为无色(图4中D),侧枝增多,转基因白桦叶片总叶绿素及类胡萝卜素质量分数均值分别低于WT株系的13.68%、36.15%(表4)。有研究表明,CHS基因的过量表达或抑制表达转基因植物的种皮及茎杆颜色变浅,叶片组织叶绿素质量分数降低,转CHS烟草及甘蓝型黑籽油菜的的侧枝数量也发生改变[11,28-29]。白桦CHS3过表达株系生长表现与前人的研究结果非常相似。
对转基因白桦的花青素质量分数分析发现,其含量不但没有提高,反而显著降低,质量分数最低的OE2株系仅为WT株系的57.27%(表6),认为在转基因白桦中发生了CHS的共抑制现象,即引入的CHS基因能够阻断花色苷的合成。共抑制现象是20世纪90年代初Nappli et al在进行矮牵牛(Petuniahybrida)过量表达CHS基因时,首次提出了CHS基因间存在共抑制现象,随后人们相继发现了矮牵牛中与色素合成有关的一些基因转基因后会发生共抑制现象,其中CHS基因的研究较多[11,28-29]。然而让我们困惑不解的是qRT-PCR结果显示:转基因株系BpCHS3表达量却显著上调,均值高于WT株系59.76倍(表2),试验又对白桦中仅有的另外2条BpCHS表达量进行分析,发现转基因株系中的BpCHS1和BpCHS2均呈下调表达(OE1株系除外),故此,推测BpCHS3的过量表达,未对BpCHS3产生共抑制,但可能对另外2个CHS家族成员(2个家族成员与CHS3具有70%左右的同源性)产生了共抑制现象,这种推测还需后续实验进一步的验证。
白桦CHS3的过量表达为何导致叶片光合色素合成量的减少,叶绿素、类胡萝卜素及花青素之间是通过怎样的代谢途径相互影响,CHS通过共抑制如何影响侧枝数量及树皮着色等问题还有待进一步揭示。

