超高效液相色谱-串联质谱测定淤泥4种氟喹诺酮类药物残留1
符靖雯,吴育彬,刘惠茹*,杨钦沾
(1.惠州市农产品质量安全监督检测中心,广东 惠州 516008;2.惠州学院 化学与材料工程学院,广东 惠州 516007)
氟喹诺酮类药物是一种广谱抗菌药物,对革兰氏阴性菌、革兰氏阳性菌、衣原体等均有效.由于其抗菌谱广、抗菌活性强、生物利用度好、口服安全有效、便宜等优点,在畜牧养殖业中广泛使用,且使用量巨大[1],但是细菌对其产生的耐药性已成为全球面临的巨大挑战.一方面,氟喹诺酮类药物可直接对人体健康造成危害.过多使用造成的不良反应有许多,比如:引起未成年动物关节组织中软骨损失;引起消化系统不良反应(恶心、呕吐、腹泻等);造成血液系统中血细胞及血小板减少;肝脏毒化反应等[2].另一方面,氟喹诺酮类药物通过各种途径进入环境中,由于其溶解性较差,性质稳定,故在水环境和土壤中的残留可以不断累积,导致氟喹诺酮类药物在水环境和土壤中的浓度水平不断升高,对水环境和土壤中的生物造成直接的影响,也对水环境和土壤中微生物群落分布结构造成破坏[3].因此,对于氟喹诺酮类药物的残留检测是十分必要的[4-8].
目前,淤泥中广谱抗菌药物残留的检测技术有毛细管电泳分析技术[6],气相色谱-质谱联用技术[7],液相色谱法[8]和高效液相色谱-质谱[9]等.毛细管电泳技术具有高效、快速、进样量少、自动化程度高等优点,缺点是其进样量少,因而制备能力差,光路短,灵敏度低,重现性差等.气相色谱-质谱联合使用可检测的物质种类多,应用范围广,分辩能力高,但对混合物的检测性能较差;液相色谱分离效率高,选择性好,检测灵敏度高,操作自动化,应用范围广,但分析时间一般比较长,若与质谱联用,可以显著地提高其灵敏度和精确度,缩短分析时间,因此,本研究借助串联质谱(MS/MS)高选择性、高灵敏度的优势,经过较为简单的前处理净化后,可以对复杂样品进行筛查分析,从技术原理上杜绝了样品假阳性和假阴性的现象,显著提高了检测的准确度;同时基于UPLC-MS/MS方法,可获得更低的检出限,能检测出0.02 μg/kg的药物残留.本论文旨在建立一种超高效液相色谱-串联质谱法测定淤泥中4种氟喹诺酮类药物残留的检测方法,对于其在淤泥中的检测具有一定的实用价值.
1 实验部分
1.1 仪器与试剂
超高效液相色谱-三重串联四级杆质谱联用仪(美国Agilent公司);高速冷冻离心机,TGL-16M型,最大转速不低于8000 r/min,湘仪离心机仪器有限公司;恒温水浴氮吹仪,LB-W型,美国Organomation N-EVAP公司;Waters Oasis HLB固相萃取柱(200 mg,6 mL,美国Waters公司);SAX固相萃取柱(3 mL,500 mg,美国Waters公司).
氧氟沙星(FOL)、环丙沙星(CIP)、恩诺沙星(ENR)、达氟沙星(DAN),纯度≥98.0%,均购自德国Dr.Ehrenstorfer公司.甲醇(色谱纯,德国Merck公司);甲酸、乙酸铵(色谱纯,广州化学试剂厂);试验用水为超纯水.
标准储备溶液:分别称取4种氟喹诺酮类药物标准品至烧杯中,用甲醇溶解,容量瓶中定容,配制成浓度为1 mg/mL的标准储备溶液.标准储备溶液于-18℃下避光保存,保存期为6个月.
混合标准溶液:分别吸取适量标准储备溶液,置于容量瓶中,用甲醇稀释成浓度为1.00 μg/mL的混合标准溶液.混合标准溶液于4℃下避光保存,保存期为1个月.
基质混合标准工作溶液:吸取一定量的混合标准溶液,用空白样品提取液稀释成不同浓度的基质混合标准工作溶液.基质混合标准工作溶液应现用现配.
1.2 仪器条件
1.2.1色谱条件
色谱柱:C18柱(2.1 mm×150 mm,1.8 μm);柱温:40 ℃;进样量:8 μL;流速:0.4 mL/min;流动相:A相:0.2%甲酸水溶液(5 mmoL/L乙酸铵),B相:0.2%甲酸甲醇溶液.梯度洗脱程序见表1.
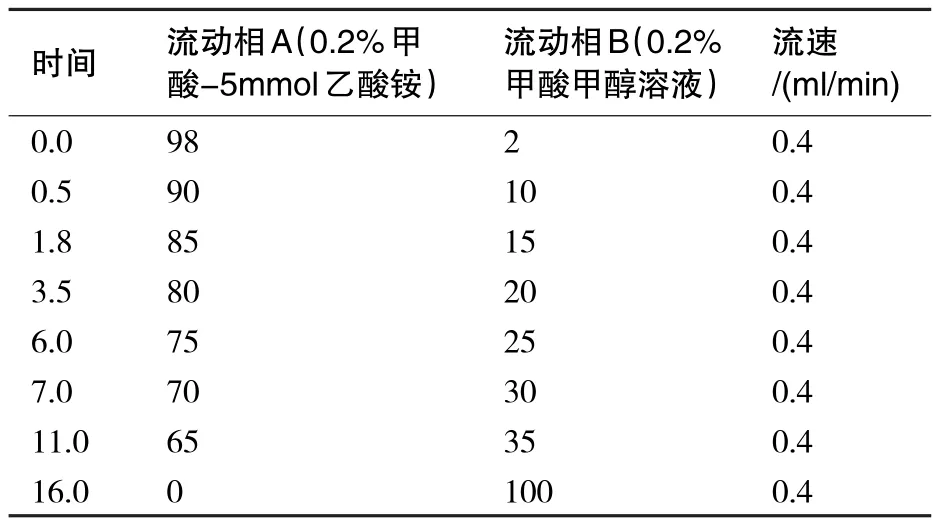
表1 流动相梯度洗脱程序
1.2.2质谱条件
电离方式:电喷雾电离(ESI);
扫描方式:正离子扫描;
干燥器流速:10 L/min;
喷雾器:50 psi;
干燥器温度:350℃;
毛细管电压:4000 V;
碰撞气:氩气,纯度≥99.999%;
检测方式:多反应监测MRM.化合物的保留时间、离子对、裂解电压、碰撞能量和扫描模式信息参见表2.
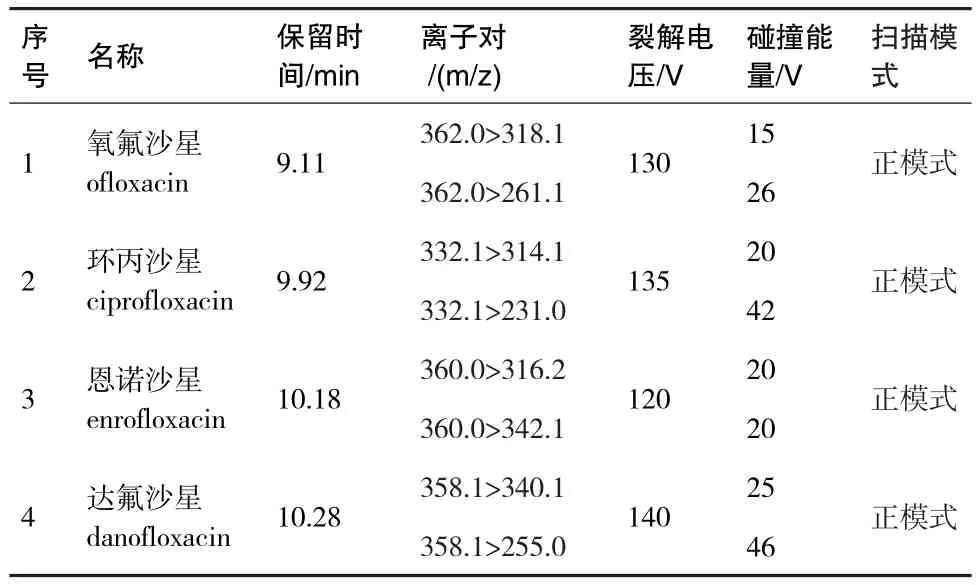
表2 优化后的4种喹诺酮类抗生素质谱参数
1.3 样品采集与前处理
采集养殖场的淤泥样品充分混匀,风干去除杂物,研磨过250 μm孔径筛,充分混匀,取500 g装入棕色或深色密封瓶中备用.在制样过程中需防止样品受到污染或残留物含量发生变化,在-18℃保存.
称取适量的经研磨的淤泥样品于离心管中,加入0.4 g乙二胺四乙酸二钠盐(Na2EDTA·2H2O)及10 mL乙腈-磷酸盐缓冲溶液(1:1)(pH=3)提取液.于摇床振摇后超声提取,8000 r/min离心5 min,收集上清液.重复提取2次,合并上清液.在50℃下蒸发至剩余约10 mL,加水稀释至约30 mL,备用.
将SAX萃取柱连接在HLB萃取柱顶部,加样前先后用6 mL甲醇、6 mL水活化柱子,将样品提取液全部转移至净化柱,控制流速为1 mL/min.加样后用6 mL水淋洗固相萃取柱,继续抽真空5 min.卸下SAX柱,用5.0 mL甲醇洗脱HLB柱,收集流出液,氮吹至近干,加入定容液,涡旋混匀,经0.22 μm滤膜过滤后,上机待测.
2 结果与讨论
2.1 色谱条件的选择
考虑到离子扫描模式为ESI+,4种氟喹诺酮类药物均为两性化合物,在水溶液里容易发生解离,形成带有电子的氟喹诺酮类离子,根据相似相容原理,故在流动相中加入一定的甲酸和乙酸铵加强电离效率,提高分离效果,改善峰形对称性.参考已有文献[10],在流动相中加入0.2%甲酸时,目标化合物的峰形尖锐.同时在流动相中加入乙酸铵缓冲盐,增加目标物的响应值,从而提高灵敏度.实验考察了不同浓度的乙酸铵缓冲盐对目标物的响应值的影响,结果显示,在流动相中加入乙酸铵后,目标物的响应值明显提高,当乙酸铵浓度提高到10 mmol/L时,响应值与5 mmol/L时并无明显差异.因此,为了保护色谱系统,选择在流动相中加入5 mmol/L乙酸铵.
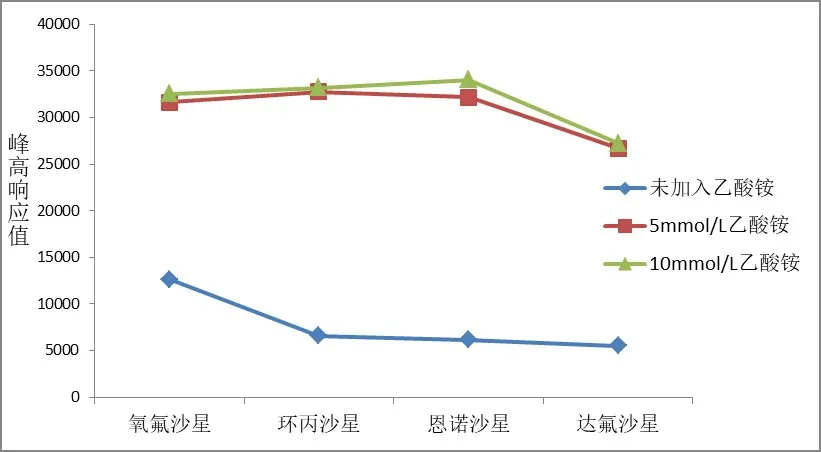
图1 不同浓度乙酸铵缓冲盐对目标物的响应值
2.2 提取剂的选择
氟喹诺酮类药物的极性结构决定了其易与金属离子发生螯合,而添加Na2EDTA可有效地抑制药物与金属离子螯合从而提高提取率.综合考虑了4种喹诺酮类药物的pKa,本实验分别用乙腈:磷酸盐缓冲液(1:1)(pH=3)、加入Na2EDTA的乙腈:磷酸盐缓冲液(1:1)(pH=3)作为提取液,提取加标淤泥.结果如图2所示,加入Na2EDTA后药物的回收率得到明显提高,因此本实验采用加入Na2EDTA的乙腈:磷酸盐缓冲液(1:1)(pH=3)作为提取液,回收率在74.2%~88.6%之间.
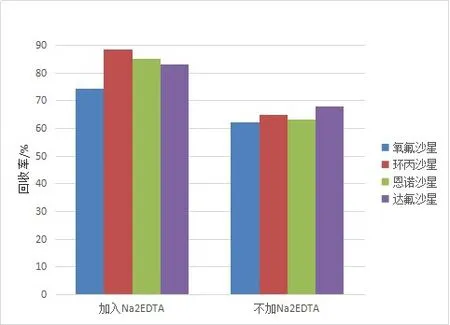
图2 有无加入Na2EDTA的提取剂对氟喹诺酮类药物回收率的影响
2.3 稀释对回收率的影响
提取液中含有大量极性的有机溶剂,若使用以聚合物为填料的HLB柱直接进行净化,目标物会被有机溶剂带出而无法保留在SPE柱上,可以通过旋转蒸发或者用弱极性溶剂稀释后降低有机溶剂的含量,从而提高回收率.本实验将提取液通过旋转蒸发至约10 mL后,加水至约30 mL,用于净化.净化液中乙腈的含量低于3%,由图3可见,目标物的回收率明显提高.
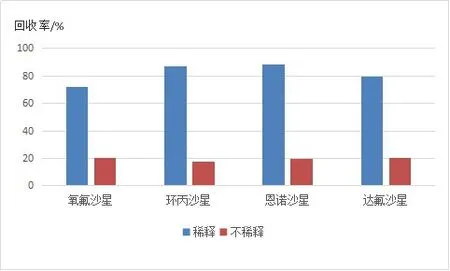
图3 稀释对淤泥中抗生素回收率的影响
2.4 固相萃取柱的选择
淤泥中以阴离子形式存在的大量腐蚀酸类有机质对色谱柱和质谱检测器有很大影响,因此需要强阴离子交换柱SAX去除这些腐蚀酸性物质的干扰.本实验比较了SPE C18固相萃取柱和Oasis HLB柱对4种氟喹诺酮类药物的萃取效率.结果如图4所示,以聚合物为填料的HLB柱对药物的回收率均高于硅胶键合的C18柱.因此,选择了SAX柱与HLB柱串联,不仅能有效的去除土壤中的干扰物质,还能很好的富集淤泥中残留的氟喹诺酮类药物.
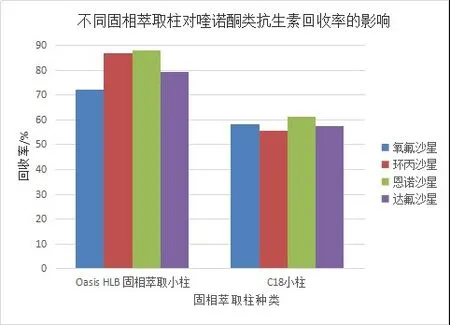
图4 两种固相萃取柱对氟喹诺酮类药物回收率的影响
2.5 线性范围和检出限
本实验采用外标法进行定量.4种氟喹诺酮类药物的线性范围、回归方程以及线性相关系数(R2)见表3.结果表明各药物在5ng/mL~100 ng/mL线性范围内线性关系良好,相关系数均大于0.998.以3倍信噪比(S/N=3)作为方法的检出限(LOD),4种氟喹诺酮类药物的检出限为0.015~0.060μg/kg.
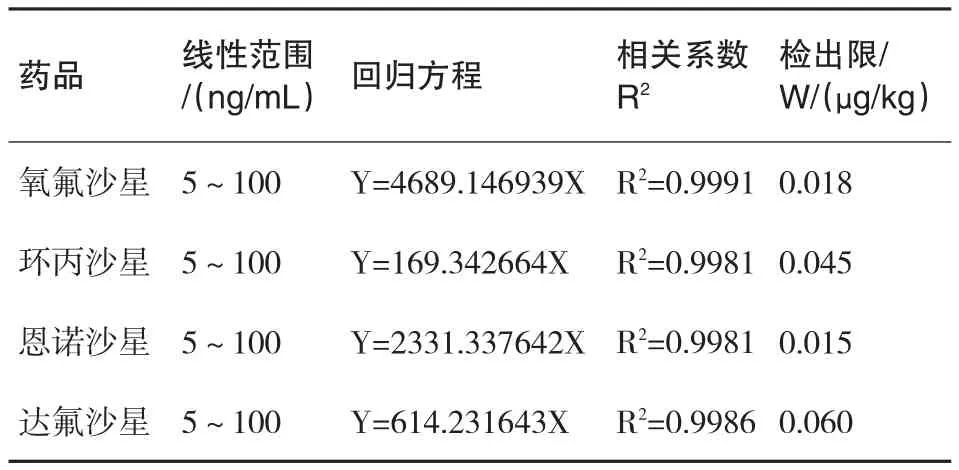
表3 4种喹诺酮类药物的线性范围、回归方程、线性相关系数及检出限
2.6 方法回收率和精密度
实验通过土壤空白样品添加实验测定回收率和相对标准偏差RSD.当添加浓度分别为5 ng/mL、20 ng/mL和50 ng/mL时,4种氟喹诺酮类药物的平均回收率为70.4%~89.4%,相对标准偏差为7.4%~9.4%.4种氟喹诺酮类药物均能达到比较满意的回收率,该方法能够满足痕量检测的要求.
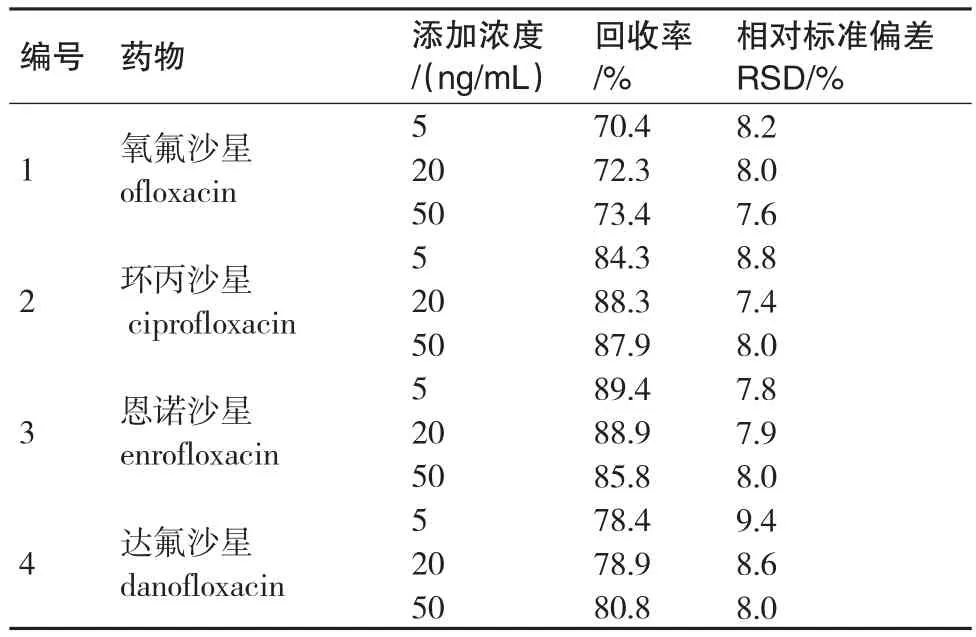
表4 4种喹诺酮类药物加标回收实验结果
2.7 实际样品检测
应用本方法对从养殖场采集的淤泥样品进行实验,4种氟喹诺酮类药物均无检出.
3 结论
建立了一种超高效液相色谱-串联质谱(UPLCMS/MS)测定淤泥中4种氟喹诺酮类药物残留量.该方法简单、快速,灵敏度高,能满足养殖场淤泥中痕量抗生素残留检测.

