脊髓背角瞬时感受器电位香草酸受体1敏感性神经元对不同温度艾灸响应的研究
蔡辉 王明 金传阳 余芝 王欣君 张建斌


摘要:目的 观察脊髓背角瞬时感受器电位香草酸受体1(TRPV1)敏感性神经元对不同温度艾灸“足三里”的响应。方法 健康成年雄性大鼠40只,以41、45、49 ℃分别艾灸干预“足三里”,用玻璃微电极探查L4脊髓背角神经元放电并进行细胞外记录;以辣椒素溶剂、辣椒素溶液穴位注射“足三里”,筛选出瞬时感受器电位香草酸受体1(TRPV1)敏感性神经元,观察并比较脊髓背角TRPV1敏感性神经元对3个温度艾灸的响应及其差异。结果 TRPV1敏感性神经元对3组温度均有响应。从响应的神经元性质看,45、49 ℃艾灸主要表现为兴奋,41 ℃艾灸兴奋和抑制的神经元数目相当;从响应的神经元特征看,不同温度对应特定放电频率的神经元:41 ℃为(8.26±2.14)spikes/s、45 ℃为(4.69±2.61)spikes/s、49 ℃为(10.66±5.97)spikes/s;从影响神经元放电频率变化看,41 ℃艾灸干预前后无明显变化,45、49 ℃艾灸干预后放电频率明显加快(P<0.01)。结论 脊髓背角TRPV1敏感性神经元对41、45、49 ℃ 3组温度均有响应,响应的特征、性质和强弱与温度有关。
关键词:脊髓背角细胞;神经元;艾灸;足三里;温度;大鼠
DOI:10.3969/j.issn.1005-5304.2018.03.011
中图分类号:R245 文献标识码:A 文章编号:1005-5304(2018)03-0048-05
Abstract: Objective To observe the response of TRPV1 sensitive neurons in spinal cord under moxibustion of different temperatures in “Zusanli”. Methods Totally 40 healthy male SD rats were chosen and stimulated with moxibustion at “Zusanli” in 41 ℃, 45 ℃ and 49 ℃. Extracellular recording techniques of glass microelectrode was used in the rats L4 spinal cord neurons. Capsaicin vehicle and solution was injected into the rats through “Zusanli” to filter the sensitive neuron to TRPV1. The response of sensitive neurons to TRPV1 in spinal cord under moxibustion of three different temperatures was recorded and compared. Results The TRPV1 sensitive neurons responded to all the three temperatures. Viewing from the nature of the responding neurons, the neuron in 45 ℃ and 49 ℃ mainly performed in agitation, while the number of agitated and inhibitory neurons appeared same in 41 ℃. Viewing from the character of the responding neurons, different temperatures correspond to differential discharge frequency: 41 ℃was (8.26±2.14) spikes/s, 45 ℃ was (4.69±2.61) spikes/s, 49 ℃ was (10.66±5.97) spikes/s. Viewing from the change of discharge frequency, the neurons in 41 ℃ was found without obvious change, while the neurons in 45 ℃ and 49 ℃ discharge frequency apparently increased (P<0.01). Conclusion Sensitive neurons in TRPV1 in spinal cord can response to 41 ℃, 45 ℃ and 49 ℃, whose character, nature and degree are related to the temperature gradient.
Keywords: spinal dorsal cell; neuron; moxibustion; Zusanli; temperature; rats
艾灸的核心作用是以溫促通[1]。在神经系统中,外周感受温热的初级传入纤维大多数为C纤维[2],经背根神经节主要投射到脊髓背角的边缘层和胶质层(传递头面部温度信息的纤维终止于三叉神经脊束核),胶质层中的兴奋性和抑制性中间神经元对温度信息进行调制[3]。瞬时感受器电位香草酸受体1(transient receptor potential cation channel subfamily V member 1,TRPV1)又称辣椒素受体或香草酸受体,是非选择性的阳离子通道蛋白家族成员之一,广泛分布于哺乳动物的感觉神经纤维,尤其是小直径的Aδ和C纤维[4]。此外,中枢神经系统如背根神经节、脊髓背角、三叉神经节及大脑部分区域的突触上亦有TRPV1的分布[5]。该受体除了对辣椒素敏感,也被伤害性热刺激信号(>43 ℃)、低pH值(<6.0)激活[6]。当TRPV1被激活后,大量钙离子内流,同时伴有极少量的镁离子、钠离子、钾离子、铯离子,胞内阳离子浓度升高,细胞去极化,产生动作电位,神经冲动经过一系列整合,上传到中枢[7],产生热觉并通过分泌神经肽等方式发挥艾灸温通作用[8-9]。因此,脊髓背角TRPV1敏感性神经元活动可能是艾灸温热效应脊髓中枢调制的主要环节;同时,有研究表明,TRPV1介导的艾灸降脂效应具有温度差异,脊髓背角TRPV1敏感性神经元的差异性响应可能是不同温度艾灸效应的原因之一[10]。本研究观察TRPV1敏感性神经元对不同温度艾灸的响应,探讨艾灸TRPV1机制的脊髓环节。
1 材料与方法
1.1 动物
健康成年雄性SD大鼠40只,体质量300~350 g。南京中医药大学动物实验中心,动物许可证号SCXK(沪)2013-0016。饲养于温度(22±2)℃、相对湿度(60±10)%环境,光照12 h/12 h明暗交替,大鼠自由摄食饮水。
1.2 主要试剂与仪器
10%乌拉坦(上海青析化工科技有限公司),滂胺天蓝(美国Sigma,批号24410),辣椒素(美国Sigma),石蜡油(南京化学试剂有限公司),无水乙酸钠(南京化学试剂有限公司),吐温80(南京化学试剂有限公司),艾条(南阳市卧龙汉医艾绒厂)。辣椒素溶液配制:将吐温80、无水乙醇、生理盐水以1∶1∶8比例配制成溶剂(vehicle),然后将辣椒素溶解于vehicle溶剂中配成0.01 mol/L辣椒素溶液。脑立体定位仪(美国David Kopf Instruments),玻璃微电极拉制仪(WD-1,成都仪器厂),微电极操作器控制(日本NARISHIGE,型号PC-5N07017),玻璃微电极(南京市泉水教学实验器材厂),细胞外电生理记录放大器(美国A-M systems,型号L-FDQ-1),Micro3-1401生理信号采集分析系统(英国CED,型号M4097),温控仪H-KWDY-Ⅲ(南京市泉水教学实验器材厂),红外测温仪(Fluke 566),动物手术器械1套。
1.3 动物处理
大鼠称重,腹腔注射10%乌拉坦(1.5 g/kg),充分麻醉并俯卧固定于37 ℃电热板上。剃净大鼠背部手术区域及小腿干预区域的毛,分离皮下组织,切除脊柱两侧的竖脊肌,暴露椎骨,撬开棘突和椎骨,暴露脊髓L4节段,用蘸有生理盐水的棉球擦净周围血液。在解剖显微镜放大下观察脊髓,剥离硬脊膜后迅速滴38 ℃左右的石蜡油保持脊髓湿润。将大鼠固定在脊髓固定架上,沿两侧外耳道插入耳棒,齿棒固定下门齿,头部制动,防止在记录过程中呼吸运动对记录产生干扰。
1.4 神经元放电
拉制玻璃微电极,尖径1~2 μm,内充溶有2%滂胺天蓝0.5 mol/L醋酸钠电解液(阻抗5~10 mΩ),并在显微镜下观察以确保无气泡残留,随后将玻璃微电极固定在微电极操作器上。连接微电极和生理信号采集系统,并开启计算机运行生物信号采集处理系统。用推进器将微电极插入大鼠脊髓L4节段后正中裂旁开0.5~1.0 mm,旁开侧与随后的干预侧保持一致。以5 μm/s速度推进到脊髓表面下250 μm后开始记录,通过微电极推进器控制使电极尖端以1 μm/s速度步进在目标脊髓的深度范围(脊髓表面下250~1000 μm),以细胞外记录的方式,探查神经元。记录到稳定放电且信噪比>3∶1,记录放电1 min作为基线和研究对照。
1.5 艾灸
参考《实验针灸(第二版)》[11]定位“足三里”:膝关节后外侧,腓骨小頭下约5 mm处。将红外测温仪固定在小型支架上并对准“足三里”监测温度。点燃艾条,采用悬灸方式刺激穴位,固定施灸距离使红外测温仪显示的数值始终保持在所需温度。依次观察41、45、49 ℃施灸“足三里”对脊髓背角神经元放电的影响。每组温度艾灸干预并记录神经元放电30 s。随后“足三里”注射150 μL vehicle作为对照,记录神经元放电30 s,再注射0.01 mol/L辣椒素150 μL,记录神经元放电30 s。以干预开始时刻为时间点,以1 s内放电1次(1 spike/s)作为平均放电频率单位,比较干预前后神经元在干预时间内平均放电频率变化率,平均放电频率=(干预后平均放电频率-干预前平均放电频率)÷干预前平均放电频率,以平均放电频率变化率的绝对值超过15%为有响应,变化率为正值是兴奋,变化率为负值则是抑制。若平均放电频率对vehicle无响应而对辣椒素有响应,则判断该神经元为TRPV1敏感性神经元。
在以上记录过程中,每组干预开始前,必须先等待上一组干预影响的神经元放电恢复至基线水平50 s以上。在注射vehicle及辣椒素溶液时,先插入针头,等待一段时间,待干扰恢复至基线水平50 s以上后,再将vehicle或辣椒素溶液注射入肌肉进行记录。实验过程中随时补充38 ℃石蜡油保持脊髓湿润,保持安静,减少周围环境的干扰。
1.6 统计学方法
采用SPSS22.0统计软件进行分析。计量资料以—x±s表示,干预前后对比采用配对t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 瞬时感受器电位香草酸受体1敏感性性神经元对不同温度艾灸的响应
40只大鼠共记录到60个自发放电的神经元,其中46个神经元对vehicle无反应而对辣椒素干预敏感,即为TRPV1敏感性神经元。进一步分析46个TRPV1敏感性神经元中,对41 ℃艾灸干预敏感的神经元24个,平均放电频率为(8.26±2.14)spikes/s;对45 ℃艾灸干预敏感的神经元21个,平均放电频率为(4.69±2.61)spikes/s;对49 ℃艾灸干预敏感的神经元20个,平均放电频率为(10.66±5.97)spikes/s。见表1。
2.2 瞬时感受器电位香草酸受体1敏感性神经元对不同温度艾灸响应的性质
在脊髓背角记录到的46个TRPV1敏感性神经元中,其中兴奋性神经元38个,抑制性神经元8个。TRPV1敏感性神经元对不同温度艾灸干预的响应存在兴奋性和抑制性差异:响应41 ℃艾灸的24个(兴奋作用12个、抑制作用12个),响应45 ℃艾灸的21个(兴奋作用21个、抑制作用0个),响应49 ℃艾灸的20个(兴奋作用16个,抑制作用4个)。脊髓背角TRPV1敏感性神经元对于45、49 ℃艾灸“足三里”的响应主要表现为兴奋,而对41 ℃艾灸“足三里”的响应则兴奋和抑制各半。
2.3 瞬时感受器电位香草酸受体1敏感性神经元对不同温度响应的放电频率变化程度
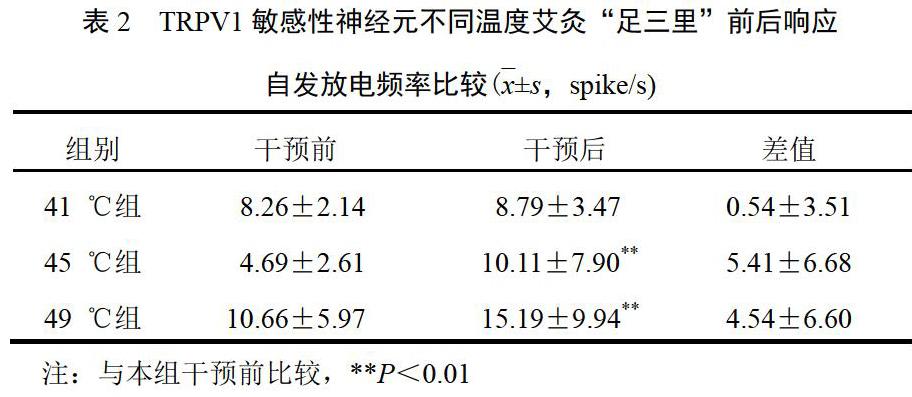
TRPV1敏感性神经元对不同温度艾灸“足三里”响应放电频率变化存在差异。其中,41 ℃艾灸“足三里”后,响应的TRPV1敏感性神经元放电频率平均升高(0.54±3.51)spikes/s,艾灸前后放电频率无明显差异。45 ℃艾灸“足三里”后,响应的TRPV1敏感性神经元放电频率平均升高(5.41±6.68)spikes/s,艾灸前后差异有统计学意义(P<0.01);49 ℃艾灸“足三里”后,响应的TRPV1敏感性神经元放电频率平均升高(4.54±6.60)spikes/s,艾灸前后差异有统计学意义(P<0.01)。见图1、表2。
3 讨论
艾灸施术于体表特定部位,通过温热感知和激活相关通路发挥以温促通的作用,其中脊髓背角是重要环节之一。足三里是临床施灸常用穴,可以治疗高血压病[12]、高血脂症[13]、冠心病心绞痛[14]等疾病。一般认为,足三里穴区的初级传入神经纤维来源于腓深神经,其在脊髓的节段为L4-5及骶S1-2节段,故本研究选择足三里为体表干预点,以L4节段的背角区域为脊髓电生理信号观察点。有研究表明,高浓度辣椒素阻断C纤维,使感觉神经元失敏,故我们选择低浓度的辣椒素(0.01 mol/L)作为TRPV1敏感性神经元的激活剂[15]。先將针头插进穴区,等放电恢复至基线水平再注射药物,排除了注射器刺入肌肉过程中的机械性伤害造成的干扰因素。我们测试了vehicle注射“足三里”对脊髓背角神经元的影响,发现其对背角神经元放电无明显影响,故可以排除vehicle注射的化学干扰因素。为避免留在肌肉内的vehicle和辣椒素溶液对艾灸干预效应产生干扰的可能,我们先给予不同温度艾灸干预,后注射vehicle和辣椒素。通过探究筛选出的TRPV1敏感性神经元及其对3组温度(41、45、49 ℃)的响应情况,探索艾灸效应的温度差异及其可能机制,确保了实验的可靠性。
结果表明,TRPV1敏感性神经元对不同温度艾灸“足三里”都可以响应,但是响应的方式和特征存在明显差异。
首先,对不同温度艾灸干预响应TRPV1敏感性神经元放电频率不同。如响应41 ℃艾灸干预的TRPV1敏感性神经元平均放电频率为(8.26±2.14)spikes/s,响应45 ℃艾灸干预的TRPV1敏感性神经元,平均放电频率为(4.69±2.61)spikes/s,响应49 ℃艾灸干预的TRPV1敏感性神经元,平均放电频率为(10.66±5.97)spikes/s。,对不同温度艾灸干预响应的TRPV1敏感性神经元数总和大于TRPV1敏感性神经元的总数。如在46个TRPV1敏感性神经元中,响应41 ℃艾灸刺激的有24个,响应45 ℃的21个,响应49 ℃的20个,提示某个放电频率特征的TRPV1敏感性神经元可能响应2个或2个以上温度的艾灸刺激。
其次,TRPV1敏感性神经元对不同温度艾灸的响应方式不同。41 ℃艾灸干预对TRPV1敏感性神经元既有抑制作用也有兴奋作用且两者神经元数目接近,并且对放电频率影响不大。而45 ℃和49 ℃艾灸则主要表现为兴奋作用,对放电频率影响也较大,艾灸前后放电频率显著升高(P<0.01)。值得关注的是,本研究中脊髓背角TRPV1敏感性神经元也响应41 ℃艾灸干预,这与一般认为的高于43 ℃温度激活TRPV1不符,并且45 ℃艾灸干预全面表现为兴奋,且干预后放电频率上升最大。而49 ℃艾灸干预在兴奋占优势的同时,少数神经元还出现了抑制,进一步提示脊髓背角TRPV1敏感性神经元艾灸响应具有温度差异性。
瞬时感受器电位(transient receptor potential,TRP)家族是机体重要的温度感受器,包括TRPV、TRPC、TRPA等多个家族成员,感受不同的温度区间。有研究表明TRPV1可以和其他的家族成员共表达于同一个神经元:如TRPV1和TRPA1共表达于同一个神经元且其活性受TRPV1和TRPA1通道共同调制[16],Weng H J等[17]也在DRG神经元中发现TRPV1和TRPA1复合体。TRPV1敏感性神经元对不同温度的响应特征是否与这一机制相关,还需进一步的实验研究。
脊髓背角TRPV1敏感性神经元是感知外周温热刺激和调控中枢热反应的主要环节之一,对不同温度艾灸干预作出相应的初级中枢响应,是其产生生物学效应的基础。我们分别选择了代表温和热温度的41 ℃、代表较低温伤害性热温度的45 ℃、代表较高温伤害性热温度的49 ℃进行艾灸干预,发现了艾灸温度参数与TRPV1机制的部分规律。该研究还需进一步扩大干预温度的范围并在温度参数上进一步精细化,从而进一步研究艾灸脊髓效应的温度梯度。
参考文献:
[1] 张建斌,王玲玲,胡玲,等.艾灸温通作用的理论探讨[J].中国针灸, 2011,31(1):51-54.
[2] 韩济生.神经科学[M].北京:北京大学医学出版社,2009:677.
[3] 吴楠,张丹龙,衡立军,等.TRPV1与pJNK在树脂毒素致痛模型大鼠脊髓背角的表达变化[J].神经解剖学杂志,2015,31(2):155-160.
[4] KOBAYASHI K, FUKUOKA T, OBATA K, et al. Distinct expression of TRPM8, TRPA1, and TRPV1 mRNAs in rat primary afferent neurons with aδ/c-fibers and colocalization with trk receptors[J]. Journal of Comparative Neurology,2005,493(4):596-606.
[5] STANDER S, MOORMANN C, SCHUMACHER M, et al. Expression of vanilloid receptor subtype 1 in cutaneous sensory nerve fibers, mast cells, and epithelial cells of appendage structures[J]. Experimental Dermatology,2004,13(3):129-139.
[6] JULIUS D. TRP channels and pain[J]. Annual Review of Cell and Developmental Biology,2013,29(1):355-384.
[7] ZEILHOFER H U, KRESS M, SWANDULLA D. Fractional Ca2+ currents through capsaicin- and proton-activated ion channels in rat dorsal root ganglion neurones[J]. Journal of Physiology,2010, 503(1):67-78.
[8] WANG L, WANG D H. TRPV1 gene knockout impairs postischemic recovery in isolated perfused heart in mice[J]. Circulation, 2005,112(23):3617-3623.
[9] BREYNE J, VANHEEL B. Methanandamide hyperpolarizes gastric arteries by stimulation of TRPV1 receptors on perivascular CGRP containing nerves[J]. Journal of Cardiovascular Pharmacology, 2006,47(2):303-309.
[10] 高建蕓,王桂英,王玲玲.TRPV1介导不同温度艾灸调脂通脉效应的临床研究[J].时珍国医国药,2015,26(9):2182-2184.
[11] 李忠仁.实验针灸学(第二版)[M].北京:中国中医药出版社,2007:255-256.
[12] 李美罗,李垠和,吴焕淦,等.灸法治疗高血压的研究概述[J].环球中医药,2012,5(2):142-147.
[13] 尹仁,吴焕淦,李璟,等.艾灸法治疗高脂血症并动脉粥样硬化研究进展[J].中国中医药信息杂志,2011,18(11):104-107.
[14] 张泽,陈民,吴文胜,等.基于Meta分析的艾灸治疗冠心病心绞痛临床疗效评价[J].南京中医药大学学报,2015,31(2):183-186.
[15] 刘乡,黄平波.辣椒素阻断腓总神经C纤维的效应及其对电针“足三里”镇痛作用的影响[J].针刺研究,1997,22(4):295.
[16] MASUOKA T, KUDO M, YAMASHITA Y, et al. TRPA1 channels modify TRPV1-mediated current responses in dorsal root ganglion neurons[J]. Frontiers in Physiology,2017,8:272.
[17] WENG H J, PATEL K N, JESKE N A, et al. Tmem100 is a regulator of TRPA1-TRPV1 complex and contributes to persistent pain[J]. Neuron,2015,85(4):833.
(收稿日期:2017-08-15)
(修回日期:2017-08-31;编辑:华强)

