不同中医证型原发性失眠患者肠道菌群差异研究
骆杰伟 吴永希 黄昉萌 陈炜玮 朱耀彬 魏世超 郑星宇 杨笑
摘要:目的 通过高通量16S rDNA测序,探讨不同中医证型原发性失眠患者肠道菌群差异。方法 选择原发性失眠患者65例,按中醫证型分为肝郁化火组22例、心脾两虚组17例、阴虚火旺组26例,健康体检者47例为对照组。采用高通量16S rDNA测序方法分析患者便菌群结构,QIIME软件与R语言stats包等分析菌群差异。结果 共得到1226个不同的基因序列分类单元(OTUs),4组间差异有统计学意义的OTUs共180个(P<0.05),表明样品有丰富的菌落。肝郁化火组、阴虚火旺组测序序列的定位个数多于心脾两虚组及对照组(P<0.05)。非加权UniFrac分析显示,组间差异显著大于组内差异,表明分组有意义(R=0.103,P=0.002),提示肠道菌群多样性与失眠不同证型高度相关。属水平在不同组间明显差异共57个属(P<0.05),所有物种水平不同组间明显差异共115个物种(P<0.05)。对照组优势菌属包括:普雷沃氏菌属(prevotella)、巨单胞菌属(megamonas)、梭菌属(clostridium Ⅺ、clostridiuum ⅩⅧ)、魏斯氏菌属(weissella)、拟普雷沃氏菌属(alloprevotella);肝郁化火组优势菌属包括:考拉杆菌属(phascolarctobacterium)、黄杆菌属(flavonifractor)、埃格特菌属(eggerthella)、嗜胆菌属(bilophila);心脾两虚组优势菌属包括:鞘氨醇单胞菌属(sphingomonas)、甲基杆菌属(methylobacterium);阴虚火旺组优势菌属包括:拟杆菌属(bacteroides)、副拟杆菌属(parabacteroides)、parasutterella、butyricimonas、odoribacter。结论 原发性失眠患者具有丰富的肠道菌群多样性及不同菌群结构,可能影响着不同中医证候的发生、发展及结局。
关键词:原发性失眠;中医证候;16S rDNA测序;肠道菌群
DOI:10.3969/j.issn.1005-5304.2018.04.007
中图分类号:R256.23 文献标识码:A 文章编号:1005-5304(2018)04-0028-07
Abstract: Objective To explore structural differences of intestinal flora in primary insomnia patients with different TCM syndromes through the high-throughput 16S rDNA sequencing analysis. Methods Totally 65 patients with primary insomnia were divided into 22 patients with syndrome of liver depression transforming into fire, 17 patients with deficiency of both heart and spleen syndrome, 26 patients with syndrome of hyperactivity of fire due to yin deficiency, with 47 cases of healthy people as the control group. The fecal flora structure of the subjects was analyzed by high-throughput 16S rDNA sequencing. QIIME software and R language stats package were used to analyze the diversity of flora. Results Totally 1226 different operational taxonomic units (OUTs) were obtained, and there were 180 significant differences among the 4 groups (P<0.05), indicating that the samples were rich in microbial colonies. The mapped reads in group of liver depression transforming into fire and hyperactivity of fire due to yin deficiency were more than the group of deficiency of both heart and spleen and the control group (P<0.05). Unweighted UniFrac analysis showed that the difference among groups was remarkably greater than the difference within group, and the grouping was statistically significant (R=0.103, P=0.002). It suggested that the diversity of intestinal flora was highly correlated with different TCM syndromes of insomnia. There were a total of 57 genera found significant differences among the different groups at the genus level (P<0.05), and 115 species at all species level. The dominant flora of the control group were prevotella, megamonas, clostridium Ⅺ (clostridium ⅩⅧ), weissella, and alloprevotella; The dominant flora of liver depression transforming into fire syndrome were phascolarctobacterium, flavonifractor, eggerthella, and bilophila; The dominant flora of deficiency of both heart and spleen syndrome were sphingomonas and methylobacterium; The dominant flora in hyperactivity of fire due to yin deficiency syndrome group were bacteroides, parabacteroides, parasutterella, butyricimonas, odoribacter. Conclusion The patients with primary insomnia have abundant intestinal flora diversity and diverse flora structure, which may affect the occurrence, development and outcome of different TCM syndromes.
Keywords: primary insomnia; TCM syndromes; 16S rDNA sequencing; intestinal flora
人體微生物组是指在人体内或表面存在的生态群落中共生、共栖和致病的微生物的总称,由Lederberg J等[1]最先提出。广义人类基因的范畴包括人类基因组和微生物组组合,人的新陈代谢功能具有人与微生物的特性。人体的共生微生物群被认为是“人体第二基因组”。在许多案例中微生物被推定为变异原因,可以影响宿主表型[2]。只有人体基因组与微生物组和谐统一,才能实现人体阴平阳秘。失眠是人群中最常见的精神障碍之一,本研究通过肠道菌群细菌16S rDNA的V3、V4区域的高通量测序[3-4],探讨不同证型失眠的菌群多样性特征,现报道如下。
1 资料与方法
1.1 一般资料
选择2015年12月-2017年1月福建省立医院原发性失眠患者65例。平均年龄(49.04±11.70)岁;中位病程6(2.5~15)年;男性31例,女性34例;肝郁化火证22例(男女各11例)、心脾两虚证17例(男8例,女9例)、阴虚火旺证26例(男12例,女14例)。收集同期福建省立医院体检中心健康体检者47例为对照组,平均年龄(48.62±12.98)岁;男性24例,女性23例。失眠患者与对照组的年龄、性别比较差异无统计学意义(P>0.05),具有可比性。本研究经福建省立医院医学伦理委员会批准(K2015-012-01)。
1.2 西医诊断标准
参照《中国失眠防治指南》[5]制定原发性失眠症相关标准。在睡眠机会和环境均良好、充分的条件下,发生以失眠症状为主的睡眠质量不满意状况,包括难以入眠、睡眠不深、多梦、醒后不易再睡,早醒,或自觉睡眠明显不足等。
1.3 中医辨证标准
参照《中医内科学》[6]制定中医辨证标准。由固定的3位中医副主任医师辨证一致,予以确认。①肝郁化火证:急躁易怒,不寐多梦,甚至彻夜不眠,伴有头晕头胀,目赤耳鸣,口干而苦,不思饮食,便秘溲赤。舌红苔黄,脉弦而数。②心脾两虚证:多梦易醒,心悸健忘,神疲食少,头晕目眩,伴有四肢倦怠,面色少华。舌淡苔薄,脉细无力。③阴虚火旺证:心悸不安,心烦不寐,腰酸足软,伴头晕,耳鸣,健忘,遗精,口干津少,五心烦热。舌红少苔,脉细而数。
1.4 纳入标准
①符合上述西医诊断及中医辨证标准者;②受试者对本研究知情,并签属知情同意书。
1.5 排除标准
①躯体疾病或大脑精神、意识功能障碍等所致的继发性失眠;②患有糖尿病、血液病、心力衰竭、肾衰、感染性疾病等基础疾病;③患有肝炎、结核病等传染性疾病;④有吸烟和饮酒嗜好者;⑤不能进行正常交流及合作者;⑥有放化疗史者。
1.6 方法
1.6.1 粪便样品采集、DNA提取
检查前1 d禁酒及药物,检查前8 h禁食。晨起7时取粪便样本,样本取备按照流程HMP手册(Version 12.0,Accession:phd003190.2)。分装后立即置于-80 ℃冰箱。DNA提取严格按MoBio PowerSoil DNA Isolation Kit说明书进行。采用16s rRNA通用引物27F/1492R(27F:5'-AGAGTTTGATCMTGGCTCAG-3',1492R:5'-TACGGYTACCTTGTTACGACTT-3')对提取的DNA样品进行PCR扩增,用Thermo Nano Drop 2000及琼脂糖凝胶电泳质控PCR产物,27F、1492R引物由Lifetech/Thermo合成。
1.6.2 16s rDNA基因V3、V4区测序
PCR扩增和产物纯化后,经文库质检合格,使用Qubit进行文库定量,根据每个样品数据量要求,进行相应比例的混合均一化。用16S特定引物扩增特异可变区V3、V4区域,得425 bp扩增片段。加接头(adeptor linkage),采用MiSeq PE300测序,应用PANDAseq软件拼接配对双端的reads[7]。经过拼接处理后,得到较长碱基序列(clean reads),进行16S分析。细菌16S rDNA的测序引物,U341:CCTACGG GRSGCAGCAG,U806:GGACTACVVGGGTATCT AATC[3-4]。由上海锐翌生物科技有限公司进行测序。
1.6.3 基因序列分类单元聚类
将序列完全一样的clean reads归为1种tag,统计每条tag对应的丰度(即reads数目),根据tags丰度大小进行排序。因为singletons(对应reads只有1条的序列)可能由于测序错误造成,故去除该部分序列,不进行后期基因序列分类单元(OTUs)聚类。利用usearch在0.97相似度下进行聚类,对聚类后的序列进行嵌合体过滤,得到用于物种分类的OUT,将所有clean reads比对到OTUs序列上,比对上OTUs的reads提取出来得到最终的mapped reads[8]。利用Ribosomal Database Project(RDP)数据库,比对该代表序列与已知物种的16S DNA,对每个OTUs进行物种归类[9]。
1.6.4 样品复杂度分析与统计学方法
用QIIME软件分析Alpha多样性与Beta多样性[10],采用迭代算法,分别在加权物种分类丰度信息和不加权物种分类丰度信息的情况下进行差异计算,做出组间的距离box图。2组间差异分析采用R语言stats包的wilcox.test函数,多组间差异分析采用R语言kruskal.test函数。
2 结果
2.1 Alpha多样性分析
Alpha多样性反映单个样品的物种多样性,包括observed species指数、chao1指数、PD whole tree指数等[10]。observed species和chao1指数反映样品中群落的丰富度(species richness),如样品中物种多样性较高,显示较多未被测序检测到的物种。Shannon指数、simpson指数反映的是群落的多样性(species diversity)。PD whole tree指数反映了样品中物种对进化历史保存的差异,PD whole tree指数越大说明物种对进化历史保存的差异越大。4组间诸种指数差异不明显(P>0.05)。见表1。
2.2 基因序列分类单元分析
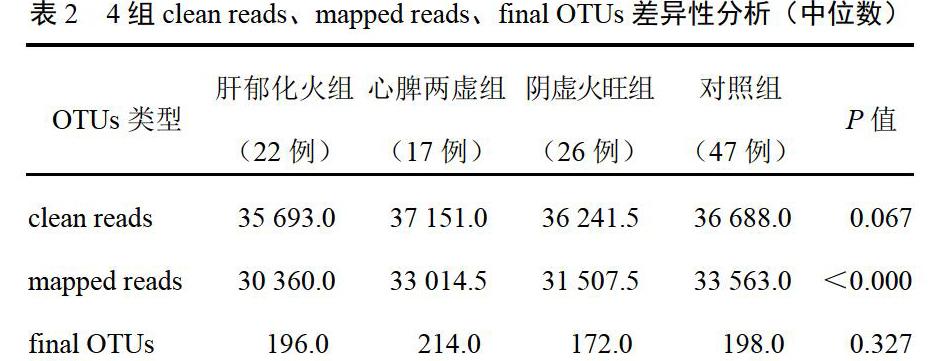
OTUs的丰度初步说明了样品的物种丰富程度。kruskal.test检验提示肝郁化火组、阴虚火旺组样本的mapped reads较心脾两虚组、对照组多(P<0.05),说明前2组具有更多的物种多样性,见表2。本研究共得到1226个不同的OTUs,4组差异有统计学意义的OTUs有180个(P<0.05)。
2.3 样本复杂性与显著性差异分析
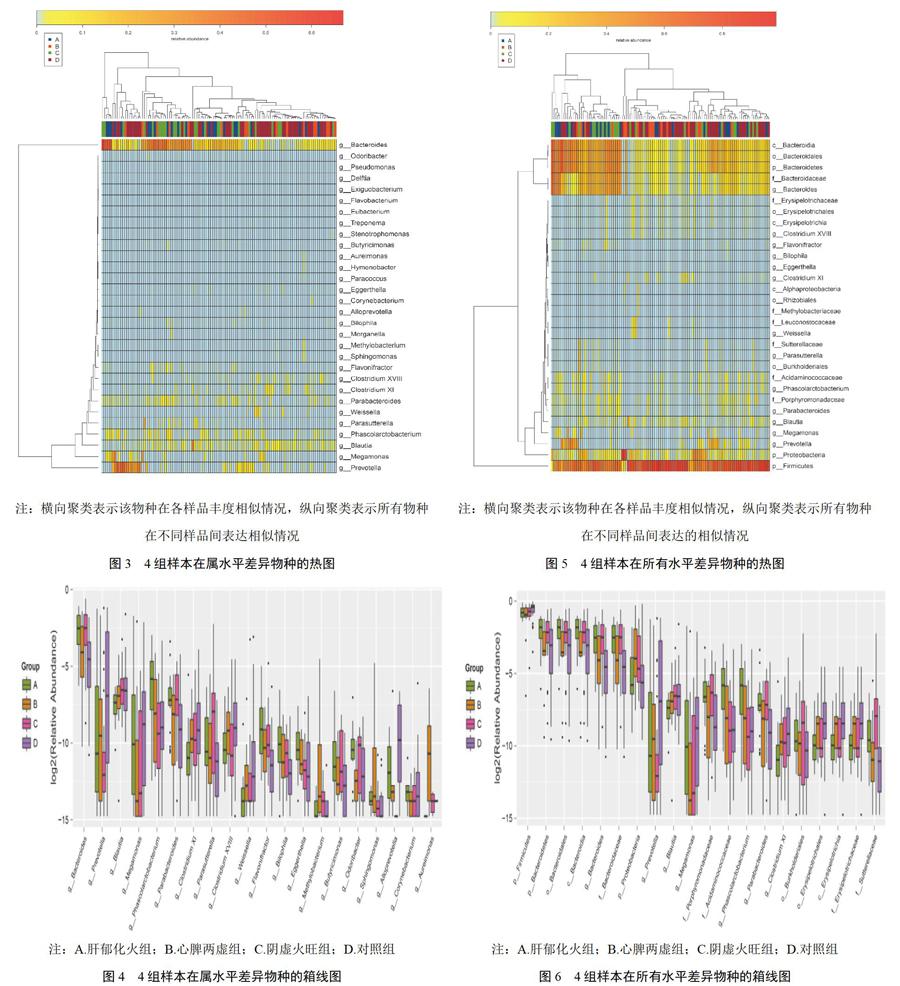
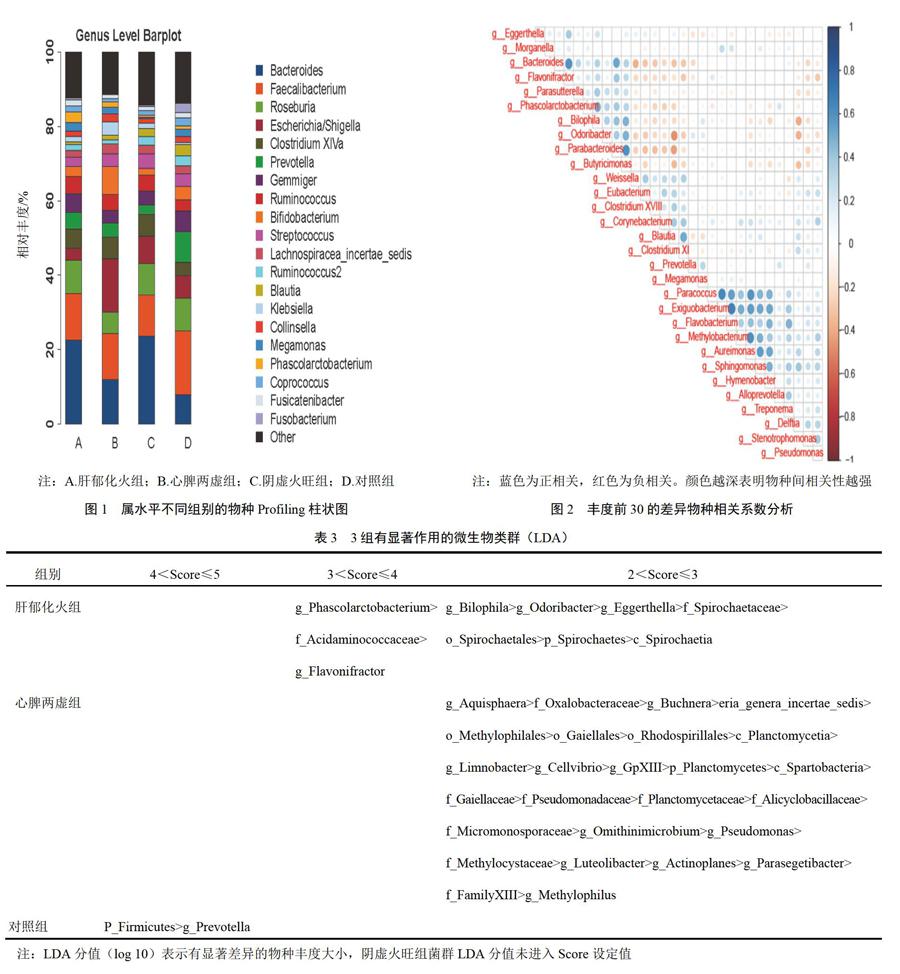
物种profiling柱状图可直观显示各样本的物种及其丰度,初步显示各组物种差异。在属水平,各样本丰度高的前20物种profiling柱状图,见图1。选择丰度前30的差异物种,通过R软件corrplot包绘制优势物种间spearman相关性热图,通过该热图发现优势物种之间重要的模式与关系。种间关系会影响物种丰度,从属水平反映各菌属的共生、拮抗关系的强弱,见图2。相似性分析(Anosim分析)检验,即非加权UniFrac,显示组间差异显著大于组内差异,分组有意义(非加权R=0.103,P=0.002)。可见,肠道微生物的不同多样性与失眠不同中医证型呈现高度相关。
LDA EffectSize(LEfSe)Tools采用线性判别分析(LDA)估算每个组分(物种)丰度对差异效果影响的大小,找出对样品归类产生显著性差异影响的群落或物种[11]。本研究4组间有差异物种见表3。通过Kruskal-Wallis test分析,属水平找出在不同组间有明顯差异共57个属(P<0.05),其中部分属种热图(heatmap)、箱线图(boxplot)见图3、图4。所有物种水平可以找出在不同组间有明显差异共115个物种(P<0.05),其中部分属种热图、箱线图见图5、图6。分析可见,对照组优势菌属有普雷沃氏菌属(prevotella)、巨单胞菌属(megamonas)、梭菌属(clostridiumⅪ、clostridiuumⅩⅧ)、魏斯氏菌属(weissella)、拟普雷沃氏菌属(alloprevotella)等菌属;肝郁化火组优势菌属有考拉杆菌属(phascolarctobacterium)、黄杆菌属(flavonifractor)、埃格特菌属(eggerthella)、嗜胆菌属(biophila)等菌属;心脾两虚组优势菌属有鞘氨醇单胞菌属(sphingomonas)、甲基杆菌属(methylobacterium)等菌属;阴虚火旺组优势菌属有拟杆菌属(bacteroides)、副拟杆菌属(parabacteroides)、parasutterella、butyricimonas、odoribacter等。
3 讨论
《素问·逆调论篇》言:“胃不和则卧不安。”中医学早已认识到胃肠道功能与睡眠障碍密切相关。近年来,随着测序技术的发展,肠道菌群与精神神经疾病的相关性得到广泛关注。如孤独症、帕金森病、精神分裂症、抑郁症、阿尔茨海默病、神经退行性疾病等常伴有肠道菌群失调,二者互相影响。若患者长期失眠,处于焦虑、抑郁等应激状态下,则影响肠道菌群动态平衡[12]。本研究发现,考拉杆菌属、嗜胆菌属等为失眠肝郁化火证优势菌属,而考拉杆菌属为定植在肠道内条件致病菌。有研究表明,其丰度与抑郁症、肠易激综合征及阳虚质有关[13]。研究发现,抑郁症患者颤杆菌属、嗜胆菌属的丰度明显升高,普雷沃氏菌属、粪球菌属(coprococcus)丰度下降[14];普雷沃氏菌属在本研究为对照组的优势菌群,可见在失眠肝郁化火证中为劣势。有报道,脑卒中后抑郁症患者肠道菌群结构异常,以考拉杆菌属、颤杆菌属(oscillibacter)、parasutterella为优势菌属[15]。本研究显示,parasutterella、拟杆菌属、副拟杆菌属等为失眠阴虚火旺证优势菌属。褪黑色素是睡眠与觉醒调节的重要物质之一,用褪黑素复合制剂后,肠道内拟杆菌属较前明显下降[16],可见失眠与菌群结构失调明显相关。
动物实验亦表明,疾病、精神行为与肠道菌群也有密切关系。在相对缺乏脑源性神经营养因子(BDNF)的小鼠中,迷走神经发育发生变化可能影响肠道菌群[17],口服抗生素后肠道菌群拟杆菌属含量升高,而副拟杆菌属、颤螺菌属(oscillospira)、考拉杆菌属含量下降,影响大脑BDNF表达。恢复肠道菌群后,可恢复脑功能[18]。而拟杆菌属、副拟杆菌属等为本研究中失眠阴虚火旺证优势菌属,考拉杆菌属为失眠肝郁化火证优势菌属,这些菌群失衡参与了疾病的发生发展。肠道菌群失衡影响精神行为,又如当无菌小鼠(GF)BALB/c、NIHSwiss接种同种小鼠的肠道菌群后,其行为与同种小鼠的行为类似,但接种不同种小鼠的肠道菌群后,其行为则受肠道菌群供体源小鼠的影响,表现出与供体小鼠相类似的行为[19]。从而说明肠道菌群可直接调控大脑功能,影响生物行为。动物实验亦发现,孕期母体高脂肪饮食导致子代肠道内乳酸杆菌缺乏,出现社交缺陷及脑奖赏环路突触强化功能缺陷,通过后期定植乳酸杆菌可改善[20]。肠道梭形杆菌数量减少会引起小鼠应激能力减弱[21]。也有发现空肠弯曲杆菌感染小鼠后,迷走神经张力增加,大脑中神经元激活标志物c-Fos表达增加,导致感染小鼠出现焦虑行为[22]。
人体共栖的肠道菌群引起疾病的机制尚不清楚。目前研究认为,微生物可能通过下丘脑-垂体-肾上腺轴(HPA轴)或直接影响肠道上皮的通透性,诱导炎症反应及胰岛素抵抗等[23-24],肠道微生物也可通过复杂的肠-脑轴机制影响人的情绪、行为等。失衡的菌群可能引起或加重大脑组织中的脑神经元损伤,影响宿主行为和大脑功能。通过人为改变实验动物原有的肠道菌群结构,其焦虑抑郁状态、认知行为及神经系统发育与正常动物有明显区别[25-26]。BDNF广泛分布于大脑中枢神经系统内,对神经元的生长发育、分化及存活有较大影响。在GF海马等区域的BDNF蛋白、mRNA表达明显降低,常伴有HPA轴发育异常,对应激反应、认知发生改变[25,27-29]。GF的5-羟色胺(5-HT)和谷氨酸受体的表达也出现异常[30]。5-HT影响情绪、自主功能、神经肌肉及内脏功能,肠道菌群及其代谢产物也影响体内5-HT产生。5-HT表达主要与产芽孢细菌密切相关[31]。颤杆菌属是定植于肠道内的厌氧条件致病菌,与抑郁症、心脑血管疾病以及肠道菌群代谢产物血浆氧化三甲胺(TMAO)的合成与代谢相关[13,32]。目前大多认为,血浆TMAO升高是心血管危险因素。中枢神经系统的活动与免疫系统密切相关,长期定植于宿主体内的共生菌群免疫系統会自动识别侵入肠道内病原菌,产生免疫反应,是通过肠上皮细胞启动及传导的信号如Toll样受体来实现[33-34]。此外,相关细菌也可以促进免疫功能,如肠道微生物中的分节丝状菌、拟杆菌、梭形菌等促进了T细胞分化,产生肠道强大的先天性、适应性免疫应答[35]。肠道内共有多种与肠内分泌相关的细胞,通过HPA轴联系中枢,应激时皮质醇释放,作用于肠道,影响免疫、肠道黏膜渗透性及肠道屏障功能,改变菌群构成。反之,失调的肠道菌群也可通过HPA轴调控大脑功能,支配肠道内外的神经共同形成多条反射回路来调控肠道活动与应激反应。
综上所述,肠道菌群的改变可能是引起精神性疾病如失眠的危险因子,或失眠导致肠道菌群结构的改变,二者互相影响则表现出不同中医证候特征,如大便性状的改变。
参考文献:
[1] LEDERBERG J, MCCRAY A T. ‘Ome Sweet' omics - a genealogical treasury of words genealogical treasury of words[J]. Scientist, 2001,15(7):8.
[2] MOON C, BALDRIDGE M T, WALLACE M A, et al. Vertically transmitted faecal IgA levels determine extra-chromosomal phenotypic variation[J]. Nature,2015,521(7550):90-93.
[3] WANG Y, QIAN P Y. Conservative fragments in bacterial 16S rRNA genes and primer design for 16S ribosomal DNA amplicons in metagenomic studies[J]. PLoS One,2009,4(10):e7401.
[4] ZAKRZEWSKI M, GOESMANN A, JAENICKE S, et al. Profiling of the metabolically active community from a production-scale biogas plant by means of high-throughput metatranscriptome sequencing[J]. J Biotechnol,2012,158(4):248-258.
[5] 杨甫德,陈彦方.中国失眠防治指南[M].北京:人民卫生出版社,2012:99-105.
[6] 王永炎.中医内科学[M].上海:上海科学技术出版社,2002:132-135.
[7] MASELLA A P, BARTRAM A K, TRUSZKOWSKI J M, et al. PANDAseq: paired-end assembler for illumina sequences[J]. BMC Bioinformatics, 2012,13(1):31.
[8] EDGAR R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nat Methods,2013,10(10):996-998.
[9] MCDONALD D, PRICE M N, GOODRICH J, et al. An improved greengenes taxonomy with explicit ranks for ecological and evolutionary analyses of bacteria and archaea[J]. ISME J,2012,6(3):610-618.
[10] KEMP P F, ALLER J Y. Bacterial diversity in aquatic and other environments:what 16S rDNA libraries can tell us[J]. FEMS Microbiol Ecol,2004,47(2):161-177.
[11] SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biol,2011,12(6):R60.
[12] 談永进,李云,周明眉,等.应激状态下机体与肠道菌群的相互作用及天然多酚干预作用研究[J].中国微生态学杂志,2016,28(4):485-488.
[13] 吴倩倩.肠易激综合征患者肠道菌群的流行病学研究[D].扬州:扬州大学,2016.
[14] 张金娜.肠道微生物与抑郁症的关联性研究[D].昆明:昆明医科大学,2013.
[15] 范文涛,闫咏梅,别玉龙,等.脑卒中后抑郁症患者肠道菌群的多样性分析[J].南方医科大学学报,2016,36(10):1305-1311.
[16] 张连龙,常蜀英,周晓江,等.褪黑素/低聚糖对老年人肠道菌群影响的临床研究[J].临床合理用药杂志,2009,2(3):5-6.
[17] MURPHY M C, FOX E A. Mice deficient in brain-derived neurotrophic factor have altered development of gastric vagal sensory innervation [J]. J Comp Neurol,2010,518(15):2934-2951.
[18] 陈凤.口服抗生素改变大鼠肠道菌群和大脑海马脑源性神经营养因子的表达及其恢复[D].大连:大连医科大学,2015.
[19] BERCIK P, DENOU E, COLLINS J, et al. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice[J]. Gastroenterology,2011,141(2):599-609,e1-3.
[20] BUFFINGTON S A, DI PRISCO G V, AUCHTUNG T A, et al. Microbial reconstitution reverses maternal diet-induced social and synaptic deficits in offspring[J]. Cell,2016,165(7):1762-1775.
[21] BAILEY M T, DOWD S E, GALLEY J D, et al. Exposure to a social stressor alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation[J]. Brain Behav Immun,2011,25(3):397-407.
[22] GOEHLER L E, PARK S M, OPITZ N, et al. Campylobacter jejuni infection increases anxiety-like behavior in the holeboard:possible anatomical substrates for viscerosensory modulation of exploratory behavior[J]. Brain Behav Immun,2008,22(3):354-366.
[23] TREMAROLI V, B?CKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature,2012,489(7415): 242-249.
[24] MAYER E A, TILLISCH K, GUPTA A. Gut/brain axis and the microbiota[J]. J Clin Invest,2015,125(3):926-938.
[25] GAREAU M G, WINE E, RODRIGUES D M, et al. Bacterial infection causes stress-induced memory dysfunction in mice[J]. Gut,2011, 60(3):307-317.
[26] BRAVO J A, FORSYTHE P, CHEW M V, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve[J]. Proc Natl Acad Sci U S A,2011,108(38):16050-16055.
[27] SUDO N, CHIDA Y, AIBA Y, et al. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice[J]. J Physiol,2004,558(Pt1):263-275.
[28] DIAZ HEIJTZ R, WANG S, ANUAR F, et al. Normal gut microbiota modulates brain development and behavior[J]. Proc Natl Acad Sci USA,2011,108(7):3047-3052.
[29] CLARKE G, GRENHAM S, SCULLY P, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner[J]. Mol Psychiatry,2013,18(6):666-673.
[30] SUDO N, CHIDA Y, AIBA Y, et al. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice[J]. J Physiol,2004,558(Pt1):263-275.
[31] YANO J M, YU K, DONALDSON G P, et al. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis[J]. Cell, 2015,161(2):264-276.
[32] 王珊,夏耿红,何彦,等.氧化三甲胺分布特征及其与肠道菌群的关联性[J].南方医科大学学报,2016,36(4):455-460.
[33] ARTIS D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut[J]. Nat Rev Immunol, 2008,8(6):411-420.
[34] MEDZHITOV R. Recognition of microorganisms and activation of the immune response[J]. Nature,2007,449(7164):819-826.
[35] CERF-BENSUSSAN N, GABORIAU-ROUTHIAU V. The immune system and the gut microbiota:friends or foes?[J]. Nat Rev Immunol,2010, 10(10):735-744.
(收稿日期:2017-09-14)
(修回日期:2017-10-22;編辑:季巍巍)

