姜黄素超分子包合物的 体外抗肿瘤活性评价
陈建平,庞艺萌,刘 颖,刘 海,钟赛意,谌素华,秦小明,*
(1.广东海洋大学食品科技学院,广东省亚热带果蔬加工现代农业科技创新中心,广东湛江 524088;2.广东省天然产物绿色加工与产品安全重点实验室,广东广州 510640;3.广东海洋大学农学院,广东湛江 524088)
姜黄素(Curcumin)是一种从姜黄根茎中提取出来的黄酮类化合物[1]。作为一种天然的食用色素,姜黄素是世界卫生组织和美国食品药品管理局以及多国准许使用的食品添加剂[2]。近年来,大量的临床研究表明,姜黄素具有抗肿瘤[3-4]、抗氧化[5-6]、抗炎[7-8]、清除自由基、抗衰老等诸多功效。然而,由于姜黄色素难溶于水,不便于注射给药,所以目前姜黄素的动物学实验研究以至临床实验研究多采用口服给药的方法。这一难溶性特点极大地限制了它在食品和医药中的应用价值。
β-环糊精(β-cyclodextrin)是由7个葡萄糖分子以α-1,4糖苷键连接而成的环状低聚糖化合物,是一种良好的包合材料[9-10]。研究表明,β-环糊精与姜黄素形成的包合物能有效诱导白血病细胞凋亡[11]。而且,Yallapu 等[12]也发现,相比单独的姜黄素,β-环糊精与姜黄素形成的包合物具有更好的抗肿瘤效果。然而,考虑到如果直接采用环糊精作为药物载体,存在其自身水溶性低的问题,因此,课题组前期应用超分子化学的理论,采用聚合反应把环糊精合成为具有水溶性良好的环糊精聚合物作为药物载体成功制备了姜黄素超分子包合物。目前国内外还未见有关姜黄素超分子包合物的抗肿瘤活性评价的报道。因此,为了对姜黄素超分子包合物的抗肿瘤活性进行评价,本文采用CCK8比色法检测姜黄素超分子包合物对A375黑色素瘤细胞、A549肺癌细胞、Hela宫颈癌细胞和MCF-7乳腺癌细胞四种肿瘤细胞生长的影响,并进一步运用Annexin-V/PI双染检测姜黄素超分子包合物抑制肿瘤细胞增殖的原因。该研究结果为姜黄素超分子包合物在抗肿瘤领域的应用提供了科学依据。
1 材料与方法
1.1 材料与仪器
姜黄素超分子包合物 实验室自制[13];胎牛血清、青霉素、链霉素 美国Gibco公司;RPMI-1640 美国Hyclone公司;Trysin-EDTA溶液 美国GENVIEW公司;Cell Counting Kit-8(CCK-8) Dojindo公司;Annexin V/PI细胞凋亡检测试剂盒 联科生物公司;96孔板细胞培养板 美国NEST公司;人黑色素瘤细胞A375、人肺癌细胞A549、人宫颈癌细胞Hela、人乳腺癌细胞MCF-7 美国ATCC公司。
BP301S电子天平 德国Sartorius公司;TDL-80-2B低速离心机 上海安亭科学仪器厂;INC108 CO2细胞培养箱 德国Memmer公司;Multiscan MK3酶联免疫监测仪 美国Thermo Fisher Scientific公司;FACSCalibur流式细胞仪 美国BD公司;倒置荧光显微镜 MOTIC公司。
1.2 实验方法
1.2.1 姜黄素超分子包合物的制备 参照陈建平[13]等的方法进行制备。称取15.76 g NaOH于三口烧瓶中,加32 mL H2O,搅拌溶解。再称取20 gβ-环糊精,加入三口烧瓶,搅拌全溶至澄清,在30 ℃下缓慢加入环氧氯丙烷(EPC)9.64 mL,搅拌24 h,冷却至室温。将反应液倒入锥形瓶中,超声5 min。将溶液倒入透析袋中(先用水润湿清洗,再用蒸馏水洗涤两次),放入盛有蒸烟水的大烧杯屮透析,开始时每小时换一次蒸馏水,之后延长时间更换水,透析至中性。将透析袋中溶液抽滤,滤去不溶物,然后用0.45 μm的纤维素膜过滤,过滤后进行旋蒸,蒸至粘稠状,加入无水乙醇析出白色固体,过滤,真空干燥,得环糊精聚合物。将姜黄素和环糊精聚合物按质量比1∶4混匀,加入研钵中研磨,研磨均匀后倒入锥形瓶中,加入50 mL水,超声5 min,功率120 W。将锥形瓶放磁力搅拌器上搅拌2 d后,将包合物溶液抽滤,除去未溶解的姜黄素,再将溶液进行旋蒸,真空干燥,即得水溶性姜黄素超分子包合物。
1.2.2 姜黄素超分子包合物的抗肿瘤活性测定
1.2.2.1 细胞培养 细胞复苏后培养在含10%胎牛血清,100 U/mL青霉素和50 U/mL链霉素的RPMI-1640完全培养液中。细胞置于培养箱中培养(37 ℃,5% CO2)72 h后,根据细胞的生长状态传代,取对数生长期细胞用于以下CCK-8实验。
1.2.2.2 CCK-8方法检测细胞生长曲线 取对数生长期的细胞进行实验,经细胞传代后,调整细胞密度至1×105/mL。将四种肿瘤细胞(A375细胞、A549细胞、Hela细胞、MCF-7细胞)以每孔100 μL接种于 96 孔培养板,置于培养箱中(37 ℃,5% CO2)培养 24 h。往不同的96孔板中分别加入不同浓度的姜黄素超分子包合物(0、40、80、160、320、640 μg/mL)。经不同浓度的姜黄素超分子包合物处理的五种肿瘤细胞分别培养 24、48和72 h后。采用倒置显微镜观察细胞的形态变化。然后,往96孔细胞培养板中加入CCK-8,每孔10 μL,放入37 ℃培养箱中孵育4 h 后,用酶联免疫检测仪在450 nm处测定各孔OD值,以空白对照组的OD值为100%,根据如下公式计算不同处理组中的细胞存活率[14]。每次实验重复三次。
细胞存活率的计算公式如式(1):
细胞存活率(%)=Ai/A0×100
式(1)
其中,Ai表示不同处理组的OD值;A0表示空白对照组的OD值。
1.2.2.3 比较姜黄素超分子包合物对四种肿瘤细胞处理不同时间后的IC50值 以各个浓度的细胞存活率为纵坐标,相应浓度的对数值为横坐标作散点图,进行线性拟合,得出线性方程。将存活率为 50%代入到线性方程中,从而计算出细胞的半数抑制浓度(IC50)。
1.2.3 Annexin-V/PI双染检测A375细胞凋亡 参考Zhang等的方法进行[15]。取A375对数生长期的细胞进行实验,经细胞传代后,调整细胞密度。以1×105细胞/孔接种于6孔板,置于培养箱中(37 ℃,5% CO2)培养24 h后,加入不同浓度的姜黄素超分子包合物(0、80、160、320、640 μg/mL)孵育72 h,然后,用胰酶将细胞消化下来,在1000 r/min下离心5 min,经PBS洗2次,收集细胞。经500 μL预冷的1×Binding Buffer悬浮细胞后,加入5 μL Annexin V-FITC混匀,然后再加入10 μL碘化丙啶(Propidium Iodide,PI)混匀,孵育15 min后,采用流式细胞仪在激发波长Ex=488 nm和发射波长Em=530 nm的条件下进行检测。
1.3 数据处理

2 结果与分析
2.1 姜黄素超分子包合物对A375黑色素瘤细胞生长的影响
不同浓度的姜黄素超分子包合物对A375细胞作用处理时间的实验结果见图1所示。由图1可知,当姜黄素超分子包合物处理A375细胞24 h后,随着姜黄素超分子包合物浓度的升高,细胞存活率从103.5%±2.6%降低到94.9%±1.1%。当处理时间增加到72 h时,随着姜黄素超分子包合物浓度的升高,细胞存活率从92.7%±0.9%降低到43.0%±1.2%。实验结果表明,在实验处理的时间和浓度范围内,A375细胞存活率均随姜黄素超分子包合物浓度的升高和处理时间的增加呈下降趋势。这种趋势的原因可能是由于姜黄素超分子包合物随着处理时间和浓度的增加,包合物可能被细胞吸收,当细胞内吸收的包合物达到一定量后,包合物可能会调控细胞内某些蛋白质的表达变化,从而引起细胞发生凋亡。
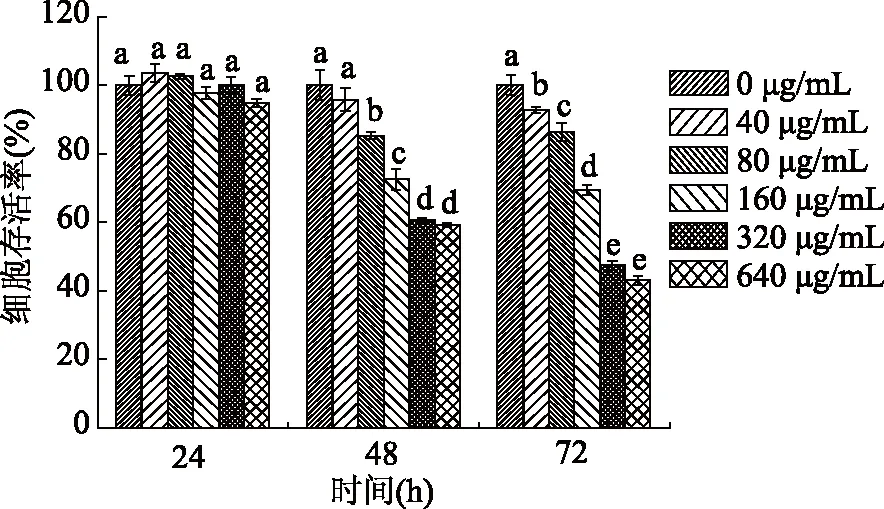
图1 不同浓度的姜黄素超分子包合物 对A375细胞处理不同时间后对其存活率的影响Fig.1 Effects of different concentration of curcumin/ β-cyclodextrin polymer inclusion complex on cell viability of A375 cells at different treatment times注:不同字母表示统计学上显著性差异(p<0.05),相同字母表示统计学上没有显著性差异;图2~图4同。
2.2 姜黄素超分子包合物对A549肺癌细胞生长的影响
不同浓度的姜黄素超分子包合物对A549细胞作用处理时间的实验结果见图2所示。由图2可知,当姜黄素超分子包合物处理A549细胞24 h后,随着姜黄素超分子包合物浓度的升高,细胞存活率从98.3%±2.2%降低到92.5%±2.3%。当处理时间增加到72 h时,随着姜黄素超分子包合物浓度的升高,细胞存活率从95.5%±4.3%降低到44.5%±1.2%。实验结果表明,在实验处理的时间和浓度范围内,A549细胞存活率均随姜黄素超分子包合物浓度的升高和处理时间的增加呈下降趋势。
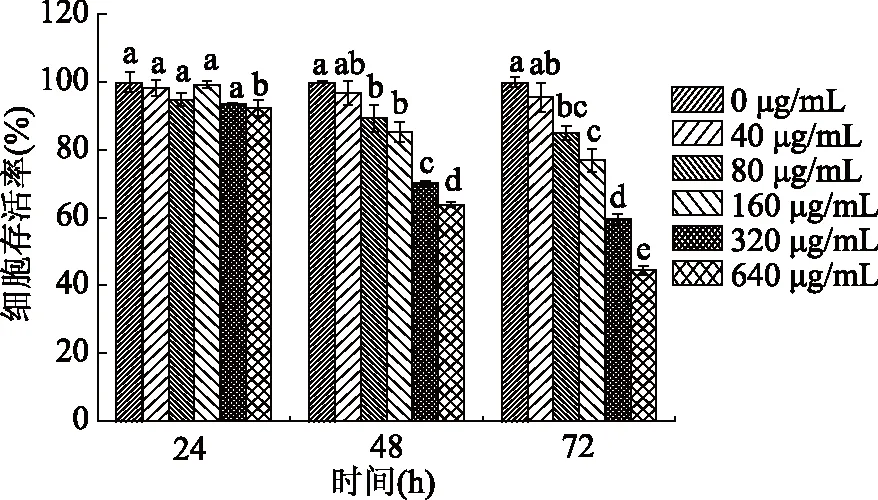
图2 不同浓度的姜黄素超分子包合物 对A549细胞作用处理时间后对其细胞存活率的影响。Fig.2 Effects of different concentration of curcumin/ β-cyclodextrin polymer inclusion complex on cell viability of A549 cells at different treatment times
2.3 姜黄素超分子包合物对Hela宫颈癌细胞生长的影响
不同浓度的姜黄素超分子包合物对Hela细胞作用处理时间的实验结果见图3所示。由图3可知,当姜黄素超分子包合物处理Hela细胞24 h后,随着姜黄素超分子包合物浓度的升高,细胞存活率从101.2%±2.1%降低到82.1%±2.1%。当处理时间增加到72 h时,随着姜黄素超分子包合物浓度的升高,细胞存活率从89.9%±4.1%降低到50.1%±1.6%。实验结果表明,在实验处理的时间和浓度范围内,Hela细胞存活率均随姜黄素超分子包合物浓度的升高和处理时间的增加呈下降趋势。
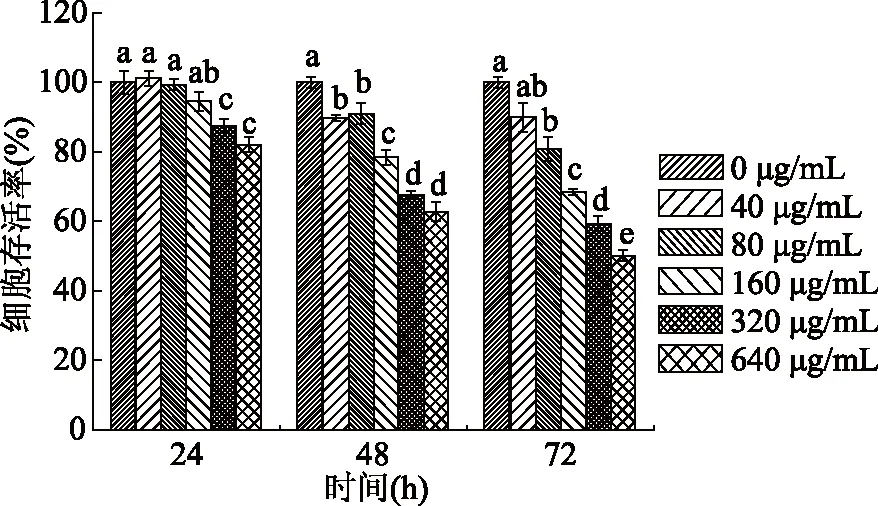
图3 不同浓度的姜黄素超分子包合物 对Hela细胞处理不同时间后对其细胞存活率的影响。Fig.3 Effects of different concentration of curcumin/ β-cyclodextrin polymer inclusion complex on cell viability of Hela cells at different treatment times
2.4 姜黄素超分子包合物对MCF-7乳腺癌细胞生长的影响
不同浓度的姜黄素超分子包合物对MCF-7细胞处理不同时间的实验结果见图4所示。由图4可知,当姜黄素超分子包合物处理MCF-7细胞24 h后,随着姜黄素超分子包合物浓度的升高,细胞存活率从96.5%±5.0%降低到77.4%±2.5%。当处理时间增加到72 h时,随着姜黄素超分子包合物浓度的升高,细胞存活率从95.7%±2.8%降低到59.4%±4.2%。实验结果表明,在实验处理的时间和浓度范围内,MCF-7细胞存活率均随姜黄素超分子包合物浓度的升高和处理时间的增加呈下降趋势。
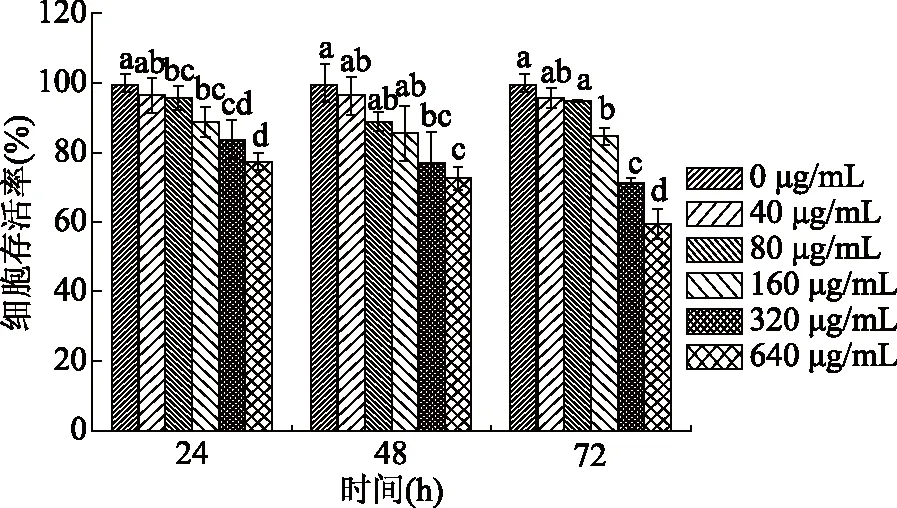
图4 不同浓度的姜黄素超分子包合物 对MCF-7细胞处理不同时间后对其细胞存活率的影响。Fig.4 Effects of different concentration of curcumin/ β-cyclodextrin polymer inclusion complex on cell viability of MCF-7 cells at different treatment times
2.5 姜黄素超分子包合物对四种肿瘤细胞处理不同时间后的IC50比较
为了更直观的比较姜黄素超分子包合物对这四种细胞的抗肿瘤活性作用,本文通过计算细胞的半数抑制浓度(IC50)来进行比较[16]。计算结果如表1所示。由表1可知,不同浓度的姜黄素超分子包合物(40~640 μg/mL)对A375细胞、A549细胞、Hela细胞和MCF-7细胞作用24 h后计算其IC50分别为2202.8、1830.8、1026.9和987.6 μg/mL,当处理时间增加到72 h后,发现其IC50分别下降到476.4、517.2、545.7和692.8 μg/mL,结果表明,随着处理时间的增加,姜黄素超分子包合物对四种细胞的IC50均呈下降趋势,且姜黄素超分子包合物对A375细胞处理72 h时,其IC50值达到最低为476.4 μg/mL,这表明姜黄素超分子包合物对A375细胞处理72 h时,抑制A375细胞增殖的能力最强。因此,本文选择对A375细胞处理72 h进行后续的细胞凋亡机理初探。
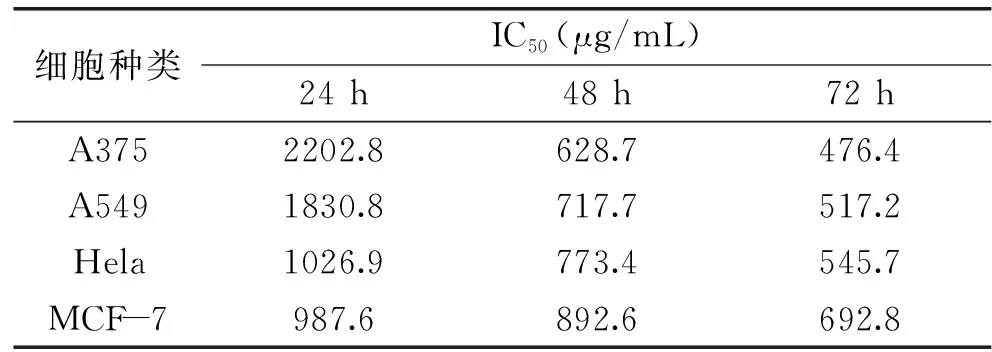
表1 姜黄素超分子包合物 对不同细胞作用不同时间的 IC50 值Table 1 IC50 of different cells exposed to curcumin/ β-cyclodextrin polymer inclusion complex for different times
2.6 Annexin-V/PI双染检测A375细胞凋亡
在抑制肿瘤细胞增殖的过程中,诱导细胞周期阻滞和/或诱导细胞凋亡往往是目前被认为抑制细胞增殖的主要原因[17-18]。为了进一步阐明姜黄素超分子包合物抑制肿瘤细胞增殖的机理,本文选择对姜黄素超分子包合物具有抑制作用最强的A375细胞作为研究对象,采用Annexin-V/PI 双染检测姜黄素超分子包合物对A375细胞的细胞凋亡情况。AnnexinV是一种与膜磷脂酰丝氨酸(PS)具有高度结合力的磷脂结合蛋白,而碘化丙啶(Propidium Iodide,PI)是一种不能透过正常细胞细胞膜的核酸染料。当细胞发生凋亡时,在凋亡早期,PS会由脂膜的内侧翻向外侧与凋亡早期细胞的胞膜结合,而在凋亡的中晚期,细胞和死细胞的细胞膜通透性增加,PI能够透过细胞膜而使细胞核染红,因此将Annexin V与PI匹配使用,就可以将处于早期凋亡细胞、死细胞和晚期凋亡细胞区分开来[19-20]。Annexin-V/PI 双染检测A375细胞凋亡的实验结果如图5所示。由图5可知,对照组中凋亡细胞数量为3.3%,当经80 μg/mL姜黄素超分子包合物处理A375细胞后,细胞凋亡数量从对照组的 3.3%上升到 20.7%。并且,当姜黄素超分子包合物的浓度提高到640 μg/mL时,其细胞凋亡总数从20.7%提高到35.0%。上述结果表明,姜黄素超分子包合物抑制A375细胞增殖主要是通过诱导细胞凋亡来实现的。
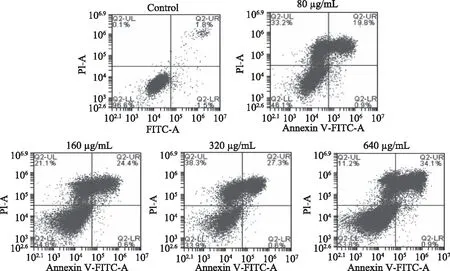
图5 不同浓度的姜黄素超分子包合物对A375细胞凋亡数目的影响。Fig.5 Effects of different concentration of curcumin/β-cyclodextrin polymer inclusion complex on population of apoptotic A375 cells
3 结论
本文采用CCK8比色法检测姜黄素超分子包合物对A375黑色素瘤细胞、A549肺癌细胞、Hela宫颈癌细胞和MCF-7乳腺癌细胞四种肿瘤细胞生长的影响。实验结果表明,姜黄素超分子包合物抑制四种肿瘤细胞的增殖均呈浓度和时间依赖性。而且,姜黄素超分子包合物对A375黑色素瘤细胞的抑制活性最强(72 h后的抑制率达到了43.0%±1.2%),其次是A549肺癌细胞(72 h后的抑制率达到了44.5%±1.2%),而对MCF-7乳腺癌细胞的抑制活性最弱(72 h后的抑制率达到了59.4%±4.2%)。并且,通过比较姜黄素超分子包合物对四种肿瘤细胞作用的IC50值也发现姜黄素超分子包合物抑制A375细胞增殖的能力最强,其IC50达到最低为476.4 μg/mL。运用Annexin-V/PI 双染进一步检测姜黄素超分子包合物抑制A375细胞增殖的原因,发现,姜黄素超分子包合物抑制A375细胞增殖主要是通过诱导细胞凋亡来实现的。然而,对于姜黄素超分子包合物如何诱导A375细胞凋亡的相关机制还不清楚,有待于下一步的研究。

