以高硫锰矿制备电池用硫酸锰的净化除杂工艺研究*
李昌新,李秋月,喻 源,钟 宏,王 帅
(1.南京工业大学安全科学与工程学院,江苏南京211816;2.中南大学化学化工学院;3.中南大学锰资源高效清洁利用湖南省重点实验室)
硫酸锰是一种重要的化工中间体,80%其他锰盐都是以硫酸锰为基础原料制得。同时,电池用硫酸锰主要应用于锂镍钴锰氧三元正极材料以及锰酸锂正极材料的合成,是近几年中国锰行业研究的热点[1]。
中国湖南郴州地区拥有大量的高硫锰矿,采用直接酸浸方法处理,会释放出大量的硫化氢气体,并且尾矿中锰品位低于18%,难以有效利用[2-3]。目前,尚无关于含锰尾矿利用方法的报道。中国一般采用堆存处理,但是堆存不仅占用大量土地资源,增加企业负担,而且对周边环境潜在威胁巨大,若管理不善,极易发生严重环境污染。本课题组研究表明,硫基还原氧化锰矿具有更大的反应趋势,针对高硫锰矿中含有大量的低价态硫元素,采用氧化锰矿与高硫锰矿联合焙烧不仅能固化高硫锰矿中的硫元素,而且能有效将软锰矿还原成酸溶性的锰化合物。
笔者以高硫锰矿与氧化锰矿的焙烧产物为研究对象,以稀硫酸浸出。由于焙烧产物在浸出过程中不仅溶解锰,其他物质(如 Al、Fe、Co、Ni等杂质)也会随着锰的浸出而进入浸出液中,因此浸出后所得的浸出液并不纯净。在实际生产过程中,需要对浸出液中的杂质进行除杂净化处理,以得到合格的硫酸锰溶液,从而制备得到电池用硫酸锰产品。
1 实验部分
1.1 实验矿样
本实验所用高硫锰矿产自湖南郴州某锰矿,实验之前经干燥、磨矿至粒度≤308 μm,其化学成分见表1。由于中国的矿样杂质总类多且含量高,考虑到后期浸出液净化过程的压力及产品费用,因此在本实验中氧化锰矿采用加蓬锰矿。该矿外观呈黑色,干燥,其化学成分见表1。由表1可知,加蓬氧化锰矿石锰品位高且杂质含量低。
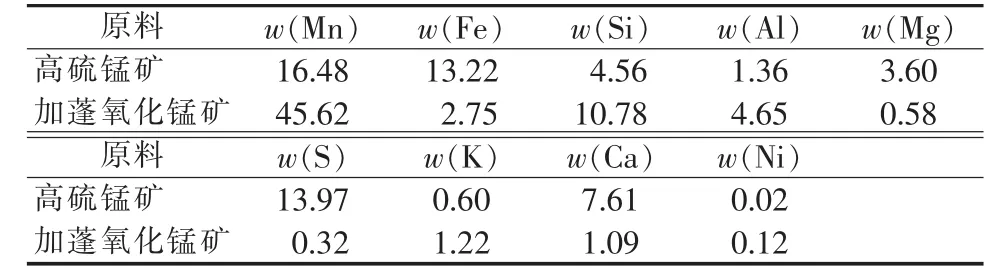
表1 高硫锰矿及加蓬氧化锰矿化学成分分析 %
1.2 高硫锰矿与氧化锰矿联合焙烧还原
根据本课题组前期研究结果,将氧化锰矿与高硫锰矿按照质量比3∶5充分混匀,混匀后的物料直接加入容积为30 mL的有盖坩埚中,置入预设温度为600℃的马弗炉内焙烧60 min。焙烧完成后,将密封反应器置入空气中冷却至室温,最后将焙烧产物倒出,装袋,保存。同时,称取一定质量的焙烧产物,在硫酸浓度为1.0 mol/L、液固体积质量比为5∶1的条件下,于60℃下浸出5 min,浸出结束后,过滤残渣。用蒸馏水洗涤,烘干,称重。分别化验浸出液中锰、铁的含量,以元素的浸出率为评价指标。
1.3 电池用硫酸锰制备工艺流程
图1为以高硫锰矿为原料制备电池用硫酸锰的工艺流程图。
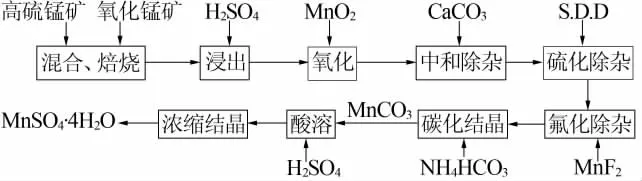
图1 以高硫锰矿为原料制备电池用硫酸锰的工艺流程
2 结果与讨论
2.1 高硫锰矿与氧化锰矿焙烧还原浸出
参照1.2节中的实验方法,将高硫锰矿与氧化锰矿联合焙烧浸出,其中锰浸出率及固硫率分别为98.72%和96.10%。另外,由于高硫锰矿原矿矿相复杂且泥化现象严重,经化学分析其中硫元素主要以黄铁矿(FeS2)的形式存在。因此,为更好地探究焙烧前后物相组成的变化以及高硫锰矿中硫的去向,本实验采用黄铁矿单矿物与电解二氧化锰按优化焙烧工艺条件进行配比、焙烧,并对焙烧产物做物相分析,以判别焙烧过程中锰及硫元素的物相转变。图2为焙烧产物XRD的分析结果。由图2可知,在焙烧过程中所得的焙烧产物,其主要组成为Mn3O4、Fe2O3和MnSO4,表明高硫锰矿中的硫元素主要转化成硫酸根的形式存在,既能减轻焙烧过程中SO2的污染,而且提供了硫酸锰生产过程的部分酸源。同时,将所得的浸出液合并收集,分析浸出液中各杂质离子含量,结果见表2。由表2可知,在浸出过程中,大量杂质离子也随着锰离子加入浸出液中,因此浸出液并不纯净。要得到合格的锰产品,需要对浸出液做除杂净化处理。

图2 焙烧产物XRD谱图

表2 浸出液中各组分含量 mg/L
2.2 Fe3+、Al3+的去除
目前,工业生产过程中常用的除铁方法有针铁矿法、黄铁矾法、中和法等[4-5]。中和法是一种使Fe3+水解析出沉淀Fe(OH)3的典型除铁方法,在冶金和化工生产中有广泛的应用。中和法沉淀去除Fe3+的原理在于不同金属水解沉淀物生成所需的pH不同。因此通过调节不同的pH,即可有选择性地生成沉淀物,达到不同金属分离的目的。金属离子的水解反应:


由式(6)可知,在反应达到平衡时:不同金属的活度积Kap为常数,而水的活度积Kω为常数,而在稀溶液里离子活度又近似于离子浓度,即可通过调节pH控制溶液中某些金属离子的浓度。同时溶液中金属离子浓度的对数与pH成线性关系,pH越大,则金属离子的浓度越小。若将Kap近似用浓度积常数Ksp代替,则可以算出不同金属离子平衡浓度与溶液中pH的关系,结果见图3。

图3 金属离子在水溶液中的平衡浓度与pH的关系(25℃)
由图3可知,当pH>3.2时,Fe3+可全部转化为Fe(OH)3;当 pH>5.0 时,A13+可全部转化为 Al(OH)3;当 pH>7.95 时,Fe2+将完全沉淀为 Fe(OH)2。 而 Mn2+开始沉淀时pH=7.54,与Fe2+沉淀区间有重叠部分,说明在中和除Fe3+前应先将溶液中的Fe2+氧化为Fe3+,否则会造成Mn2+大量沉淀而流失。由此可以看出,只需先将溶液中的Fe2+氧化,再将溶液pH调到5.0~5.5,就可以将 Fe3+、Al3+杂质完全去除,而不会造成Mn2+的损失。
在湿法冶金领域,广泛使用的氧化剂有O3、H2O2、MnO4-、ClO-、HNO3、ClO3-、Cl2、MnO2、O2。考虑到成本、操作等因素,在电解锰工业中广泛使用MnO2为氧化剂,将Fe2+氧化成Fe3+,其离子反应方程式:
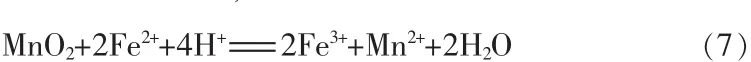
本实验加入MnO2的实际用量为理论用量的1.1倍,且于60℃下氧化,每隔15 min采用邻菲罗啉法检测浸出液中是否有Fe2+存在,直至所有Fe2+被氧化为止,最后反应时间为60 min。将氧化后所得的浸出液用CaCO3调溶液pH至5.0~5.5,过滤后滤液送检ICP,结果证明浸出液中的Fe3+和Al3+差不多完全除去,结果见表3。

表3 浸出液除Fe3+、Al3+后各组分含量 mg/L
2.3 重金属离子的去除
目前,工业上去除溶液中的重金属离子普遍采用硫化法,常用的硫化剂有福美钠(S.D.D)、硫化钠、硫化铵、硫化氢等[6],本实验以福美钠作为沉淀剂。
重金属硫化物在水溶液中的电离溶解按式(8)进行:

其溶度积可按下式表示:

又由式(9)可变形:

则金属离子浓度满足:
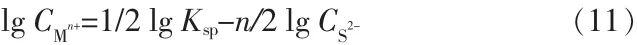
而溶液中硫离子浓度CS2-由下式计算(25℃):

由式(12)和(13)得到总电离方程:

其电离常数可表示如下:

将式(15)代入式(11)并变形:


图4 溶液中金属离子浓度与pH的关系(25℃)
查表可知,在 25℃、0.1 MPa下,H2S(aq)的饱和浓度为0.1 mol/L,将上述相应数值代入式(16)中,即可得到金属离子浓度与相应硫化物沉淀的溶液pH的关系图,结果见图4。由图4可知,各个重金属形成 硫化物沉淀 的 顺 序 :Cu2+→Pb2+→Cd2+→Zn2+→Co2+→Ni2+→Mn2+。也就是说对应 Ni2+的分离 pH较大,最不易与Mn2+分离,所以在工业上一般采用丁二酮肟定性检测溶液的重金属离子,当溶液中没有出现亮红色时表明重金属已经去除干净。
在对浸出液进行处理除去重金属的同时,为了保证浸出液中锰离子不被析出,计算一般工业上浸出液中锰离子硫化沉淀起始pH很有必要。
对于MnS而言,MnS溶度积关系式如下所示:

在25℃下,H2S在饱和状态下浓度为0.1 mol/L,则由式(15)得:

联立式(17)和(18)可得:

在本文中,Mn2+的质量浓度为40 g/L左右,即0.73 mol/L,代入式(19):
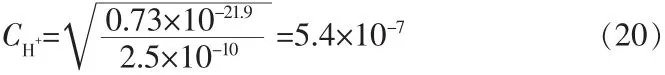
所以当MnS开始沉淀时,pH=-lg CH+=6.2。
因为在上一步除Fe3+、Al3+后pH为5.0左右,因此在硫化除重金属阶段允许的pH范围应为5.0~7.0。在该pH范围内除Mn2+外,以上重金属均可沉淀至浓度低于10-5mol/L,而Mn2+不会发生沉淀,可以有效实现重金属杂质与Mn2+分离。
本实验在常温条件下,硫化pH控制为7.0左右、硫化反应50 min,再于常温下静置12 h,过滤,得到粉红色滤液,滤液中重金属浓度见表4。结果表明,经硫化除杂后,浸出液中的重金属基本上完全除去。

表4 浸出液经硫化除杂后各组分含量 mg/L
2.4 Ca2+、Mg2+的去除
本文采用MnF2作为脱除Ca2+、Mg2+的沉淀剂,这是因为根据热力学数据,CaF2和MgF2的溶度积较低,MnF2溶解度较大,因此MnF2的使用既能有效去除溶液中的 Ca2+、Mg2+,又不会引入新的杂质[7]。
使用MnF2作为沉淀剂,沉淀反应过程主要存在以下 3 个平衡[8]:

图5a、5b分别为Mg-F-H2O系和Ca-F-H2O系φ-pH图。从图5中可以看出,pH为4~12时,CaF2和MgF2均能稳定存在,CaF2和MgF2稳定存在范围较大,适合氟化沉淀去除。而只有当pH<3.5时,CaF2和MgF2才能溶解。此外,要使硫酸锰溶液中的钙镁离子含量降低达到电解的要求,就必须有足够浓度的F-。 而CF-又与CH+直接相关,如果pH太小,由于氢氟酸属于弱酸,氟主要以HF形式存在,这样一方面严重腐蚀设备,另一方面减少参与反应的F-数量,降低脱除钙镁的效果。

图5 Mg-F-H2O(a)及 Ca-F-H2O(b)系统 φ-pH 图
本实验在去除Ca2+和Mg2+时,MnF2用量为理论用量的1.3倍,控制溶液pH为8.0左右,于90℃下反应120 min,过滤,滤液中各离子浓度如表5所示。

表5 浸出液经氟化除杂后各组分含量 mg/L
2.5 Na+、K+的去除
本实验采用碳化结晶法先将净化液中的Mn2+沉淀出来,陈化过滤后,以大量去离子水洗涤滤饼,将钠离子、钾离子洗去,得到高纯碳酸锰滤饼,从而去除含锰溶液中的钠离子和钾离子。实验选用价格低廉的碳酸氢铵作为碳化试剂,与硫酸锰的反应如式(24):

由于碳酸锰的溶度积Ksp=1.8×10-11,表明MnCO3沉淀极易生成。但在碳化结晶过程中,碳化条件的选择(如碳酸氢铵的初始浓度、碳化温度、加入方式等)均对碳酸锰的质量以及钠离子、钾离子的去除效果有着较大的影响。
本文以匀速滴加碳酸氢铵的加料方式,滴入1 mol/L的碳酸氢铵溶液,用量为理论值的1.1倍,于40℃下搅拌反应60 min,反应结束后,静置 3~4 h,抽滤,滤饼以35~40℃的蒸馏水反复冲洗以除去Na+、K+、SO42-等可溶性杂质,直至用质量分数为2%的BaCl2溶液检测不到SO42-为止,将滤饼烘干,称重,装袋保存。同时取样分析碳酸锰的产品质量。结果表明,碳化处理后所得的产品中钠离子和钾离子质量分数都小于0.005%。
2.6 电池用硫酸锰的制备与分析
目前,硫酸锰结晶的主要方法有3种:浓硫酸盐析法、蒸发浓缩法、高温压力结晶法[9]。本实验采用蒸发浓缩法制备电池用硫酸锰,以50 mL 1.0 mol/L硫酸溶液为底液,向其中缓慢加入制得的碳酸锰固体至溶液pH为5.0~6.0为止。最后将制备得到的硫酸锰溶液采用蒸发浓缩法制得硫酸锰晶体。由于硫酸锰在90℃以下时容易生成MnSO4·7H2O。因此在结晶过程中,控制结晶温度达90℃以上,待接近饱和溶液时浓缩结晶成MnSO4·H2O产品。同时应注意,在烘干结晶产品时要将温度控制在200℃以下,时间控制在2 h以内,避免过度失水[10]。将所得到的硫酸锰晶体称重,装袋,并做相应的质量分析。
2.6.1成分分析
结晶后的产品经过烘干得到最终产品,其成分分析见表6。由表6可知,本实验所制得的硫酸锰产品,锰质量分数为32.4%,满足HG/T 4823—2015《电池用硫酸锰》中硫酸锰质量分数大于32%的要求。另外,杂质离子含量、水不溶物、pH等指标均达到HG/T 4823—2015标准要求。

表6 制备所得硫酸锰产品成分分析
2.6.2XRD分析
图6为所制备的产品XRD谱图。由图6可见,所制备的产品XRD的峰位与晶体数据库中硫酸锰的XRD峰位完全吻合,因此确定产品为目标产物MnSO4·H2O。从图6中还可看出,衍射峰为MnSO4·H2O纯相,基本上无杂相存在,再次说明制备的产品纯度高。
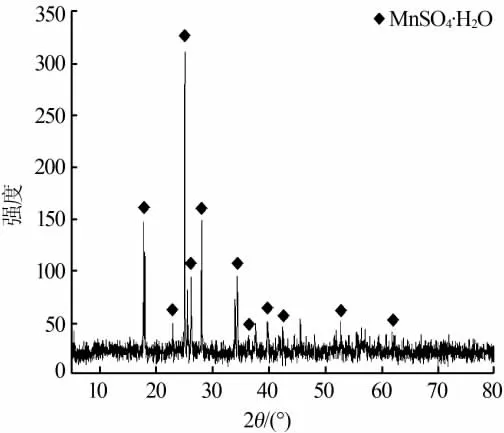
图6 制备所得硫酸锰产品XRD谱图
2.6.3SEM分析
图7为硫酸锰产品SEM照片。从图7可知,所制备的硫酸锰产品颗粒较匀称,粒度均小于50 μm,但产品的粒径差异较大,分布不均匀,外形为不规则片状或是颗粒状。

图7 电池用硫酸锰产品SEM照片
2.7 技术经济分析
以高硫锰矿为原料制备电池用硫酸锰的工艺与传统煤基焙烧还原氧化锰矿工艺相比,具有以下优势:1)尽管二者的主体焙烧设备完全相同,但传统煤基焙烧还原工艺要求焙烧温度高达850℃左右,而高硫锰矿与氧化锰矿联合焙烧工艺温度为600℃,可以大幅降低在焙烧还原过程中的能耗;2)作为传统煤基焙烧还原过程中的还原剂,无烟煤价格大概为1 200元/t左右,而高硫锰矿作为尾矿,目前大多是作为废弃物堆存处理,因此采用高硫锰矿与氧化锰矿联合焙烧工艺可以降低原料成本;3)高硫锰矿与氧化锰矿联合焙烧工艺中固硫率为96.10%,一方面能大幅度减轻锰冶金工业中SO2的污染,另一方面可将氧化锰矿中的高价锰还原成酸溶性锰化合物,而且提供了硫酸锰生产过程的部分酸源,显著降低了锰冶金工业的硫酸消耗,实现了资源的综合利用。
3 结论
本文主要考察了以高硫锰矿及软锰矿为原料,经焙烧还原、酸浸、净化除杂等过程以制备电池用硫酸锰的可行性,并对浸出液净化、结晶过程及所制备的产品质量指标做了系统的研究,得到结论:1)用MnO2为氧化剂对溶液中Fe2+进行氧化后,以CaCO3调 pH 到 5.0~5.5 时,即可完全去除 Fe3+、Al3+;重金属的去除采用福美钠(S.D.D)化合,于常温下反应50 min,静置12 h后,浸出液中的重金属基本上完全除去。2)采用 MnF2氟化沉淀去除 Ca2+、Mg2+,当 MnF2用量为理论用量的1.3倍、pH为8.0左右、于90℃下反应 120 min后,Ca2+、Mg2+浓度均大幅下降;以碳化结晶法去除Na+、K+等离子,当碳酸氢铵用量为理论值的1.1倍,于40℃下碳化反应60 min后,制备所得碳酸锰产品中Na+、K+质量分数都小于0.005%。3)通过 ICP、XRD、SEM 分析,经浓缩结晶制备硫酸锰产品符合HG/T 4823—2015《电池用硫酸锰》标准。

