基于双重微滴式数字PCR对转基因油菜RF1品系的定量方法
蔡教英,姚丽锋,王小玉,游淑珠,丁琦
(珠海出入境检验检疫局检验检疫技术中心,广东珠海 519015)
随着生物技术的快速发展,全球转基因作物的种植面积持续增加。全球转基因作物累计种植面积由170万公顷(1996年)增加至20亿公顷(2015年),且转基因作物的种植面积前6位的国家一次是美国、巴西、阿根廷、印度和中国[1]。近年来,转基因作物带来的食品安全和环境安全问题一直是一个关注的热点,目前公众对转基因作物到底含有哪些转基因及其相应含量尤为关注,因此许多国家和地区均出台了转基因限量规定,并实施了标识管理措施。然而各个国家或地区做规定的限量标准和标识管理措施存在很大差异[2],为了打破国际贸易壁垒和促进标识管理制度的顺利进行,迫切需要对作物中转基因含量建立可靠、准确的定量分析方法。
目前应用最广的定量检测方法是实时荧光定量PCR技术,该方法需要通过标准曲线来进行定量,但是在建立标准曲线的过程,容易受到样品中抑制剂等的影响,导致准确性降低[3]。数字 PCR(digital polymerase chain reaction PCR,dPCR),又成为“第三代 PCR”技术,是一种近年来发展迅速的检测手段,在转基因成分检测领域拥有巨大的潜能。微滴式数字PCR(droplet digital polymerase chain reaction,ddPCR)是将反应体系分割成很多微小的反应微滴,实现每个反应微滴只有单个模板分子进行PCR扩增,根据泊松分布原理,按阳性微滴与阴性微滴数的比例计算目标分子拷贝数,实现绝对定量[4,5]。国内外已有将微滴式数字 PCR平台应用于精准定量转基因拷贝数的报道[6~10]。本研究以转基因油菜RF1品系作为研究对象,建立其内参基因及品系特异性基因的 ddPCR定量检测方法。全球转基因油菜的种植面积从2015年的850万公顷增加到2016年的860万公顷[11]。美国、加拿大和澳大利亚的转基因菜籽油的边际产量均有所增加,满足了全球对食用油的需求。智利也有种植,但仅作为种子使用,不用来榨油。在短期内,为了应对菜籽油和生物柴油日渐增加的使用需求,全球油菜需求量可能会显著增加。转基因油菜籽是我国广泛应用的加工原料,根据我国的“转基因生物安全管理条例”,要求对转基因油菜种子、油菜籽及其加工产品进行强制标识管理[12]。为此,本研究拟建立一种转基因油菜RF1双重ddPCR定量方法,为实现转基因油菜RF1精准定量奠定基础。
1 材料与方法
1.1 原料
转基因油菜RF1、RF2、MS1、MS2和T45品系以及转基因大豆GTS40-3-2品系标准物质购于美国油脂化学家协会(American OilChemists' Society,AOCS)。非转基因油菜、大豆样品为本实验室储备。Premix Ex Taq TM,大连宝生物;MasterMix(2×)、ddPCR Droplet Generation Oil、GD8 Cartridge均购自美国伯乐公司;引物和探针由invitrion公司合成,稀释为终浓度为10 μmol/L的工作液使用。ddPCR Super Mix、ddPCR Droplet Generation Oil、ddPCR Droplet Reader Oil、Droplet Generator DG8Cartridge、Droplet Generator DG8 Gasket、plate holder 美国 Bio-Rad 公司;QX200 Droplet Digital PCR系统美国Bio-Rad公司;Nanodrop 2000c核酸蛋白分析仪美国Thermo公司。
1.2 方法
1.2.1 引物探针和特异性验证
根据文献选取磷酸烯醇式丙酮酸羧化酶(phosphoenilpyruvate-carboxylsae,PEP)和油菜RF1特异性基因序列,选取适用于数字PCR的引物探针对,序列信息(见表1),并在实时荧光PCR仪上验证特异性,扩增体系为:Premix Ex Taq 12.5 μL,引物(10 μmol/L)各 1 μL,探针(10 μmol/L)各 0.25 μL,DNA 模板 2 μL,补水至 25 μL。反应参数:预变性 95 ℃、5 min;95 ℃、15 s,60 ℃、1 min,收集荧光信号45个循环。
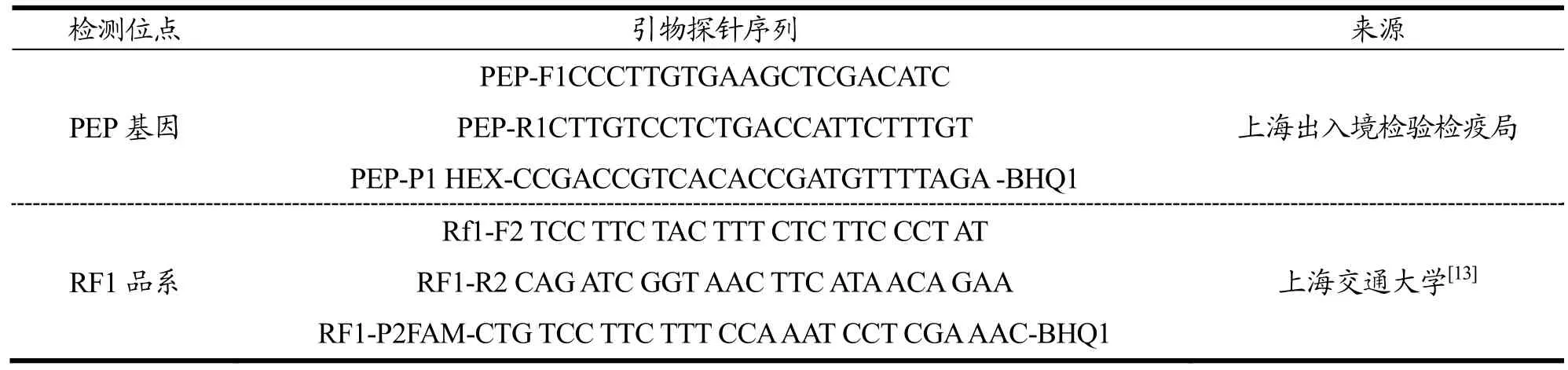
表1 引物探针序列表Table 1 Primer probe sequence for ddPCR
1.2.2 扩增稳定性试验
为验证转基因油菜RF1品系标准品在微滴式数字PCR的扩增稳定性,以30 ng/μL转基因油菜RF1品系基因组DNA按照下述反应体系和参数进行检测,同时设置3个平行进行检测,3个平行的相对标准偏差(RSD)不超过25%。
数字PCR 反应体系:2×MasterMix 10 μL,引物(10 μmol/L)各 1 μL,探针(10 μmol/L)各 0.25 μL,DNA 模板2 μL,补水至20 μL。反应参数:95 ℃、5 min (1 ℃/s);94 ℃ 15 s,60 ℃、1 min (1 ℃/s),共 45 个循环;98 ℃、10 min(1 ℃/s),12 ℃保存反应产物。反应结束后将96孔反应板置微滴分析仪中读取数据,应用 QuantaSoft V1.3.2软件进行数据分析。
1.2.3 线性范围验证
将油菜 RF1品系标准品的基因组稀释至 30 ng/μL,用 0.1×TE (Tris-HCl,EDTA-Na,pH 8.0)缓冲液进行6个梯度的梯度稀释,将原始基因组分别稀释至 6,1.2,0.24,0.12,0.024,0.0048 ng/μL,将以上梯度稀释组的DNA模板进行数字PCR检测,每个浓度梯度组包含3个平行,平行间相对标准偏差(RSD)不超过25%。检测结果RSD(<25%)的样品拷贝数为定量检测限(LOQ),能够检测的样品最低拷贝数为检测限(LOD)。
1.2.4 定量检测限和检测限的验证
取上一步线性范围下限的DNA样品进行LOQ的验证。将该DNA进行十个平行的数字PCR验证,计算每个平行的单位体积的内参基因和外源基因的拷贝数,计算平均值和RSD值,RSD要求小于25%。
1.2.5 精密度试验
选取外源基因LOQ临界值和LOQ临界值10倍浓度的DNA样品进行精密度验证,每个样品做5个平行。通过数字PCR对其拷贝数进行测定,计算其定量检测的精密度,检测结果要求RSD小于25%。
1.2.6 准确度试验
取LOQ值,LOQ5倍,LOQ值25倍的3组阳性进行准确度的验证。对以上3组DNA样品进行三个平行的数字PCR实验。通过测定拷贝数计算其定量检测的准确度,检测结果要求RSD小于25%。
2 结果与讨论
2.1 引物探针特异性验证
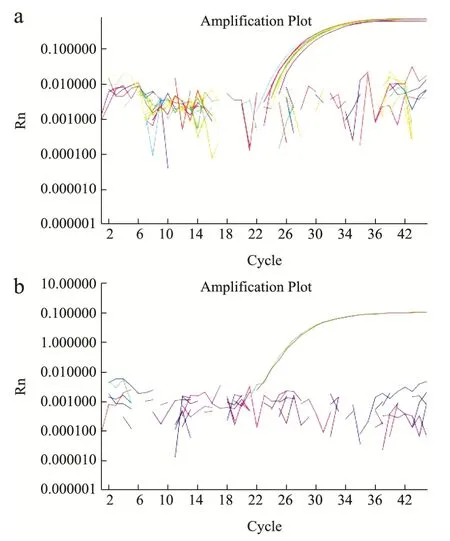
图1 PEP和RF1特异性荧光PCR结果Fig.1 Specificity of RF1 by real-time PCR
应用荧光 PCR方法对转基因油菜 RF1品系、5种转基因油菜、1种大豆基因组DNA和1种非转基因大豆、1种非转基因油菜进行扩增的结果如图1所示。6个油菜基因组DNA在HEX通道下都有扩增曲线,而大豆基因组DNA未见扩增曲线(见图1a)。在FAM通道下,只有转基因油菜RF1品系有扩增曲线,其余的DNA均未见扩增曲线,结果表明该引物探针对特异性好(见图1b)。
2.2 扩增稳定性验证结果
采用1.2.2中数字PCR反应体系和参数,对油菜RF1标准品的内源基因PEP和RF1品系特异性序列进行稳定性验证的数据见表2,热点图如图2所示,图2a为PEP内参基因,图2b为外源基因。在此反应体系中,模板的添加量为30 ng,按照单倍体油菜基因组1.3 pg计算,预期体系中内参基因的拷贝数为23077个。从图2可以看出数字PCR所获得的阴性点与阳性点之间有明显的荧光信号差距,可以通过设置统一的阈值限进行阴性反应点和阳性反应点的区分。内参基因三次扩增重复的实际检测拷贝数分别为 24520、24480和24240,平均检测拷贝数为24413,相对标准偏差为0.62%;外源基因三次扩增重复的实际检测拷贝数分别为25000、24880和24800,平均检测拷贝数为24893,RSD为0.40%。本文所用的内参基因和外源基因的引物探针扩增稳定性良好,并且该阳性样品稳定可用。
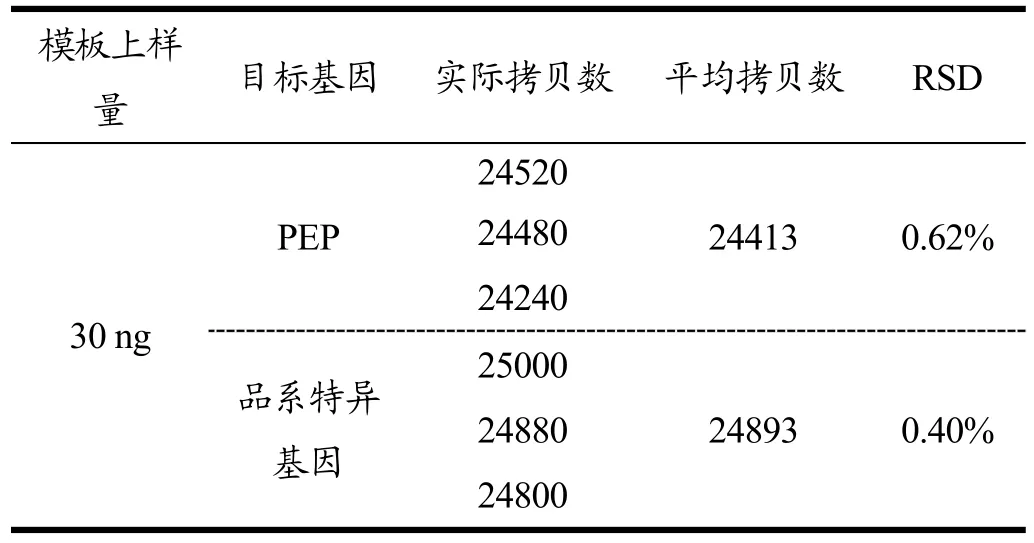
表2 油菜RF1扩增稳定性验证Table 2 Stability of RF1
2.3 线性范围验证结果
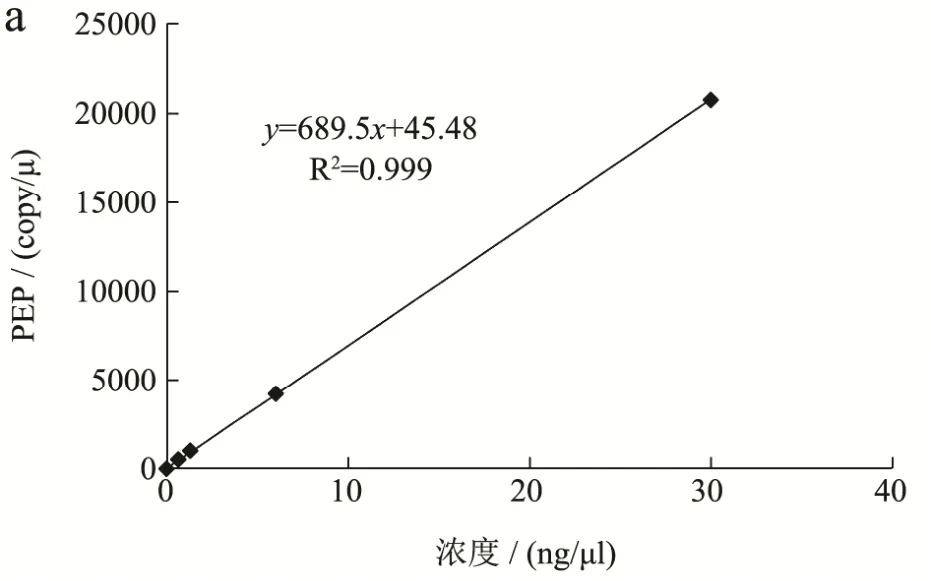
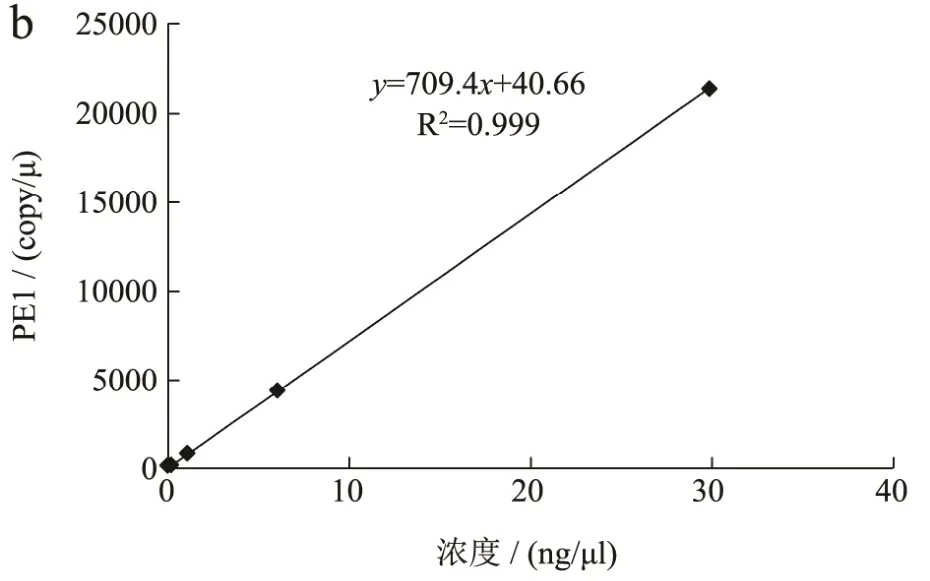
图3 RF1数字PCR线性范围拟合标准曲线Fig.3 Standard curves of the RF1 ddPCR assay
线性范围验证实验检测结果见表 3,线性范围内的数据拟合标准曲线见图 3。由实际拷贝数的检测结果和拟合标准曲线可以看出,本标准方法在单位体系内参基因拷贝数位于 18~23077的区间内可以呈现出良好的线性,r2为0.999,所有浓度组的RSD值位于1.23%到11.45%之间,均小于25%;外源基因拷贝数位于 18~23077的区间内可以呈现出良好的线性,r2为0.999,所有浓度组的RSD值位于1.01%到21.43%之间,均小于25%。因此,本方法在内参基因和外源基因拷贝数位于18~23077时,具有良好的定量能力。
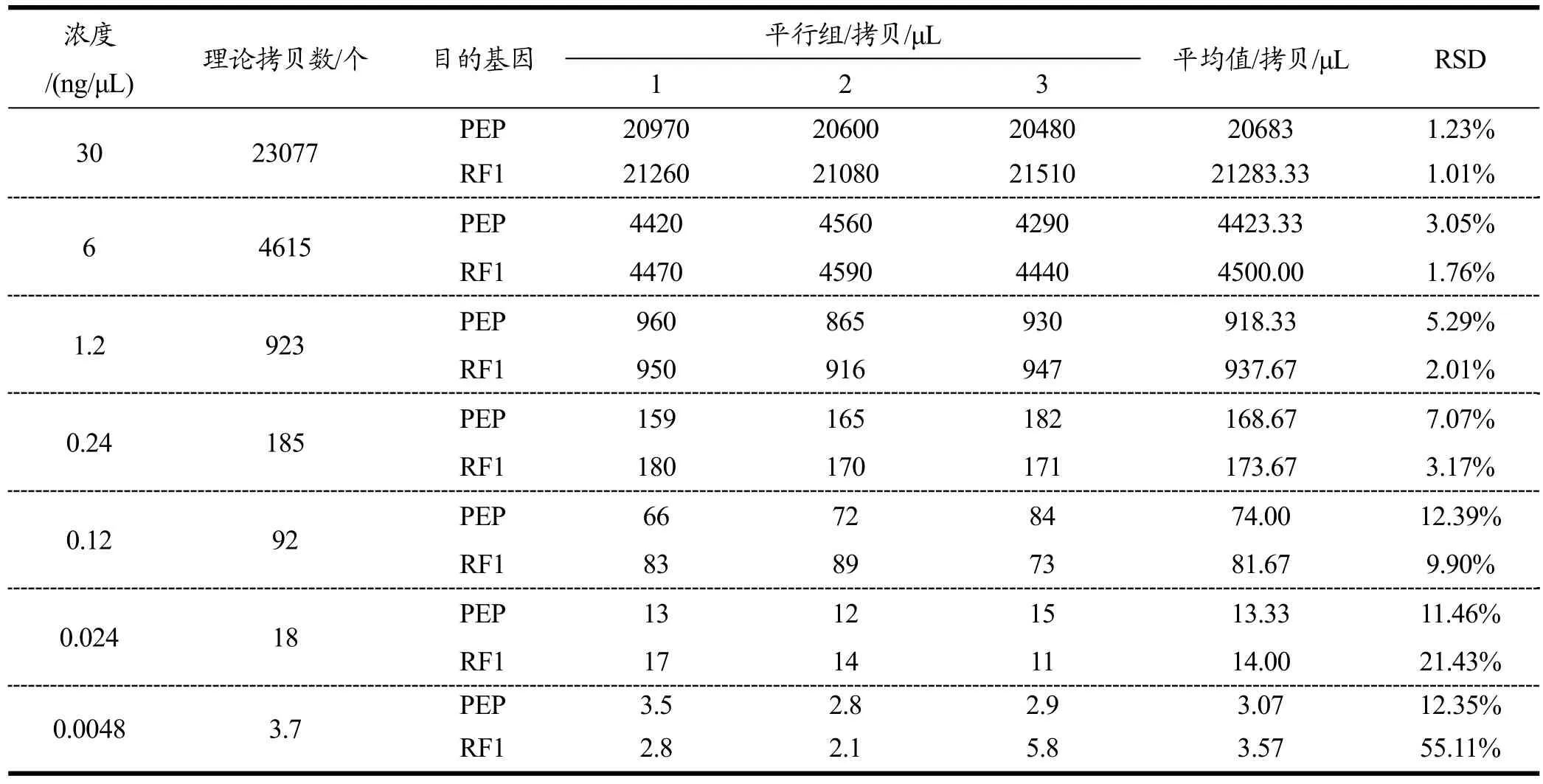
表3 RF1数字PCR的线性范围验证Table 3 Dynamic range of RF1 for ddPCR
2.4 定量检测限和检测限的验证结果
定量检测限和检测线实验结果见表4。LOQ试验中内源基因和品系特异性基因的RSD分别为17.87%和15.58%,均小于25%。这说明方法可以对单位体积内源基因和外源基因拷贝数为 18的样品进行稳定的定量检测。LOD验证结果如表5所示。十个平行试验中,阳性检出率为10个,符合LOD质控的要求(不低于9个)。因此本方法可以对单位体积外源基因拷贝数为3.7的样品进行稳定检测。
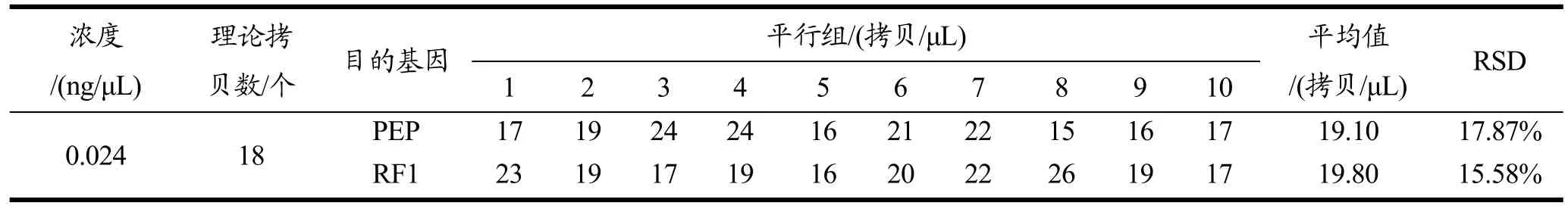
表4 RF1数字PCR的LOQ验证Table 4 Verification of the LOQ of RF1 by ddPCR

表5 RF1数字PCR的LOD验证Table 5 LOD verification of the RF1 by ddPCR
2.5 精密度试验结果
精密度试验检测结果见表6。综合分析LOQ临界点和临界点10倍的DNA样品的检测结果,两组浓度的DNA样品所得到的组内RSD值分别为24.50%、17.39%和10.60%、8.40%,符合整个方法对于精密度的要求(RSD小于25%)。
2.6 准确度试验结果
取LOQ值,LOQ5倍,LOQ值25倍进行数字PCR实验。实验结果如表7所示,对于浓度为0.024,0.12,0.6 ng/μL的DNA标准样品,所测得拷贝数百分比的平均值分别为112.6%,106.0%和107.2%,DNA标准样品理论拷贝数百分比为 100%,计算得到浓度为0.024,0.12,0.6 ng/μL的DNA标准样品的检测偏差分别为12.64%,5.97%和7.20%,三组偏差均符合要求(小于 25%)。因此本方法可以比较准确的对油菜RF1品系进行绝对定量检测。
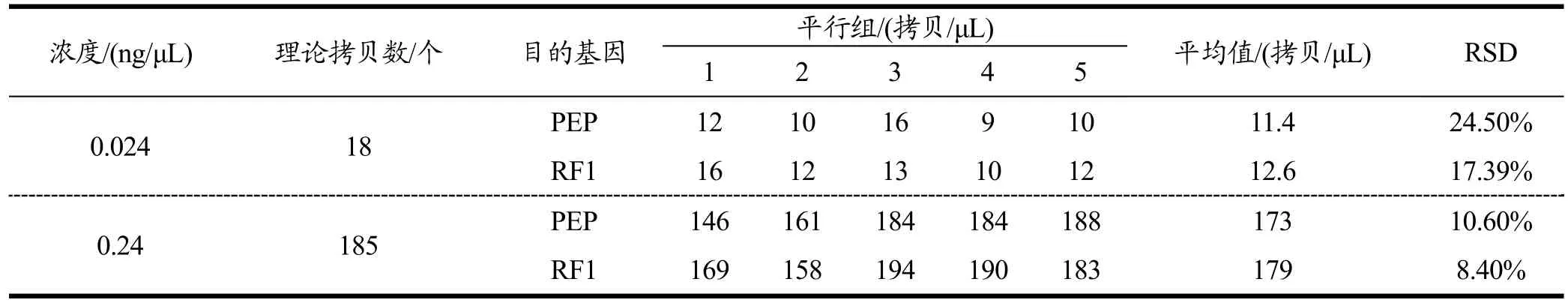
表6 RF1数字PCR的精密度验证Table 6 Precision of the RF1 by ddPCR
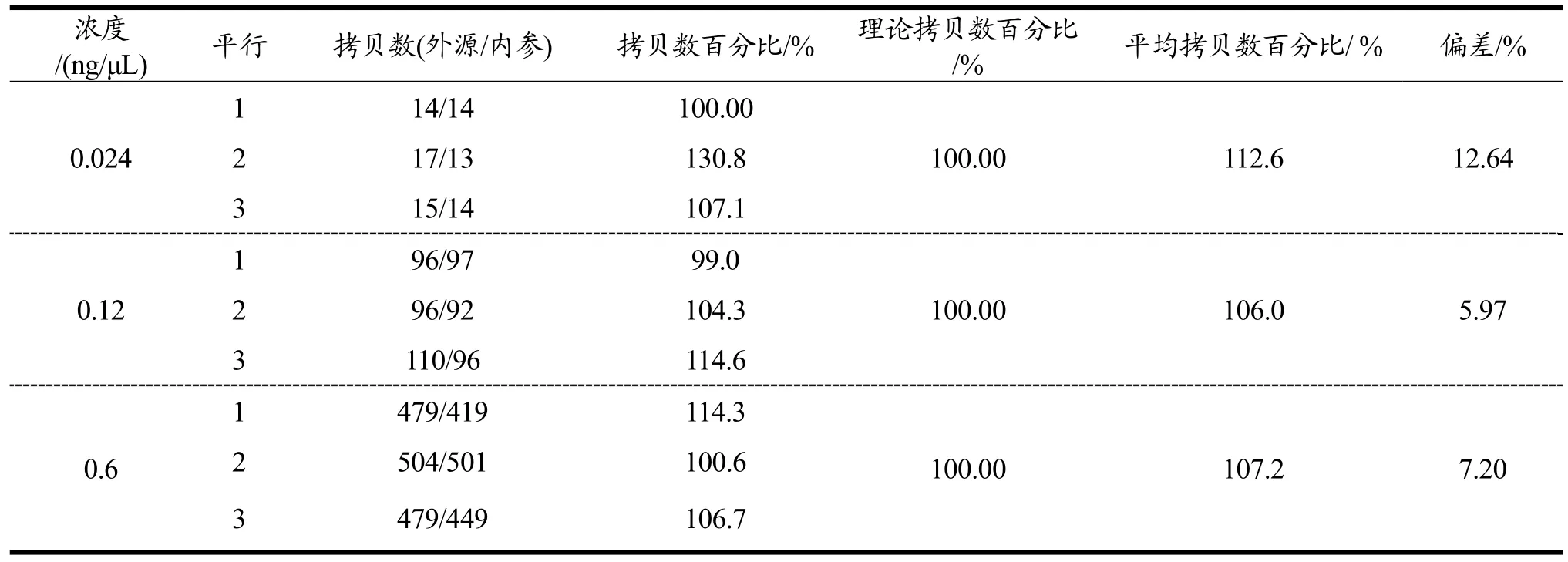
表7 RF1数字PCR的准确度验证Table 7 Accuracy of the RF1 by ddPCR
3 结论
3.1 目前,国际上最常用的转基因作物转基因检测的方法主要基于核酸的PCR反应。前人根据油菜中所转入的外源性基因种类制备基因芯片,其检测的特异性和重复性较好,但是在检测低含量的转基因油菜时的灵敏度为0.5%[14]。还有研究者利用热不对称交错PCR检测转基因油菜Oxy-235,其绝对LOD和LOQ分别为10个拷贝数和20个拷贝数[13]。2003年,我国国家质检总局颁布了转基因油菜筛选、基因检测普通PCR和实时荧光 PCR方法[15,16]。李想等人利用实时荧光PCR对我国进口油菜籽进行了转基因品系分布及转基因成分含量情况进行了详细的分析,研究结果表明,含MS1×RF1和MS1×RF2的检出率约为40%[10]。但是,普通PCR和实时荧光PCR反应易受引物之间的相互干扰和DNA样品的纯度等因素的影响,从而影响PCR扩增效率。数字PCR是一种新的核酸检测和定量分析方法,具有特异性好、灵敏度高,其检测结果直接反应样品的拷贝数,与标准曲线和参考样品无关。国内还为见采用双重ddPCR对转基因油菜籽产品进行定量分析的报道。
3.2 本文在国内首次建立了转基因油菜籽 RF1双重ddPCR定量分析方法。通过对引物探针的特异性进行筛查,同时还验证了扩增稳定性、线性范围、确定了定量检测限和检测限,也对精密度、准确度进行了研究。结果显示本研究所建立的转基因油菜籽RF1双重数字ddPCR定量方法特异性好、扩增稳定性好。综上所述,本研究建立的转基因油菜籽 RF1双重 ddPCR定量分析方法可用于转基因油菜RF1的转基因成分定量检测。

