猪圆环病毒2型全基因组的克隆及病毒拯救
,,,,
(浙江理工大学生命科学学院,杭州 310018)
0 引 言
猪圆环病毒(Porcinecircovirus, PCV)是最小的动物DNA病毒之一[1],最早由德国学者Tischer在猪肾细胞系PK-15中被当作一种细胞污染物[2],其病毒粒子主要以二十面体对称,无囊膜为主要特征,直径约17 nm。PCV基因组以滚环模式复制,大小约为1.7~2.0 kb,为单股环状闭合DNA。根据其核苷酸序列和致病性不同,PCV被分为PCV1、PCV2 和PCV3。PCV1无致病性,PCV3为新发现的一种猪圆环病毒,可能与垂直传播或导致母猪繁殖障碍疾病有关[3-5]。Allan等[6]从猪群中分离并确认PCV2为断奶仔猪多系统衰竭综合征(PMWS)的主要病原,其主要影响6~8周断奶仔猪,通常表现为消瘦、呼吸困难和免疫抑制[7-8]。PCV2还可诱导猪皮炎与肾炎,繁殖障碍和呼吸道综合征等疾病的综合感染[9]。
PCV基因组中大于200 nt的开放阅读框(Open reading frame, ORF)有6个[10],已全部鉴定完毕。ORF1是其中最大的开放阅读框,编码启动病毒复制的Rep蛋白,为PCV2的DNA复制、相关蛋白表达及病毒粒子的产生所必需,不同PCV毒株ORF1的核苷酸同源性高达80%以上[11];ORF2位于病毒基因组互补链,编码病毒的核衣壳蛋白Cap,是目前唯一已知的结构蛋白,不同PCV毒株的核苷酸同源性为63%左右[12-13]。Cap蛋白具有免疫原性,存在多个免疫反应区,可诱导机体产生病毒中和抗体,是PCV2最重要的亚单位疫苗抗原[14]。ORF3编码一种非病毒复制必需的非结构蛋白,通过构建ORF3缺失株证实ORF3蛋白能导致PK-15细胞凋亡的发生[15],ORF4编码60个氨基酸,与ORF1和ORF3基因重叠,编码方向与ORF1相反,ORF4蛋白具有凋亡抑制功能但非病毒复制必需[16-17]。ORF5可能通过调节NF-κB信号通路在PCV2持续性感染中起重要作用[18]。PCV2的ORF6蛋白对病毒复制是非必需的,可能参与Caspase调控和多个细胞因子表达[19]。
目前,PCV2的分子致病机制尚未研究清楚。为进一步研究PCV2基因组结构与功能、致病机制和免疫机理,本文通过PCR扩增PCV-2全基因组,构建自环化PCV-2全基因组DNA,并进一步转染细胞,成功获得拯救病毒PCV2。
1 材料与方法
1.1 材料与试剂
1.1.1毒株与细胞
PCV2细胞株(PCV2-SY)由扬州大学高崧教授提供;不携带PCV的PK-15细胞由本实验室保存。
1.1.2载体与菌株
pMD18-T连接试剂盒购于宝生物工程(大连)有限公司,大肠杆菌(Escherichiacoli)DH5α和pBluescript SK(pSK)载体由本实验室保存。
1.1.3试剂
Taq DNA聚合酶、dNTP、胶回收试剂盒、相关引物、DMEM高糖培养基均购自生工生物工程(上海)股份有限公司;限制性内切酶XbaⅠ、EcoRⅠ、HindⅢ、T4 DNA连接酶、南美胎牛血清、细胞胰酶消化液(含酚红)和Lipo 6000TM转染试剂购自碧云天生物技术有限公司;质粒提取试剂盒购自康宁生命科学(吴江)有限公司。
1.2 引物设计
从美国国家生物技术信息中心(National center for biotechnology information, NCBI)网站下载PCV2全基因组序列并对序列进行同源分析,利用Primer Premier 5.0软件设计一对用于检测PCV2的特异引物,以及一对扩增基因组全长的引物,并引入XbaⅠ酶切位点,以利于下游基因操作,本研究所用引物如表1所示。

表1 本研究所用引物序列
注:PCV2的Cap蛋白转录正常剪接扩增产物大小为486 bp,基因组DNA扩增产物则为878 bp。
1.3 PCV2株全基因组克隆
以用常规方法提取感染病毒细胞总DNA为模板,利用PCV2特异性引物TF1094和TR1471进行PCR。PCR反应首先在 94 ℃进行预变性5.0 min;接着进行30个循环的94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,72 ℃延伸5.0 min。反应结束后用1%琼脂糖凝胶电泳检测PCR产物。以上述总DNA为模板,利用GF1358和GR1363引物对进行PCV2全基因组克隆。除PCR扩增延伸时间延长至1.5 min外其它反应参数同上。将PCR产物回收后与pMD®18-T克隆载体连接,转化大肠杆菌DH5α,经挑取单菌落,提取并将酶切鉴定的质粒进行测序。
1.4 pSK-PCV2重组质粒构建
将测序正确的pMD-PCV2质粒用XbaⅠ酶切,凝胶电泳分离PCV2片段,把回收的 PCV2 DNA与pSK质粒用T4 DNA连接酶16 ℃连接过夜。将连接产物直接转化大肠杆菌DH5α,挑取单菌落,提取质粒送公司测序。
1.5 病毒双链裸DNA制备及转染
提取质粒并用XbaⅠ内切酶做酶切鉴定,将切下的目的片段用T4 DNA连接酶自环化,获得病毒双链环化DNA。按照Lipofecter脂质体转染试剂盒说明书,将鉴定正确的环化重组质粒转染PK-15细胞,并在37℃、5% CO2条件下培养48 h,反复冻融3次后收集上清液,接种于新培养的 PK-15细胞并连传15代。
1.6 病毒体外转录鉴定
根据RNAiso TM Plus说明书提取总RNA,并用DNase Ⅰ处理,以除去混有RNA的少量病毒DNA,以纯化后的RNA为模板,利用M-MLV逆转录酶逆转录合成cDNA,再用引物对CapR466和GF1358进行PCR。除循环次数增加到35个外,其它扩增条件同1.3。用10 g/L的琼脂糖凝胶电泳检测PCR产物。
1.7 间接免疫荧光检测
将传代培养15代的接毒细胞消化分装于6孔板,每孔注入3.0×105个细胞,在CO2培养箱中培养48 h后用PBS缓冲液洗涤,拍干,通过100%甲醇固定细胞10.0 min,弃去固定液,用PBS清洗两次后以抗PCV2的ORF2兔多抗为一抗,37 ℃作用1 h,FITC标记羊抗兔荧光二抗(1∶1000稀释)为二抗,37 ℃作用1 h,每孔加入1滴磷酸甘油封片液,荧光显微镜观察,以正常PK15细胞作为阴性对照。
2 结果与分析
2.1 PCV2全基因组克隆及序列分析
以细胞毒总DNA为模板,用PCV2全长引物对GF1358/GR1363扩增到约1.8 kb目的片段,结果如图1所示。将纯化的目的片段克隆到pMD18-T获得pMD18-PCV2,阳性克隆经过EcoRⅠ和HindⅢ双酶切鉴定结果如图2所示。测序结果显示,本研究获得PCV2毒株基因组全长序列为1767 bp,将该序列与国内外27个代表性PCV2毒株进行序列比较,结果表明同源性在95.4%~99.9%之间,不存在明显特殊变异,与GQ996404的亲缘关系最密切,同源性达99.9%(图3)。

M:DL 2 000 DNA Marker; 1:未接毒PK-15细胞总DNA;2:接毒PK-15细胞总DNA图1 PCV2全基因组扩增检测照片

M:1 kb DNA Ladder;1-4:重组质粒EcoR Ⅰ和Hind Ⅲ双酶切图2 重组质粒EcoR Ⅰ和Hind Ⅲ双酶切鉴定照片
2.2 pSK-PCV2重组质粒构建
质粒pMD-PCV2经XbaⅠ限制性内切酶37 ℃酶切,回收目的片段,并与pSK载体连接获得重组质粒pSK-PCV2,将其再次经XbaⅠ限制性内切酶酶切鉴定,产生与预期相符的1767 bp和2961 bp目的片段,结果如图4所示,表明PCV2全基因组成功克隆至载体pSK。

图3 PCV2-SY毒株的系统进化关系

M: DNA Marker;1: Xba Ⅰ酶切产物图4 pSK-PCV2酶切鉴定照片
2.3 病毒自环化及转染
XbaⅠ酶切重组质粒并经凝胶电泳鉴定正确后,回收PCV2全基因组酶切产物并用T4 DNA连接酶16 ℃连接过夜,形成自环病毒DNA。重组病毒持续盲传15代,每一代都进行病毒液回收并再次感染新的PK15细胞,再对回收的病毒液提取DNA进行PCR检测。图5为盲传第10代PCR检测结果,自环化重组病毒和野毒均产生378 bp大小目的PCR产物,但pBluescript SK-PCV2转染细胞和PK-15细胞无阳性产物,表明自环化重组病毒已成功转染并可在PK15细胞内进行稳定复制传代。

M: DNA Marker;1:空白阴性对照;2:野生PCV2;3:重组PCV2;4:pSK-PCV2转染PK15阴性细胞; 5:PK-15阴性细胞图5 PCR检测传代10代病毒DNA***
2.4 病毒Cap蛋白基因转录检测
提取盲传10代的重组细胞病毒液中总RNA后,经DNase Ⅰ处理,RT-PCR扩增后电泳检测条带大小约486 bp,表明转染细胞中Cap基因mRNA存在特异性剪接和表达(图6)。
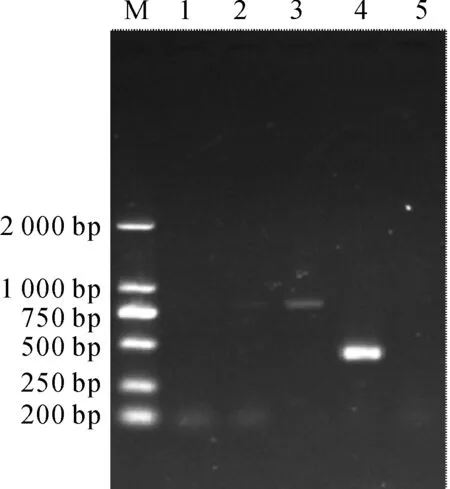
M:DNA Marker;1:阴性对照;2:未经DNase Ι处理PCV2 RNA;3:PCV2 DNA;4:DNase Ι处理的PCV2 RNA;5:PK-15阴性细胞RNA图6 重组病毒Cap RNA检测
2.4 间接免疫荧光检测
重组病毒感染爬片细胞后48 h利用IFA检测PCV2 ORF2表达,结果如图7所示,重组PCV2感染细胞用抗PCV2 ORF2抗体为一抗在荧光显微镜下检测到特异性绿色荧光,而阴性对照细胞无特异荧光产生,因此自环病毒在体外转染后再感染细胞可以产生具感染性的子代PCV2病毒。

图7 重组病毒感染PK-15细胞间接免疫荧光检测
3 讨 论
越来越多的研究表明,PCV2通常以混合感染的方式引起猪只PMWS,因此由PCV2混合感染病料直接接种细胞难以获得纯的PCV2病毒,给PCV2相关研究增加难度[20-22]。Meerts等[23]发现,PCV2在接种后6~12 h的PK-15细胞内可检测到Cap蛋白表达,接种后12~24 h的Cap主要分布在细胞核周围,并有子代病毒产生。通过细胞连续传代表明PCV2增殖能力较强,因而利用病毒的感染性DNA克隆,获得遗传背景单纯的拯救病毒,是PCV2致病机理、相关疾病防治和疫苗开发研究的有力工具。
国内外已有应用PCV2全基因组复制出完整病毒的报道。Liu等[24]构建含有 PCV2全基因组的重组质粒,体外环化转染猪视网膜细胞系得到具有感染性的病毒,应用构建的感染性病毒在进行致病性实验时可避免其它病毒的干扰,容易定量和在细胞传代过程中不易产生变异等优点。Fenaux等[25]和郗鑫等[26]用酶切位点SacⅡ构建PCV2体外感染性分子克隆,但采用体外自环的方式将PCV2全基因环化再转染PCV阴性PK15细胞,在其子代细胞中检测到病毒相应的抗原,而Fenaux将线性化的两条单拷贝PCV2同向连接在一起,利用酶切位点SacⅡ与pBluescript SK载体连接构成重组质粒后转染PK-15细胞,再感染以获得成熟病毒粒子,同时发现双拷贝比单拷贝体外转染细胞效率高。本研究利用高拷贝的质粒载体pMD18-T正向插入单拷贝的PCV2全基因,两端引物含XbaⅠ序列重叠,经自环化显示构建的自环化质粒ds-PCV2具有感染性,但与李俊等[27]研究结果不同,重组质粒pSK-PCV2转染PK-15细胞没有检测到子代病毒,推测与PCV2的滚环复制机制和共价闭合环状DNA基因组有关[28-29]。连到pBluescript SK载体上的PCV2全基因组DNA分子因载体序列的分隔使PCV2全基因组不连续,因而失去部分重要功能。另一种可能原因是由于重组质粒pSK-PCV2转染产生子代病毒但在PK-15细胞中的增殖滴度不高,基因组转染效率较差,导致转染后细胞PCR检测呈阴性。
4 结 论
本文通过PCR成功扩增出PCV2 1767bp全基因组,利用设计的一对含XbaⅠ酶切位点的特异性引物成功构建PMD-PCV2重组质粒。将质粒体外酶切自环化后转染PK-15细胞并检测到PCV2病毒的复制,结果表明,本研究成功构建PCV2全长DNA克隆和拯救病毒。经过测序的PCV2-SY株系为PCV2b亚型,与国内外毒株有着极高的同源性,介于95.4%~99.9%之间,具有很强的代表性,为后续研究PCV2病毒致病机理、疫苗开发和有效治疗奠定基础。
——一道江苏高考题的奥秘解读和拓展

