人子宫内膜间质细胞原代培养及生物学行为的研究▲
刘俐伶 庞丽红 植枝福 杨文梅
(1 广西医科大学,南宁市 530021;2 广西壮族自治区人民医院生殖医学与遗传中心,南宁市 530021;3 广西医科大学第一附属医院妇产科,南宁市 530021)
子宫内膜异位症(endometriosis, EMS)是一种良性且常见的妇科疾病,其中卵巢型内膜异位症更是频发于妇科临床,严重影响患者的生活质量。为了加强对其病因病机等的基础研究,科研人员一直不断探索建立有利于研究该病的体内外实验模型。子宫内膜异位症体外模型包括组织模型和细胞模型。组织模型主要用于观察早期异位组织侵袭、增殖和血管形成过程[1-3]。但体外培养的来源和条件不同,子宫内膜组织培养时间不宜过长,最长的时间不应超过1周,否则,就会因改变组织的生理结构而失去研究意义。细胞模型能很好地反映细胞在体内的生物学特性,在一定程度上反映了细胞之间的相互作用,更接近于人体的真实环境,因此细胞模型仍是目前研究EMS发病机制的重要方式。由于一直缺乏稳定可靠的细胞系,原代细胞培养是EMS体外研究的一种重要方法。但是原代细胞培养技术要求高,成功率低,最早报告的子宫内膜异位间质细胞的培养成功率仅为56%[4],近几年相关学者报道的成功率也仅为60%~70%。本研究首次对子宫内膜间质细胞原代培养方法进行探索改良,取得了明显的效果。现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 标本采集 选取2016年3月至12月在广西医科大学第一附属医院妇产科住院的15例卵巢型子宫内膜异位症患者,经组织学明确入选,获取子宫内膜异位囊肿即巧克力囊肿内壁;另选15例经宫腹腔镜检查证实为输卵管性不孕的患者,获取子宫内膜组织。卵巢型内异症患者中按评分全部为Ⅲ/Ⅳ期,年龄21~35(29.1±0.2)岁,不孕患者年龄26~35(28.2±0.7)岁。两组均取自增生期内膜,取样前3个月无激素治疗史。无菌条件下操作获得组织标本,立即置于4℃预冷的含有双抗(青霉素、链霉素各100 IU/mL)的无菌1640培养液中,1 h内送至实验室,在生物安全柜中进行细胞分离(操作前生物安全柜需紫外线消毒30 min,开启风机15 min,并用75%酒精擦拭超净台)。
1.1.2 主要仪器 CO2细胞培养箱(ThermoFisher);BCM-1000A型净化工作台(AIRTECH);微量可调移液器(法国Glison公司);OLYMPUS倒置相差显微镜(CKX53);湘仪Td5a-ws离心机;杭州米欧仪器涡旋振荡器(MZX-28+);SH2-88型37℃恒温水浴摇床(上海安亭科技仪器厂);ThermoFisher酶标仪(MULTISKAN FC)。
1.1.3 主要试剂 无菌PBS溶液(美国Hyclone公司);100 IU/mL青霉素、链霉素(双抗)溶液(美国Sigma公司);胎牛血清(美国Gbico公司);RPMI-1640培养液(美国Gbico公司);25%不含EDTA的胰蛋白酶消化液(美国Gbico公司);鼠抗人波形蛋白单克隆抗体(vimentin)、鼠抗人角蛋白单克隆抗体(北京中杉公司);CCK-8试剂盒(C0038 Cell Counting Kit-8碧云天公司);完全培养基(血清浓度为20%):含双抗1640溶液 ∶胎牛血清=4 ∶1;鼠抗人波形蛋白单克隆抗体(vimentin);鼠抗人角蛋白单克隆抗体。
1.2 实验方法 将组织标本在无菌生物安全柜中用含有双抗的PBS液或无菌生理盐水清洗数次以去除血凝块,并尽量剪除结缔组织。在无菌培养皿中用组织剪和眼科剪将内膜组织剪成体积约1.0 mm3的碎颗粒,再用PBS溶液清洗组织块至清洗液清亮。静置数分钟,使组织块自然沉淀到管底,弃去上清;然后将剪碎的内膜组织用无菌镊转移至离心管中;加入PBS,1 000 r/min离心5 min,去上清,再次去除血凝块等杂质。加入0.25%不含EDTA的胰酶(约为组织体积的3倍),在37℃水浴箱中消化,到时间后用完全培养液终止消化。消化终止后入离心机1 000 r/min离心5 min,静置后,吸去上清,加1640培养基用吸管反复吹打组织块,使细胞分离,静置,使未分散的组织块下沉。用200目筛网研磨过滤后,过滤时须使滤网保持一定的张力,并用无菌镊轻轻拨动过滤组织,使其充分过滤,无菌离心管收集滤液(即为间质细胞)。取滤液加血清浓度20%含双抗完全培养基,轻轻吹打混匀后将细胞接种至六孔板中,并加上述培养液至2 mL细胞生长液置入六孔板中,置于37℃、CO2培养箱中培养。24 h后倒掉培养基,去除红细胞等非贴壁悬浮物,加入2 mL新的培养基继续培养。以后每2~3 d换液,倒置显微镜下观察间质细胞形态。
1.3 观察指标
1.3.1 细胞的鉴定 波形蛋白已被证明存在于间质细胞,所以波形蛋白可以作为一抗,采用细胞免疫组化法(SP法)对间质细胞进行鉴定。此染色过程中,用鼠抗人角蛋白单克隆抗体替代第一抗体做阴性对照。
1.3.2 光学显微镜观察 将无菌盖玻片放入六孔培养板中,消化分离后的间质细胞接种于六孔培养板盖玻片上,置于37℃、5%CO2培养箱中培养。从培养皿中取出间质细胞生长良好的载玻片,用 PBS液洗去原培养液,用95%乙醇固定,常规HE染色,光学显微镜下观察。
1.3.3 CCK8检测细胞增殖情况 细胞接种96孔板,细胞孵育0 h、24 h、48 h、72 h、96 h后分别加入CCK-8显色液,于37℃、5%CO2培养箱中孵育60 min。取出96孔板于酶标仪读取各孔OD450吸光值,绘制细胞增殖曲线。
1.3.4 流式细胞仪检测细胞凋亡情况 取105个细胞,1 200 r/min离心5 min,去上清液。每管加入50 μL 1×Binding Buffer,重悬,按以下分组加入染料:a.阴性对照:不加任何染料;b.单阳对照:加入5 μL FITC Annexin V;c.单阳对照:加入5 μL PI;d.样本管:加入5 μL FITC Annexin V和5 μL的PI。将溶液轻轻震荡后,避光在室温下(25℃)孵育15 min,分别加入400 μL 1×Annexin V Binding Buffer,在1 h内上机。
1.4 统计学分析 采用SPSS 19.0统计学软件处理数据,计量资料比较用独立样本t检验;重复测量资料比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 原代细胞分离培养情况 分离培养的15份正常子宫内膜标本,成功14份,分离培养成功率为 93.33%;分离培养的15份EMS异位内膜标本,成功13份,分离培养成功率为86.67%。
2.2 细胞类型鉴定结果 间质细胞波形蛋白染色呈阳性反应,细胞纯度达85%,经1次传代后,纯度可达90%以上。见图1。


图1 子宫内膜间质细胞免疫组化鉴定(A.正常内膜间质细胞,B.异位内膜间质细胞,20×)
2.3 两种间质细胞生长特点及形态差异
2.3.1 生长特点差异 正常子宫内膜间质细胞贴壁率高,均匀稳定生长,1周左右达到对数生长期。异位内膜间质细胞开始贴壁率低,生长缓慢,呈集落式生长,形成集落后生长迅速,呈肿瘤样旋涡状生长,常有中心坏死灶,一般需4周达到对数生长期。
2.3.2 形态差异 显微镜显示正常子宫内膜间质细胞分散生长,呈纺锤状,胞核不易看出,细胞之间无明显界限,大多平行排列。HE染色显示细胞形态均一。异位内膜间质细胞像肿瘤样集落抱团生长,胞核大,细胞分裂象多,细胞之间贴近密集生长,生长旺盛时常有局部缺血坏死。HE染色显色细胞形态大小不一,异质性明显。异位内膜间质细胞比正常子宫内膜间质细胞的细胞形态明显增大。见图2、图3。
2.4 传代情况 两组间质细胞均可传代8~10代,但是正常子宫内膜间质细胞5代后细胞生长明显减慢,异位内膜间质细胞7代后细胞生长开始减慢,细胞形态改变。

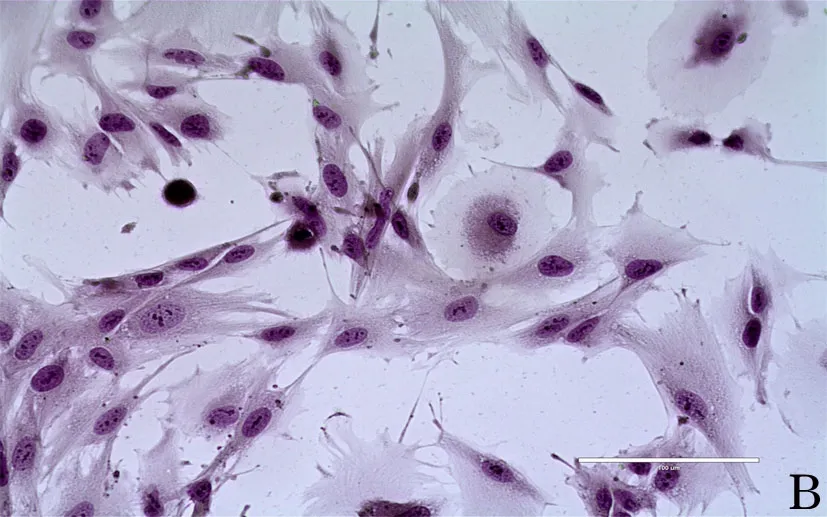
图2 正常子宫内膜间质细胞形态(HE染色,A:10×;B:40×)

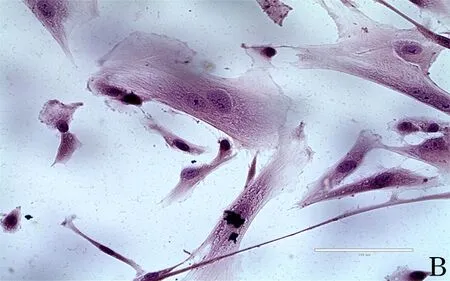
图3 异位子宫内膜间质细胞形态(HE染色,A:10×;B:40×)
2.5 细胞增殖率比较 子宫内膜异位症异位内膜间质细胞(ESC)比正常子宫内膜间质细胞(NSC)增殖旺盛。增殖48 h、72 h时ESC的细胞相对增殖率明显高于NSC,差异均有统计学意义(P48h<0.001;P72h<0.001)。见图4。

图4 细胞增殖率比较
2.6 细胞凋亡情况比较 24 h、48 h、96 h的NSC凋亡率明显高于ESC,差异均有统计学意义(P<0.001)。72 h时,NSC、ESC凋亡率比较,差异无统计学意义(P>0.05)。见图5。

图5 NSC、ESC凋亡情况
3 讨 论
子宫内膜异位症中异位的子宫内膜组织(腺体和间质)除了具有生长功能,还具有类似恶性肿瘤的增生、侵袭、黏附等恶性生物学行为[5],有一定的恶变率,但是其病因病机等基础研究一直没有明确的结论。这除了因为该疾病的异质性外,缺乏理想的实验模型也是一个重要的因素。目前该疾病的体内研究模型中最理想的是非人灵长类动物模型,但由于动物来源稀缺而且价格昂贵,不利于大样本研究。所以大多选用啮齿类动物和新西兰兔等,这些动物无月经周期,不会自发形成子宫内膜异位症,且具有一定的局限性,不能很好地模拟人体的真实情况。而体外模型因为能从多角度反映疾病的发展变化特征,从而成为研究疾病的重要手段。
一直以来研究者都在积极建立细胞系,但是效果不佳。从最早研究的由原代内膜间质细胞经猴空泡病毒40、SV40(simian virus40)转染而类永生化的内异间质细胞系被发现有高化例的畸形现象[6],再到后来文献报道应用端粒酶技术处理原代细胞而培养的异位内膜上皮细胞系Z11及异位内膜的间质细胞22B[7];另外也有HESC等细胞系[8]由实验室续转染处理后永生化,但有相当一部分被其他细胞系污染(如HELA),研究至今仍有使用代数较老、细胞状态不稳定等问题。因此针对EMS发病基础的生物学研究,一直缺乏稳定可靠的细胞系,EMS体外细胞实验仍主要以原代细胞培养为主,但是原代培养要求技术高,成功率低,为此我们在查阅相关文献的基础上,结合细胞的生长特点及我们的具体实践,摸索及改良了子宫内膜间质细胞的原代培养方法:①组织的取材需要注意避免污染,异位内膜组织要选取病变较新鲜同时有一定组织厚度的部分,该部分提示病变活跃,在进展期容易获得细胞。②个性化的组织消化时间非常重要。对于正常子宫内膜组织消化时间为30~60 min即可;针对不同厚度的异位内膜组织,消化时间控制在120~160 min,胰酶量为组织量的2~3倍较为合适,缓慢消化后得到的活性细胞较多。③针对异位内膜间质细胞不易贴壁的特点,选用不含EDTA的胰酶可减少对细胞的损伤,增加细胞贴壁率。④针对异位间质细胞具有类肿瘤的生长特性,我们选用了肿瘤细胞培养常用的1640培养基取代常规文献报道的培养基,并将培养液的血清浓度由10%提高到20%。⑤我们采用6孔板培养,比培养瓶培养容易在早期形成细胞集落,增加培养成功率。待孔板底基本生长满后移到培养瓶培养,此时细胞已进入生长旺盛期,培养更容易成功。通过多环节的改良,我们发现原代细胞培养成功率得到明显的提高,以上改良的实验方法国内外尚未见相关报道。
现有的研究发现,EMS患者在位及异位内膜存在细胞的异常增殖、异常程序性凋亡和降低的凋亡易感性[9-11],这些都促进了该疾病的存在及发展,多种分子生物学改变存在于内异症,包括已被报道的细胞存活信号的异常激活[12-14],但是具体的分子机制仍有待进一步明确研究。由此可见对EMS细胞中的相关机制研究,是研究发病机制的重要方式。为了证明我们建立的体外细胞模型仍具有疾病的特征,能成为疾病研究的良好模型,我们对于体外培养的细胞增殖及凋亡情况进行了相关的研究。结果表明:与正常子宫内膜间质细胞相比,异位内膜间质细胞增殖明显增强。在不同的时间点,正常子宫内膜间质细胞与异位内膜间质细胞的凋亡比较结果并不一致,其中72 h两者凋亡比较无差异,24 h、48 h、96 h三个时间点与正常子宫内膜间质细胞相比,异位内膜间质细胞明显凋亡减少,总体趋势表明异位内膜间质细胞的明显凋亡减少。由此可见,我们建立的体外细胞模型中细胞的生长特性与子宫内膜异位症的疾病特点是一致的,细胞生物学行为表现为增殖增强、凋亡减少的特性,可作为疾病机制研究的理想细胞模型。
子宫内膜异位症是一种激素依赖性疾病,为了排除激素水平对细胞的影响,我们均选用了增殖期的内膜组织。处于分泌期的内膜组织是否具有不同的特性,尚有待我们进一步的研究。
参 考 文 献
[1] Nap AW,Groothuis PG,Demir AY,et al. Tissue integrity is essential for ectopic implantation of human endometrium in the chicken chorioallantoic membrane[J].Hum Reprod,2003,18(1):30-34.
[2] Prechapanich J,Kajihara T,Fujita K,et al.Effect of a dienogest for an experimental three-dimensional endometrial culture model for endometriosis[J].Med Mol Morphol,2014,47(4):189-195.
[3] Shi JH,Yang YJ,Dong Z,et al. Morphological analysis on adhesion and invasion involved in endometriosis with tissue culture[J]. Chin Med J(Engl),2011,124(1):148-151.
[4] Ryan IP,Schriock ED,Taylor RN. Isolation,characterization,and comparison of human endometrial and endometriosis cells in vitro[J].J Clin Endocrinol Metab,1994,78(3):642-649.
[5] Bulun SE. Endometriosis[J].N Engl J Med,2009,360(3):268-279.
[6] Rinehart CA,Laundon CH,Mayben JP,et al.Conditional immortalization of human endometrial stromal cells with a temperature-sensitive simian virus 40[J].Carcinogenesis,1993,14(5):993-999.
[7] Zeitvogel A,Baumann R,Starzinski-Powitz A.Identification of an invasive,N-cadherin-expressing epithelial cell type in endometriosis using a new cell culture model[J].Am J Pathol,2001,159(5):1839-1852.
[8] Krikun G,Mor G,Alvero A,et al.A novel immortalized human endometrial stromal cell line with Nnrmal progestational response[J]. Endocrinology,2004,145(5):2291-2296.
[10] Garcia-Velasco JA,Arici A. Apoptosis and the pathogenesis of endometriosis[J].Semin Reprod Med,2003,21(2):165-172.
[11] Gebel HM,Braun DP,Tambur A,et al. Spontaneous apoptosis of endometrial tissue is impaired in women with endometriosis[J]. Fertil Steril,1998,69(6):1042-1047.
[12] Hornung D,Ryan IP,Chao VA,et al. Immunolocalization and regulation of the chemokine RANTES in human endometrial and endometriosis tissues and cells[J].J Clin Endocrinol Metab,1997,82(5):1621-1628.
[13] Kao LC,Germeyer A,Tulac S,et al.Expression profiling of endometrium from women with endometriosis reveals candidate genes for disease-based implantation failure and infertility[J]. Endocrinology,2003,144(7):2870-2881.
[14] Wu Y,Kajdacsy-Balla A,Strawn E,et al.Transcriptional characterizations of differences between eutopic and ectopic endometrium[J].Endocrinology,2006,147(1):232-246.

