自噬相关基因在烟曲霉自噬时的表达
邵建业,孙林,赵巍,王斌
(1.青岛大学生命科学学院,山东青岛 266071;2.青岛大学基础医学院,山东青岛 266071)
自噬与癌症、神经退行性疾病、各种人类发育过程有关,相关的自噬研究在过去十几年中显著增加[1]。在真菌中,cAMP信号通路参与多种生物学过程,并且已被证明对免疫抑制的侵袭性曲霉病鼠科动物模型的毒力至关重要。cAMP途径的主调控因子PKA是真核生物中重要的应激反应调节剂[2]。PKA为异四聚体,是细胞中调节生长、代谢、增殖的一个重要的信号分子。当cAMP与调节亚基结合时,发生构象变化,释放催化亚基使其自磷酸化并磷酸化下游靶标。当cAMP结合调节亚基时,会发生构象变化,其释放催化亚基自动磷酸化下游目标[3]。PKA信号通路参与了烟曲霉的生长、孢子的形成过程以及影响烟曲霉的毒力,但其对曲霉菌自噬的影响并不明确。
为研究烟曲霉中PKA与其自噬水平的关系,本实验采用ΔPkaR突变株和WT株,从孢子的存活率、菌丝营养获取能力、自噬小体的形态以及自噬相关的基因表达来反应自噬水平,验证烟曲霉中的自噬是否受PKA通路的调控,为丝状真菌中的自噬机制提供新的实验证据[4],争取为预防和治疗IA提供一个新的靶点。
1 材料和方法
1.1 材料
1.1.1 菌株
烟曲霉(A.fumigatus)野生菌株(简称WT)为美国辛辛纳提大学病理和实验医学系Judith C Rhodes教授惠赠,PKA调节亚基突变株(简称ΔPkaR)为本实验室构建,置于37℃恒温培养箱中孵育。
1.1.2 培养基
AMM液体培养基、AMM固体培养基、YG液体培养基、YG固体培养基、WA培养基。
1.2 方法
1.2.1 营养缺乏时营养吸收能力的检测
(1)收取AMM培养基上新鲜的孢子;(2)在4℃、4500r/min条件下离心5min,再用无菌蒸馏水清洗两次,然后重悬于无菌蒸馏水中;(3)显微计数,稀释孢子浓度至1×104个/mL,用移液枪吸取孢子悬浮液,用三角玻璃棒均匀涂布于平板上;(4)在37℃恒温培养箱中孵育24h,然后使用吸管从平板上取单个菌,移到WA平板的中心排布;(5)在37℃恒温培养箱中孵育4~5天,孵育24h时,开始测量菌落直径。
1.2.2 Real-time PCR法检测自噬相关基因的表达
将WT和ΔPkaR菌株的孢子以1.0×107个/mL浓度分别接种于AMM液体培养基,培养8.5~9h,然后转移到1.5mLEP管中离心弃上清,将菌体沉淀用灭菌过的滤纸进行进一步干燥处理。采用液氮研磨法破碎菌体后加Trizol提取总RNA,用反转录试剂盒转录为cDNA,再以cDNA为模板扩增。Real-time PCR反应体系见表1,反应参数:95℃预变性1min;95℃、15s,56℃、15s,72℃、1min,共40个循环。扩增反应完成后,应用软件设定阈值,使其处于扩增的指数增长期,并确定阈值循环数(Ct),计算Δ Ct(实验组内参照、目的基因的Ct值减去对照组内参照、目的基因的Ct值)和ΔΔ Ct(目的基因的Δ Ct值减去内参照基因的Δ Ct值),根据2-ΔΔCt计算实验组目的基因相对于对照组目的基因变化的倍数。扩增引物由上海生工生物工程有限公司合成,引物序列见表2,内参为GAPDH。

表1 Real-time PCR反应体系
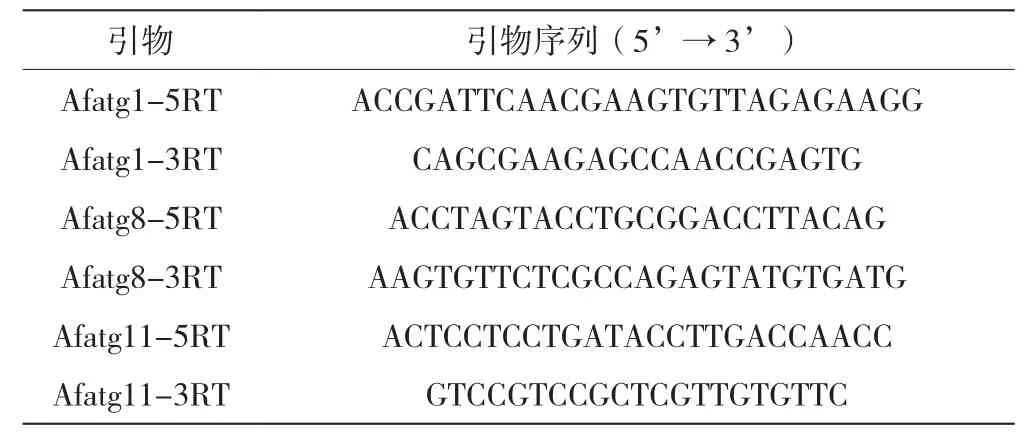
表2 实验所用引物
2 结果与分析
2.1 PkaR敲除对烟曲霉菌丝的觅食能力的影响
将已培养24h的WT和ΔPkaR菌的单菌落转移到YG和缺乏营养的WA培养基上,24h测一次菌落直径,结果如图1所示。由图1可知,WT 72h长满了整个平板,菌落直径6.5cm,ΔPkaR 120h达到最大直径4.2cm,表明PkaR的敲除影响了顶端菌丝的延伸,抑制了菌丝的伸长。转移到WA培养基上的菌株,WT菌丝生长速度减缓,168 h达到最大直径,但ΔPkaR72 h时停止生长,菌落直径1.5cm,WA培养基上缺乏营养,饥饿可以诱导自噬,表明自噬对烟曲霉菌丝的延伸没有影响。

图1 YG和WA培养基上菌落的变化
2.2 PkaR敲除对烟曲霉Atg1的mRNA水平的影响
对AMM培养基中培养了一段时间后的WT和ΔPkaR菌株提取RNA,进行Real-time PCR定量分析,结果如图2所示。由图2可知,与WT组相比,ΔPkaR组Atg1的mRNA水平显著上升,差别具有统计学意义(P<0.01)。以上结果表明,PkaR敲除后能增加Atg1的mRNA水平,PkaR可能抑制细胞自噬。
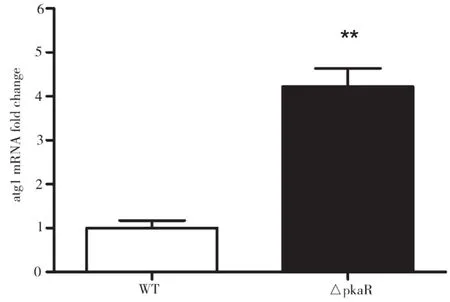
图2 PkaR敲除对烟曲霉Atg1的mRNA水平的影响
2.3 PkaR敲除对烟曲霉Atg8的mRNA水平的影响
对AMM培养基中培养了一段时间后的WT和ΔPkaR菌株提取RNA,进行Real-time PCR定量分析,结果如图3所示。由图3可知,与WT组相比,ΔPkaR组Atg8的mRNA水平显著上升,差别具有统计学意义(P<0.01)。以上结果表明,PkaR敲除后能增加Atg8的mRNA水平,PkaR可能抑制细胞自噬。

图3 PkaR敲除对烟曲霉烟曲霉Atg1的mRNA水平的影响。
2.4 PkaR敲除对烟曲霉Atg11的mRNA水平的影响
对AMM培养基中培养了一段时间后的WT和ΔPkaR菌株提取RNA,进行Real-time PCR定量分析,结果如图4所示。由图4可知,与WT组相比,ΔPkaR组Atg11的mRNA水平显著上升,差别具有统计学意义(P<0.01)。以上结果表明,PkaR敲除后能增加Atg11的mRNA水平,PkaR可能抑制细胞自噬。
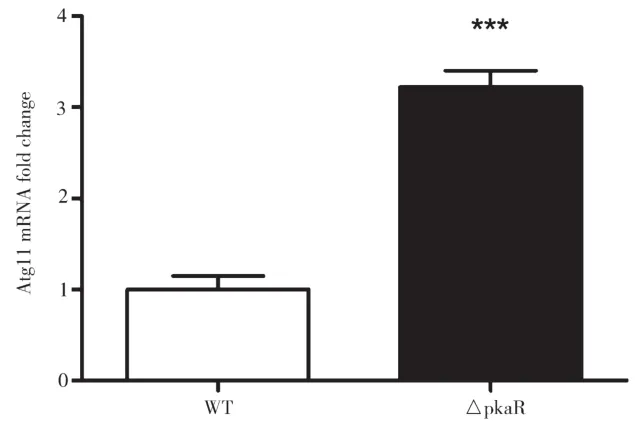
图4 PkaR敲除对烟曲霉Atg11的mRNA水平的影响
3 结论
(1)PKA调节亚基促进烟曲霉的自噬的发生。(2)PKA调节亚基可能是通过促进Afatg1、Afatg8和Afatg11的表达来提高烟曲霉的自噬水平。
烟曲霉是免疫缺陷宿主的重要致病性真菌病原体,普遍存在于人们周边,其孢子极小,漂浮于空气中,可随呼吸进入肺中[5]。在水分和足够的营养物质的存在下,如在哺乳动物肺中,休眠的分生孢子破坏代谢和细胞周期的休眠。经过一段时间的核分裂和各向同性生长(膨胀)后,每个分生孢子建立一个极轴,然后发展成侵入性菌丝,引起侵染性曲霉病[6]。因此,分生孢子萌发代表了烟曲霉生命周期中的关键过程,并且是吸入后,成为侵入性曲霉菌病发展中的第一个关键步骤。免疫功能健全的人,吸入的孢子会被自身免疫清除;而对免疫受损的个体,吸入的孢子则会引起侵染性曲霉病或过敏反应,危及生命[7]。
烟曲霉基因测序完成后,发现了大量未知功能的基因碱基序列。RNA干扰、基因敲除等基因功能的研究技术和方法,开始被应用于研究未知功能的基因,来试图找到烟曲霉的关键毒力因子[8]。而自噬是一种通常由饥饿应激触发的细胞存活反应,在真菌中,自噬的报道相对较少,但真菌的渗透性,菌丝体的生长发育和它们能侵入不均匀、营养缺乏的物质的非凡能力,有力地表明自噬可能是真菌生活方式的基础。
本实验证明,自噬的发生对烟曲霉分生孢子的存活率以及菌丝的生长有影响,但对其侵染性的作用未知。自噬通常被认为是促生存的过程,它对于细胞在细胞外环境中应对营养不足至关重要[9]。因此,当营养供应不足以满足细胞能量需求,或者当细胞暴露于不同形式的应激时,自噬就会上调。在这些条件下,一些研究表明自噬作用可以保护细胞免受各种真核生物的死亡。然而,自噬也被证明是细胞死亡的一个促成因素,是真核生物中存在一种非凋亡性程序性细胞死亡途径,这种途径取决于自噬基因[10]。在大多数情况下,这些自噬的双重作用可能取决于当时的细胞外环境条件。已经了解TOR激酶在感染相关自噬的启动中和PKA信号潜在的相互作用,对其附着胞形态发生是必需的,因此,在烟曲霉中了解TOR激酶和PKA信号的潜在联系,以及烟曲霉自噬的基因组分析,对于了解烟曲霉感染至关重要[11]。如果能验证自噬在烟曲霉侵染过程中的重要性,控制烟曲霉自噬的发生,可能成为开发新型抗真菌药物提供新的靶标。
[1]Ohsumi Y. Historical Landmarks of Autophagy Research[J]. Cell Research,2014,24(1):9-23.
[2]Berry A, Han K, Trouillon J, et al. cAMP and Vfr Control Exolysin Expression and Cytotoxicity of Pseudomonas Aeruginosa Taxonomic Outliers[J]. Journal of Bacteriology,2018:18.
[3]Schrevens, S., et al., Methionine is Required for cAMP-PKA-mediated Morphogenesis and Virulence of Candida Albicans[J]. Molecular Microbiology,2018.
[4]Klionsky D, Aghi M, Agam G, et al. Guidelines for the Use and Interpretation of Assays for Monitoring Autophagy (2nd edition)[J].Autophagy,2016,4(1):151-175.
[5]Richie D, Fuller K, Fortwendel J, et al. Unexpected Link between Metal Ion Deficiency and Autophagy inAspergillus fumigatus[J]. Eukaryotic Cell,2007,6(12):2437-2447.
[6]Nadal M, SE Gold. The Autophagy Genes ATG8 and ATG1 Affect Morphogenesis and Pathogenicity in Ustilago maydis[J].Molecular Plant Pathology,2010,11(4):463-478.
[7]Pollack J K, Harris S D, Marten M R. Autophagy in Filamentous Fungi[J].Fungal Genetics & Biology Fg & B,2009,46(1):1-8.
[8]JS Stephan, YY Yeh, V Ramachandran, et al. The Tor and PKA Signaling Pathways Independently Target the Atg1/Atg13 Protein Kinase Complex to Control Autophagy[J]. Proc Natl Acad Sci U S A,2009,106(40):17049-17054.
[9]Feng D, Liu L, Zhu Y, et al. Molecular Signaling Toward Mitophagy and its Physiological Significance[J]. Experimental Cell Resear ch,2013,319(12):1697-1705.
[10]Richie, DL, DS Askew0 Autophagy: A role in metal ion homeostasis?[J].Autophagy,2014,4(1):115-117.
[11]Li X, Cullere X, Nishi H, et al. PKC-δ Activation in Neutrophils Promotes Fungal Clearance[J]. J Leukoc Biol,2016,100(3):581-588.

