我院药品不良反应快速上报信息化系统应用效果研究分析
李 忻,于 倩,郭义明(吉林大学中日联谊医院药学部,吉林 长春 130033)
药品不良事件(adverse drug event,ADE)是药物治疗过程中的现象,从产生的成因出发,可对药品不良事件进行分类,包括药品标准缺陷、药品质量问题、药品不良反应(adverse drug reaction,ADR)、用药失误以及药品滥用等多种方面[1]。ADR是指合格药品在正确的用法用量下出现的与用药目的无关的有害反应,是药物治疗中伴随的风险[2]。ADR/ADE监测工作是药品监督管理系统的一个首要组成部分,是保证广大人民群众安全用药的必要手段[3],其上报工作的质量直接影响患者用药的风险。统计分析显示,2016年ADR/ADE报告按来源统计,来自医疗机构的报告构成比为85.6%[4]。欲发挥这一体系的预期效果,取决于不良反应监测实践中ADR/ADE报告的数量和质量。我院的ADR/ADE报告监测手段不完善,导致报告率低、数据质量低,大量的ADR/ADE不能及时准确地上报。自2015年10月开始,我院采用引自解放军ADR监测中心的“医疗机构ADR报告与管理系统”不仅提高了ADR/ADE上报的质量,而且提高了ADR/ADE上报的工作效率[5]。
1 资料与方法
ADR快速上报信息化系统引自解放军ADR监测中心的“医疗机构ADR报告与管理系统”,分为报告采集、校正评价、查询统计、频数预警、数据分析、信息反馈、宣教培训、布局管理、数据同步共9个部分,具有开放式登录分层授权、对接HIS系统采集信息、报告项目模块化、关键信息结构化、各级原始数据保存完整、标准化数据审查、一键式数据同步等优势。
采用回顾性分析方法,对于我院2014 – 2016年上报国家药品不良反应监测中心的ADR/ADE报告(2014年218例,2015年709例,2016年915例),按报告病例无记录、病例有记录未上报及怀疑药品不良反应病例等进行统计分析。对传统不良反应上报流程与运用快速上报信息化系统上报的ADR/ADE报告程序进行分析对比。
2 结果
2.1 2008 – 2016年ADR/ADE上报情况
我院从2008年开始通过“国家药品不良反应监测系统”在线上报ADR/ADE工作,2008 – 2016年ADR/ADE上报情况见图1。
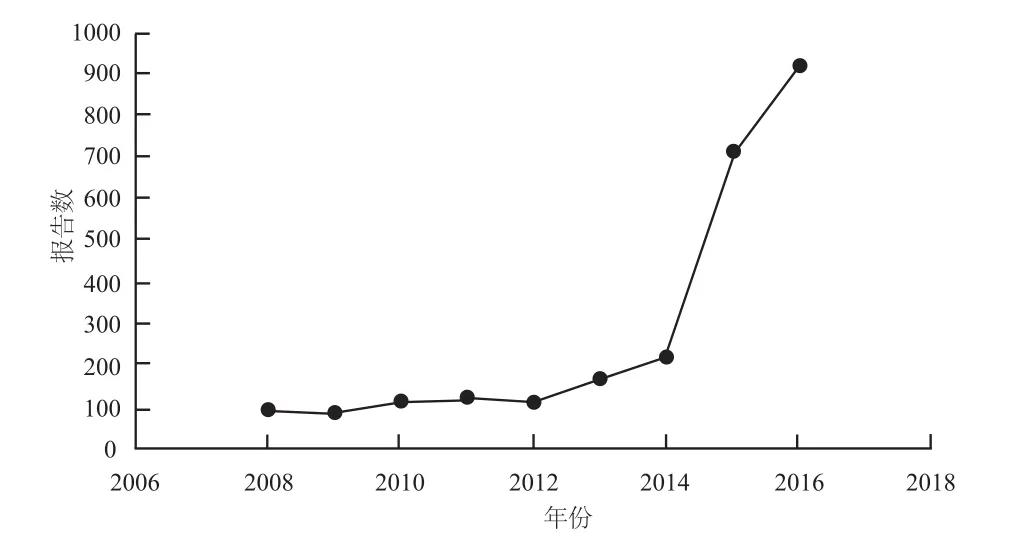
图1 2008 – 2016年ADR/ADE上报情况Fig 1 ADR/ADE reports during 2008 – 2016
2.2 2014 – 2016年ADR/ADE上报数量及质量
2014年1月 – 2015年9月,我院ADR/ADE的上报是由各科室ADR/ADE信息员对发生的ADR/ADE填写纸质报告并上报,药学部ADR/ADE管理员首先对各科室上报的ADR/ADE纸质报告进行校正、评价,再将信息逐条在线录入到“国家药品不良反应监测系统”中;2015年10月开始运用快速上报信息化系统上报ADR/ADE,2016年正式全面开展,同时我们对上报的ADR/ADE病例进行反查,按ADR/ADE报告病例无记录、病例有记录未上报及怀疑等ADR/ADE报告进行分析,其报告情况、报告的合格率及漏报率结果见表1。
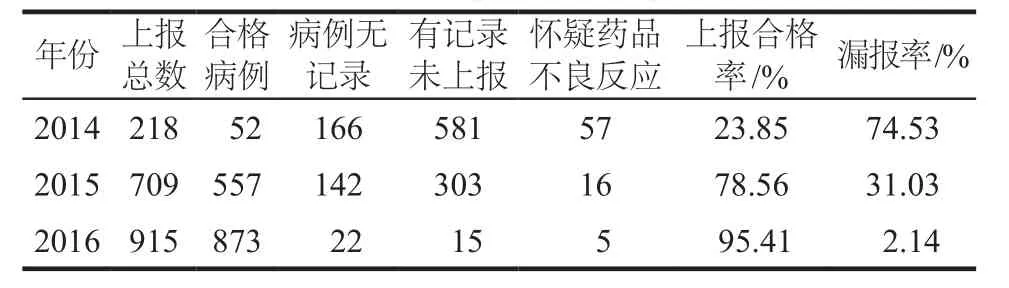
表1 2014 – 2016年ADR/ADE上报情况Tab 1 ADR/ADE reports during 2014 – 2016
2.3 传统不良反应上报流程与运用快速上报信息化系统流程对比
两种报告系统的工作流程基本相同,只是在数据的采集及上报的工作内容有所不同。
2.3.1 传统不良反应上报工作流程逐一填写药品不良反应/事件报告表电子版信息,发送药学部工作站(外网)→管理员对电子版表格进行信息校正、评价并打印→管理员在线录入国家药品不良反应监测系统网站。
2.3.2 运用快速上报信息化系统工作流程(1)ADR监测事件创建:监测员登录之后,可以根据患者ID号自动提取相关信息,自动创建ADR事件的基本信息。监测员根据ADR事件的实际情况进行数据的补充和筛选,并做出初步的判断后保存。系统会自动对必要数据进行监测,提示数据补充完整。(2)ADR事件评价:评价员登录系统后,可以对系统内尚未进行处理的ADR事件进行评价。评价信息内容覆盖国家药品不良反应监测中心的数据要求,确保信息完整。(3)数据导出和导入:数据管理员登录之后,对已经评价过的数据进行数据的导出,并可将加密导出的文件在外网提交到国家不良反应监测中心系统中。
2.4 运用快速上报信息化系统上报减少ADR/ADE上报工作量
在两种报告系统中,除校正和评价等所用的时间基本相同外,其他两个操作环节相差较大。对于从事药品不良反应上报工作比较熟练的信息员,填写一份ADR/ADE纸质报告所用的时间通常为5 ~ 10 min,平均时间为7 min;对于从事药品不良反应上报工作比较熟练的管理员,于“国家药品不良反应监测系统”在线录入一份报告所用的时间通常为5 ~ 10min,平均为7 min;校正评价用时为2 min。以我院2016年平均每月上报77份ADR/ADE报告为例(2016年共计上报ADR/ADE报告915例,平均每月上报76.25份),填写、校正、评价及上报ADR/ADE所用时间为1080 min。而运用快速上报信息化系统上报流程中因录入登记号后信息自动生成,稍加修改即可完成,从ADR/ADE报告生成、校正及评价所用时间仅为164 min。把每次评价完成的数据打包,利用外网国家ADR/ADE中心接口上传即可,每次所用时间为2 min,按每周评价一次(无论ADR/ADE报告数量多少),每月4次,上报整月药品不良反应的时间最多用8 min,运用快速上报信息化系统每月填写、校正、评价及上报ADR/ADE所用时间仅为164 min,较传统不良反应上报节省报告时间约84.81%,详见表2。
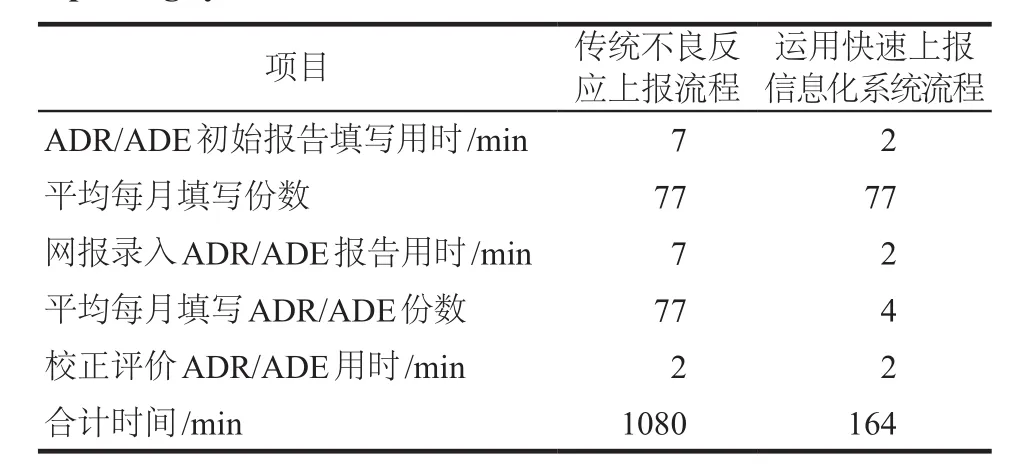
表2 两种药品不良反应上报系统用时对比Tab 2 Comparison of reporting time of the two ADR reporting systems
3 讨论
3.1 运用快速上报信息化系统流程提高了我院ADR/ADE上报的数量与质量
3.1.1 报告数量国际上曾把每百万人口平均报告药品不良反应/事件400份作为工作开展较好国家的统计基本数据[6]。WHO在发展中国家的调查资料显示,10% ~ 20%住院患者会发生ADR/ADE,其中5%的患者住院原因是发生了ADR/ADE[7]。根据我院服务的人口及收治的住院患者计算,我院ADR/ADE的报告数量每年应至少在900 ~ 1000例左右,然而在2008 – 2014年我院ADR/ADE报告数量在84 ~ 218例之间,这样的报告数量不能真实地反映我院ADR/ADE的发生情况。我院于2015年10月开始运用快速上报信息化系统流程,2016年正式全面开展。因其直接与我院的HIS系统相连接,只录入患者的登记号或ID号,就能自动从HIS系统中提取患者的基本信息及使用药品信息,并通过阅读病例,就可以将发生的或怀疑的ADR/ADE进行填写上报。2015 – 2016年我院ADR/ADE上报数量分别为709例和915例,较2008 –2014年的84 ~ 218例有了大幅度提升。运用快速上报信息化系统大大的提高了我院ADR/ADE上报报告的数量。
3.1.2 报告质量ADR/ADE的上报工作对于发现药品安全信息、控制药品风险、促进临床合理用药、加强药品监管安全等方面发挥着重要的作用[8]。ADR/ADE上报工作的质量直接影响患者用药的风险。不良反应报告的质量包括ADR/ADE报告的合格率和漏报率。报告的真实性、规范性、完整性是合格的ADR/ADE报告所应具备的,对于每份上报的ADR/ADE报告我们都与患者病例中记录的不良反应发生过程、使用的药品相关信息及发生时间等内容进行复核;同时对病例中记录发生ADR/ADE及怀疑发生ADR/ADE的病例要求上报。运用快速上报信息化系统上报可以使我们在评价发生ADR/ADE报告的同时,通过HIS系统对病例进行筛查,找出上报不合格的ADR/ADE报告及没有上报的ADR/ADE报告,并针对具体情况进行校正、评价,经此处理后ADR/ADE报告的合格率得到提高,ADR/ADE报告的漏报率减少。我们对2014 – 2016年上报的所有ADR/ADE报告进行逐一筛查,2014年、2015年和2016年ADR/ADE报告合格率为23.85%、78.56%和95.41%;漏报率为74.53%、31.03%和2.14%,大大减少了ADR/ADE报告的漏报率。上报的不良反应病例中未记录及怀疑未上报的原因如下:1)患者发生的不良反应临床表现较轻微,停药即痊愈,医生未在病程中记录。2)部分医生未遵循不良反应怀疑即上报的原则。
3.2 运用快速上报信息化系统的优势
两种ADR/ADE上报的工作流程大体接近,但在具体环节上,运用快速上报信息化系统较传统不良反应上报无论是从ADR/ADE初始报告的获取、填写,还是对ADR/ADE初始报告的校正、评价,或是最终的在线网报上所用时间等都体现出方便快捷,客观真实。
3.2.1 减免手工填写报告的复杂性,降低ADR/ADE监测管理人员事务性工作传统不良反应上报模式是由临床医师和护士及药师等药品不良反应信息员对发生ADR/ADE的病例进行手工填写,由药品不良反应管理员对纸质报告进行转录,纸质报告填写与转录的工作较为繁杂,这些事务性工作占据了大量时间。而运用快速上报信息化系统进行ADR/ADE上报,报告全部由HIS系统自动生成,稍加校正即可完成报告。
3.2.2 优化报表结构,强化信息质量传统不良反应上报在手工采集、管理数据方面存在工作效率低、主观偏差大;信息沟通不畅通、主观性过强而导致时间滞后、报告填写存在畏难情绪;在线报告受网络条件限制;报告的填写与录入需培训,受人员变动影响较大等多种问题。而运用快速上报信息化系统全部自动化采集和管理数据,信息员及管理员的工作在同一系统,可及时对上报的ADR/ADE进行校正、评价,发现问题及时反馈;报告不受网络条件限制;人员变动只需互相交接即可上岗工作。
3.2.3 便于医疗机构药品安全监管传统不良反应上报存在纸质报告获取、传送、保管不便捷;录入后的信息如需查询必须进入国家药品不良反应监测系统导出,医疗机构无法对发生ADR/ADE的药品进行及时、安全、有效监管。而运用快速上报信息化系统上报的ADR/ADE数据可根据需要随时调取(ADR/ADE发生的科室、药品、严重程度、临床表现等),如2014年我院注射用复方三维B(Ⅱ)致ADR/ADE 4例[9],2015年18例[10];2016年我院注射用细辛脑致ADR/ADE 26例[11];2016年我院果糖类注射液或果糖类注射液作为药物溶媒致ADR/ADE 13例[12];2014 – 2016上半年我院氟喹诺酮类药品致ADR/ADE 111例[13];2016年我院硫酸依替米星注射液致ADR/ADE 1例[14];2016年我院注射用核糖核酸Ⅱ致ADR/ADE 1例[15];2016年我院红花黄色素氯化钠注射液致ADR/ADE 1例[16];2017年我院盐酸多柔比星脂质体注射液致ADR/ADE 1例[17]。根据快速上报信息化系统提供的数据支持对我院2016年上报的915份ADE进行了用药分析[18],对于ADR/ADE发生率较高的科室、发生率较高的药品及新的或严重的ADR/ADE及时与临床沟通并加以关注,便于对药品安全监管。
3.2.4 提高ADR/ADE整个团队的工作效率我们在实际工作中对两种上报流程中所用的时间进行了对比分析,以平均每月上报77份为例,运用快速上报信息化系统上报所用时间为164 min;传统不良反应上报所用时间为1080 min,工作效率提高了84.81%。在ADR/ADE报告在线网报的频次上,运用快速上报信息化系统上报可以每月进行4次评价上报(每周评价上报1次);而传统不良反应上报每月有多少份ADR/ADE报告就需评价上报多少次。因此运用快速上报信息化系统大大提高了ADR/ADE整个团队的工作效率。
综上所述,医疗机构仍是我国ADR/ADE报告的主要来源,提升其监测水平对国家ADR/ADE监测工作具有重要意义。“医院机构ADR报告与管理系统”有利于提高报告效率、保证报表质量、扩大监测网络覆盖面,为药品安全评价和科学监管提供可靠的依据,有力提升医院的预警能力及合理用药水平。
[1] 高建超,李岚,夏东胜,等.药品不良事件的经济成本研究案例分析[J].中国药物警戒,2015,12(10):607-610.
[2] 朱曼,郭代红,凡超,等.军队医院22 605例抗感染药物药品不良反应/事件报告分析[J].中国药物应用与监测,2015,12(5):284-288.
[3] 韩建红.浅谈药品不良反应监测工作现状与对策[J].山西医药杂志,2014,43(23):2769-2771.
[4] 国家食品药品监督管理局.国家药品不良反应监测年度报告(2016年)[EB/OL].(2017-04-28)[2017-05-18]. http://www.sda.gov.cn/WS01/CL0844/172167.html.
[5] 陈超,郭代红,刘皈阳,等.医疗机构药品不良反应监测的优化实践[J].中国药物警戒,2010,7(3):164-168.
[6] 李季梅.加强管理提高药品不良反应报告数量和质量分析[J].首都医药,2013,(12):37-39.
[7] 胡文俊,蔡吉芬.我国药品不良反应报告与监测现状分析[J].中国药物警戒,2012,9(2):92-94.
[8] 任清兰.我院2011 – 2013年药品不良反应报告分析[J].中国药物与临床,2015,15(8):1184-1186.
[9] 朱昆,李忻,刘玉梅.278例药品不良反应分析[J].中国药物应用与监测,2015,12(5):288-291.
[10] 李忻,于倩,王华.9441例注射用复方三维B(Ⅱ)的合理用药评价[J].中国药物应用与监测,2016,13(5):290-292.
[11] 党安建,于倩,李忻.5554例注射用细辛脑的合理用药评价[J].中国药物应用与监测,2017,14(2):121-123.
[12] 党安建,严明兰,于倩.19 468例果糖类注射液合理用药评价[J].中国药物应用与监测,2017,14(5):301-304.
[13] 尹航,谢程.111例氟喹诺酮类药品不良反应/事件临床分析[J].中国药物应用与监测,2017,14(3):163-165,182.
[14] 赵天毓,朱昆,严明兰.硫酸依替米星注射液致不良反应1例[J].中国实验诊断学,2017,21(4):712-713.
[15] 崔海珍,赵天毓,关丽英.注射用核糖核酸Ⅱ致不良反应1例[J].中国实验诊断学,2017,21(11):2015-2016.
[16] 朱昆,于倩,李忻.红花黄色素氯化钠注射液致不良反应1例[J].中国实验诊断学,2017,21(10):1796-1797.
[17] 毕铁琳,严明兰,赵天毓.盐酸多柔比星脂质体注射液致不良反应1例[J].中国实验诊断学,2017,21(9):1639-1640.
[18] 尹航,郭鑫,李忻.915例药品不良事件用药分析[J].中国药物应用与监测,2017,14(5):289-292,316.

