行择期结直肠手术的老年患者术后肺部并发症的相关因素
桑阿明,柴军,谭媚月,陶倩云,陈丽娜
(中国医科大学附属盛京医院麻醉科,沈阳 110004)
术后肺部并发症 (postoperative pulmonary complications,PPC) 是影响手术患者预后的常见因素,它可以延长住院时间,增加诊疗费用,提高死亡率。近年来随着人口老龄化的进展,行肠道手术的患者年龄呈逐渐升高趋势。老年患者PPC越来越受到重视,但导致老年患者PPC的相关原因尚不确定,尤其肌肉松弛药的应用与拮抗、老年患者不同年龄亚群分组以及术后静脉镇痛泵的应用与老年患者PPC的联系少有研究。本研究回顾性分析行择期结直肠手术的老年患者PPC的围术期相关危险因素,为更好地预防和控制老年患者发生PPC提供参考。
1 材料与方法
1.1 一般资料
选择2014年10月至2017年3月间在中国医科大学附属盛京医院行择期结直肠手术的老年患者,均采用静吸复合气管插管全身麻醉方法,术后1周内常规行腹部CT检查。纳入标准:年龄≥65岁;行择期结直肠手术;术前有胸部CT平扫或DR等影像学检查。排除标准:年龄<65岁;未经腹的结直肠手术;急诊手术;肺部影像学资料不全;术前有严重心肺功能不全 (如陈旧性心肌梗死、心绞痛、呼吸衰竭、急性肺炎等) ;严重肝肾功能不全等。
1.2 研究方法
利用本院医院信息系统收集病历资料,纳入患者445例,其中男253例,女192例。采集病历指标包括患者一般资料 (性别、年龄、ASA分级) 、病史 (抽烟、饮酒、高血压病史、糖尿病病史、肺部基础疾病病史、心肌缺血病史) 、术前入院检查 (患者术前血红蛋白、白蛋白、影像学、实验室检查) 、手术相关资料 (术式、手术时长、术中输血量、术后肌松药拮抗剂的应用、术后疼痛) 等。
PPC定义:PPC为在院期间发生的与临床诊疗相关的呼吸系统功能紊乱。PPC的诊断基于临床症状 (咳嗽、咳痰、发热、指脉氧低于90%、呼吸困难) ,并且影像学上术后肺部CT较术前肺部影像学检查有明显新增改变 (胸腔积液、肺不张、肺部分实变、肺部炎性浸润扩展等) 。PPC包括术后肺炎、肺不张、胸膜渗出、肺栓塞、呼吸衰竭、气胸、急性呼吸窘迫综合征等。对比分析老年患者术后CT与术前肺部影像学检查结果,按术后有无PPC将445例患者分成PPC组和非PPC组,对2 组中上述影响因素 (患者一般资料、病史、术前检查、手术资料) 的差异进行统计学分析,评价哪些影响因素与行结直肠手术的老年患者PPC密切相关。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析,正态分布计量资料采用±s表示,采用t检验比较组间差异;偏态分布的计量资料以中位数 (四分位间距) 表示,计数资料采用χ2检验,所有有统计学差异的因素采用二元logistic回归分析找出提示PPC的独立危险因素。P< 0.05为差异有统计学意义。
2 结果
2.1 患者一般资料和病史与PPC的相关性
单因素分析显示,高龄 (年龄≥75 岁) 、ASA>Ⅱ级、开腹、术前血红蛋白、白蛋白、术中输血、肺部基础疾病、高血压和心肌缺血是PPC的危险因素。组间患者性别、术后镇痛、肌松拮抗、糖尿病史、吸烟、饮酒史无统计学差异 (P> 0.05) 。见表1。PPC组术后住院时间 (17.449 ±7.4192) d,非PPC组术后住院时间 (13.051±5.7379) d,PPC大大延长了术后住院时间 (P< 0.001) 。
2.2 术前检查与PPC的相关性
术前血红蛋白<100 g/L是PPC的危险因素(OR=3.598,P< 0.001) ;白蛋白<35 g/L的患者发生PPC的概率较大 (OR=2.571,P= 0.007) 。见表1。
2.3 手术因素与PPC的相关性
在结直肠手术中,开腹相对于腹腔镜手术患者发生PPC的概率更大 (P= 0.004,OR=2.687) ;术中输血大大提高了发生PPC的风险 (OR=3.345,P= 0.002) 。术后使用肌松药拮抗剂 (新斯的明)、应用镇痛泵与患者PPC发生率无明显相关性。见表1。
2.4 PPC的独立危险因素
将年龄≥75岁、ASA>Ⅱ级、高血压、心肌缺血、肺部基础疾病、术前血红蛋白<10 g/L、白蛋白<35 g/L、开腹、术中输血这些有统计学差异的因素纳入二元logistic回归分析中,得出ASA>Ⅱ级和开腹为PPC的独立危险因素。见表2。
3 讨论
PPC很常见,可以延长住院时间,增加诊疗费用,提高死亡率[1-3]。已有研究[4]表明PPC发病率可高达13.1% (本研究中PPC的发病率为11%) ,且PPC导致的患者死亡在院内死亡人数中超过2/3。随着老龄化进程的推进,结直肠癌患者年龄呈逐渐升高趋势,其中28%的患者年龄>80岁[5],而且结直肠癌患者在围术期内大多存在免疫功能下降和营养不良,这些都提高了PPC的风险,因此本研究选择行择期结直肠手术的老年患者 (年龄≥65岁) 作为观察对
象。
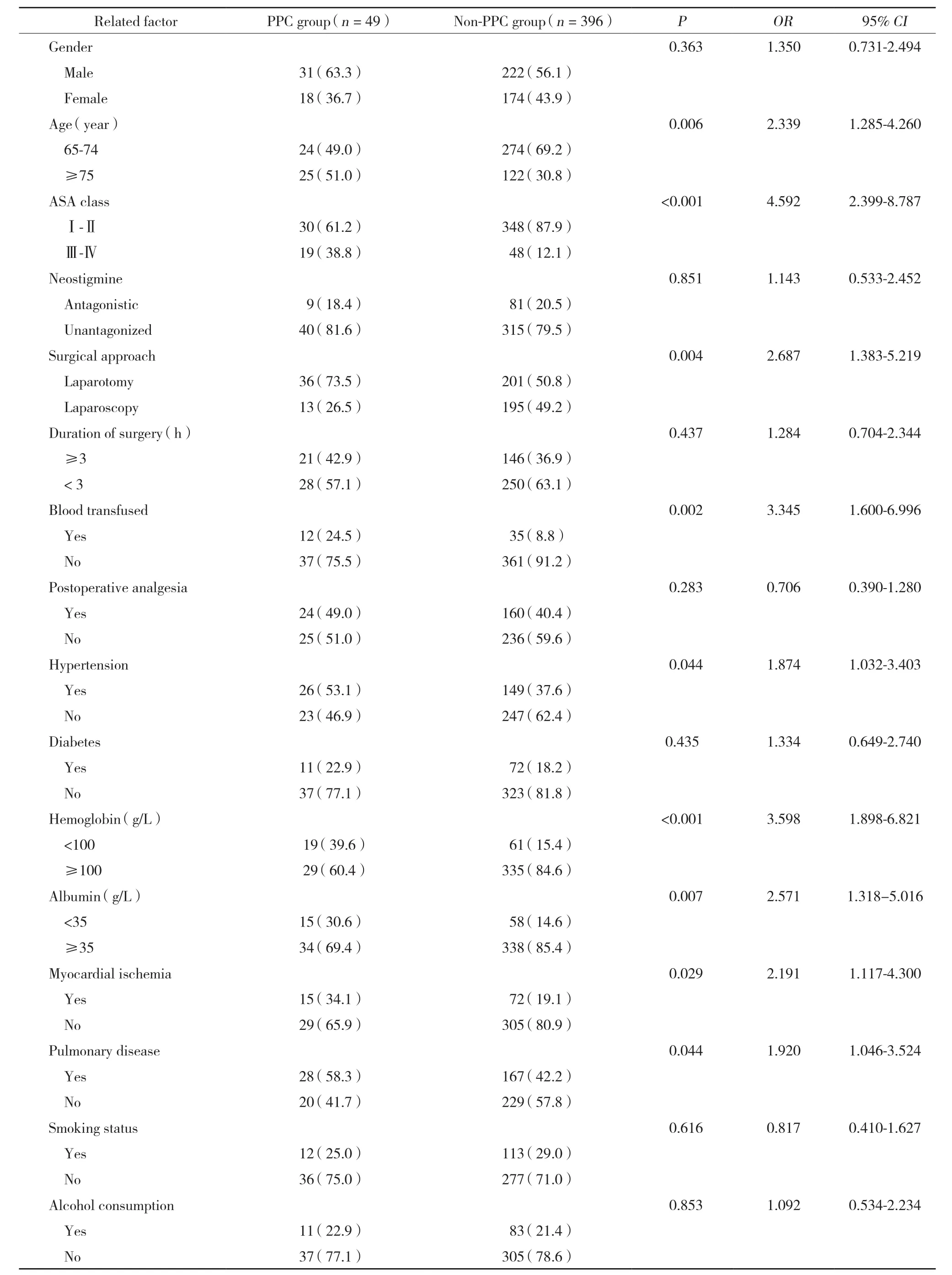
表1 PPC影响因素的单因素分析结果 [n (%) ]Tab.1 Univariate analysis of risk factors associated with postoperative pulmonary complications [n (%) ]

表2 PPC围术期危险因素logistic多因素回归分析结果Tab.2 Results of logistic multifactor regression analysis performed on the risk factors associated with postoperative pulmonary complications
高龄是PPC重要的危险因素。高龄患者的肺弹性和胸壁顺应性下降,肺泡残气量增加,对高碳酸血症和低氧血症的低反应性[6],导致老年患者更易出现呼吸肌疲劳和上呼吸道梗阻。世界卫生组织定义65岁以上为老年,但老年人不是一个简单的集合,NEUGARTEN[7]在1974年将老年这个群体分出几个亚型,至今沿用:55~75岁定义为“young-old”,75~85岁为“old-old”,≥85岁为“very old”。亚型分组不同,老年人肺功能也存在明显差别。以往相关研究都是将老年患者作为泛化单一群体,并未考虑不同年龄分组对PPC的影响,本研究按照年龄将老年人分为65~74岁组 (young-old组) 和≥75岁组 (oldold组) ,这更有利于对老年患者中PPC预防和治疗进行细致深入研究。本研究结果发现,在老年患者中old-old组的PPC患病率 (17.0%) 明显高于young-old组 (8.1%) ,这提示结直肠手术患者中≥75岁的老年人更容易发生PPC,对于高龄老年人术前评估、围术期预防PPC更要引起足够的重视,术前更要关注加强呼吸功能锻炼,改善肺部基础疾病,术后积极预防PPC的发生。
除了年龄之外,PPC另一大影响因素就是肌松药的应用。这可能和术后肌松残留导致的残留性麻痹有关。术后膈肌、肋间肌等肌群的残留性麻痹使患者的肺活量和功能残气量降低,从而不能进行有效的呼吸和咳痰,增加了肺不张、肺炎的概率。手术中应用肌松药增加PPC的发病率,并与剂量呈正相关,而适量的拮抗剂却可以降低PPC的发病率[8]。本研究中89例患者术后进行了新斯的明拮抗 (剂量为15~20 μ g/kg) ,355例患者没有给予肌松拮抗,拮抗组和非拮抗组PPC发生率没有统计学差异 (P=0.851,OR=1.143) ,这很可能与我院的麻醉管理方法有关。我院麻醉医生比较注重肌松的恢复与用量,诱导时给予小剂量肌松剂 (2~3倍95%的有效药物剂量) ,术中维持也采用较小剂量 (约1倍95%的有效药物剂量) 肌松剂,手术结束前最后1 次给予肌松剂也是满足手术要求的最小剂量。术毕绝大多数患者肌松恢复良好,这可能是拮抗和非拮抗组无统计学差异的重要原因。考虑到术式 (开腹和腹腔镜) 的影响,分别在开腹和腹腔镜患者中对比分析术后有无应用拮抗剂 (新斯的明) ,同样无统计学差异。
结直肠手术术式的选择 (腹腔镜和开腹) 也可以影响老年人PPC的发病率。在WELLER等[9]的研究中 (n= 19516) ,开腹患者PPC的发病率是腹腔镜的2倍。这大概是因为腹腔镜术后患者的疼痛明显比开腹患者要轻,术后恢复快,这有利于促进术后患者深呼吸、有效的咳痰、增加肺容量,从而有利于降低患者PPC的概率。本研究中,开腹患者 (n= 237)PPC发生率为15.19%,腹腔镜患者 (n= 208) PPC发生率为6.25%,结直肠开腹手术患者PPC发病率是腹腔镜的2.4倍,与WELLER等的研究一致。同时在众多危险因素中,开腹也是PPC的一个独立的危险因素。所以在条件允许的情况下,尽可能选择腹腔镜术式,可以降低老年患者PPC的发生。
本研究还观察了术后镇痛对老年人PPC的影响。结直肠手术术中膈肌上抬,可能导致下肺膨胀不良。术后的切口疼痛使患者不敢深呼吸,从而影响膈肌运动,使得肺下叶复张困难[10],长时间的肺不张最终将导致肺部感染的概率大大增加[11]。因此,术后镇痛可有效地预防术后肺不张,减少PPC的发生。本研究中所有患者均单次给予镇痛剂 (短时镇痛数小时) ,其中184例患者另外应用了术后静脉镇痛泵 (长时镇痛,50 h) ,261例患者没有另外使用镇痛泵。本研究结果表明,术后应用镇痛泵对PPC发生率无明显影响。为了排除术式对研究结果的影响,本研究分别对比分析开腹和腹腔镜术式术后静脉镇痛泵的应用,PPC发病率仍无统计学差异。这可能是因为单次给予的镇痛剂有效地减轻了术后早期疼痛,或者样本量有限,不足以证实术后长时镇痛对PPC的影响。
本研究涉及的患者为高龄患者,常伴随多种并存病,所以本研究将行择期结直肠癌根治术且术前严重贫血 (血红蛋白<100 g/L) 、合并心肺等脏器基础疾病的患者定义为ASA Ⅲ级。本研究中ASA>Ⅱ级是PPC的一个独立的危险因素 (P< 0.001;OR,4.592;95%CI,2.399~8.787) ,这也与一些研究[12]结果一致。
肺部基础疾病患者肺通气受限,肺组织过度膨胀,顺应性降低,呼吸膜增厚,降低气体弥散速率,减少弥散量,这些因素将促进PPC的发生[13]。因此,术前对并存肺部基础疾病的患者要重视肺功能测定,指导呼吸和咳嗽训练[14],术中行保护性肺通气策略 (小潮气量+合适的呼气末正压)[15-16],术后有效的吸痰胀肺,避免长时间卧床等,有助于降低PPC的发病率。
老年患者行择期结直肠手术中,年龄分组非常重要,old-old组老年患者应得到更大的关注。开腹、ASA>Ⅱ级是PPC发生率升高的独立危险因素。术前加强对高龄组老年患者的全面评估、对ASA>Ⅱ级的患者重点关注、术中合理的应用肌松药以及尽量选择腹腔镜术式,可以有效地降低PPC的发生率。另外,积极治疗肺部基础疾病和其他合并症、纠正贫血及营养状态也是减少PPC的有效措施。
[1]YANG CK,TENG A,LEE DY,et al. Pulmonary complications after major abdominal surgery:national surgical quality improvement program analysis [J]. J Surg Res,2015,198 (2) :441-449. DOI:10.1016/j.jss.2015.03.028.
[2]SABETE S,MAZO V,CANET J. Predicting postoperative pulmonary complications:implications for outcomes and costs [J].Curr Opin Anaesthesiol,2014,27 (2) :201-209. DOI:10.1097/ACO.0000000000000045.
[3]SASAKI N,MEYER MJ,EIKERMANN M. Postoperative respiratory muscle dysfunction:pathophysiology and preventive strategies [J]. Anesthesiology,2013,118 (4) :961-978. DOI:10.1097/ALN.0b013e318288823b.
[4]SHANDER A,FLEISHER LA,BARIE PS,et al. Clinical and economic burden of postoperative pulmonary complications:patient safety summit on definition,risk-reducing interventions,and preventive strategies [J]. Crit Care Med,2011,39 (9) :2163-2172. DOI:10.1097/CCM.0b013e31821f0522.
[5]LIEU CH,RENFRO LA,DE GRAMONT A,et al. Association of age with survival in patients with metastatic colorectal cancer:analysis from the ARCAD Clinical Trials Program [J]. J Clin Oncol,2014,32(27) :2975-2984. DOI:10.1200/JCO.2013.54.9329.
[6]KRONENBERG RS,DRAGE CW. Attenuation of the ventilatory and heart rate responses to hypoxia and hypercapnia with aging in normal men [J]. J Clin Invest,1973,52 (8) :1812-1819. DOI:10.1172/JCI107363.
[7]NEUGARTEN BL. Age groups in American society and the rise of the young old [J]. Ann Am Acad Pol Soc Sci,1974,415 (1) :187-198.DOI:10.1177/000271627441500114.
[8]MCLEAN DJ,DIAZ-GIL D,FARHAN HN,et al. Dose-dependent association between intermediate-acting neuromuscular-blocking agents and postoperative respiratory complications [J]. Anesthesiology,2015,122 (6) :1201-1213. DOI:10.1097/ALN.0000000000000674.
[9]WELLER WE,ROSATI C. Comparing outcomes of laparoscopic versus open bariatric surgery [J]. Ann Surg,2008,248 (1) :10-15. DOI:10.1097/SLA.0b013e31816d953a.
[10]张慧,黄焜,宗志勇,等. 气管插管全身麻醉术后患者肺部感染现状[J]. 华西医学,2012, (12) :1910-1913. DOI:51.1356.R.20121214.1733.018.
[11]FUJITA T,SAKURAI K. Multivariate analysis of risk factors for postoperative pneumonia [J]. Am J Surg,1995,169 (3) :304-307.DOI:10.1016/S0002-9610 (99) 80163-9.
[12]AGOSTINI PL,CIESLIK H,RATHINAM S,et al. Postoperative pulmonary complications following thoracic surgery:are there any modifiable risk factors [J]. Thorax,2010,65 (9) :815-818. DOI:10.1136/thx.2009.123083.
[13]SEKINE Y,BEHNIA M,FUJISAWA T. Impact of COPD on pulmonary complications and on long-term survival of patients undergoing surgery for NSCLC [J]. Lung Cancer,2002,37 (1) :95-101. DOI:10.1016/S0169-5002 (02) 00014-4.
[14]MANS CM,REEVE JC,ELKINS MR. Postoperative outcomes following preoperative inspiratory muscle training in patient undergoing cardiothoracic or upper abdominal surgery:a systematic review and meta analysis [J]. Clin Rehabil,2015,29 (5) :426-438. DOI:10.1177/0269215514545350.
[15]FUTIER EL,CONSTANTIN JM,PAUGAM-BURTZ C,et al. A trial of intraoperative low-tidal-volume ventilation in abdominal surgery[J]. N Engl J Med,2013,369 (5) :428-437. DOI:10.1056/NEJMoa1301082.
[16]SERPA NETO A,HENNES S,BARBAS C,et al. Protective vs conventional ventilation for surgery. A systematic review and individual patient data meta-analysis [J]. Anesthesiology,2015,123 (1) :66-78.DOI:10.1097/ALN.0000000000000706.

