肺保护性通气策略在新生儿胸腔镜手术中对脑氧饱和度的影响
万玉骁,朱俊超
(中国医科大学附属盛京医院麻醉科,沈阳 110004)
先天性食道闭锁及食管气管瘘 (esophageal atresia/tracheoesophageal fistula,EA/TEF) 和先天性膈疝 (congenital diaphragmatic hernia,CDH) 的治疗技术目前已经愈发成熟[1-3]。新生儿胸腔镜术中常发生高碳酸血症和酸中毒,特别是EA/TEF及CDH的患儿,多伴肺发育不良和肺内感染,生理影响更加显著[4-8]。目前术中单肺通气 (one-lung ventilation,OLV) 的建立多通过人工气胸压力及腔镜器械推压术侧肺来达到。多以术中增加通气量的方式改善高碳酸血症和低氧血症,但不利于患侧肺萎陷、且增加了肺损伤发生,而肺保护性通气策略 (pulmonary protective ventilation strategy,PPVS) 可以显著降低其发生率。PPVS包括小潮气量、恰当的呼气末正压通气 (positive end expiratory pressure,PEEP) 和定时肺复张,但目前允许性高碳酸血症 (permissive hypercapnia,PHC) 在新生儿的定义、动脉血二氧化碳分压(partial pressure of carbon dioxide,PaCO2) 的合理范围及PHC对脏器功能影响的报道甚少。FISHMAN等[5]研究显示,胸腔镜与开胸术式的高碳酸血症和酸中毒发生率没有统计学差异;也有报道[9]指出 ,传统通气 (conventional ventilation,CV) 模式治疗CDH能显著增加高碳酸血症和酸中毒的发生。本研究拟通过观察腔镜下EA/TEF和CDH术中脑氧饱和度(cerebral oxygen saturation,cSO2) 变化,探明PPVS通气模式是否会对cSO2产生影响。
1 材料与方法
1.1 研究对象
选取2015年6月至2017年1月于我院择期行胸腔镜下EA/TEF和CDH的新生儿20例,其中EA/TEF患儿12例,CDH患儿8例。患儿ASA分级为Ⅱ~Ⅲ级,其中男13例,女7例,日龄为11~24 d,体质量2.2~4.1 kg。入组患者均排除以下因素: (1) 合并气胸; (2) 合并严重代谢性疾病、免疫系统疾病; (3) 存在严重心脏畸形及肝、肾功能异常; (4) 术中转开胸 (腹) 及术后死亡病例。将20例新生儿随机分为保护性通气PPV组 (P组) 和传统通气组 (C组) 。各组受试者一般资料比较差异无统计学意义 (P> 0.05) 。
1.2 麻醉前准备
患儿置于暖箱内转运,入室后常规监测心电图(lectrocardiograph,ECG)、血压(blood press,BP) 、血氧饱和度 (satruation of pulse oxygen,SpO2) ,开放静脉通路,用注射器通过鼻胃管和吸痰管吸引食管盲端和口咽部的分泌物并进行胃肠减压。此类患儿特别是EA/TEF,因术前禁食时间较长,术中注意预防低血糖的发生。
1.3 麻醉方法
预充呼吸回路完成后,即以6%七氟烷吸入行麻醉诱导 (FiO2100%,氧流量 4~5 L/min) ,避免过高浓度七氟烷引起呼吸抑制,保留自主呼吸情况下行气管内插管。连接麻醉机行呼气末CO2(partial pressure of carbon dioxide in endexpiratory gas,PETCO2) 监测及控制呼吸。麻醉维持以持续吸入七氟烷保持最低肺泡气有效浓度 (minimum alveolar concentraiton,MAC) 在0.8~1.0,同时静脉持续泵注瑞芬太尼0.5~1.0 μ g/(kg·min) 。建立有创动脉血压 (invasive blood pressure,IBP) 监测,术中监测尿量及体温。手术开始人工气胸 (压力为6 mmHg) 建立后,P组起始潮气量6 mL/kg,吸/呼比(I∶R)为1∶1.5~1∶2,呼吸频率 (respiratory rate,RR) 为30~40次/min,PEEP 4~6 cm H2O,辅以PPVS (维持PETCO2<80 mmHg) 的通气策略。C组潮气量初始以10 mL/kg,其他呼吸参数同P组,调 整RR、PEEP,维 持PETCO2在35~45 mmHg。术中根据生命体征及手术情况调整麻醉深度。术中间断给予顺苯磺酸阿曲库铵,以患儿无自主呼吸、人工气胸侧肺萎陷术野清晰和术者对肌松效果满意为目标。补液 (乳酸林格氏液) 速度和补液量以维持心率 (heart rate,HR) 120~160 次/min、动脉平均压(mean aterial pressure,MAP) 60~70 mmHg 以及平均尿量约0.5~1 mL/ (kg·h) 为目标。
1.4 监测指标及观察时点
分别于插管机械通气后 (T0) 、气胸后30 min(T1) 、气胸后60 min (T2) 、气胸后90 min (T3) 、气胸解除后30 min (T4) 5个时点进行动脉采血分析,以近红外光谱仪测量各时点cSO2。同时记录各时点HR、MAP、SpO2、RR 、PETCO2、PEEP及气道峰压 (P) 。
1.5 统计学分析
所有数据均用SPSS 19.0软件进行分析,计量资料以±s表示,各时点 (T0~T4) 采用重复测量数据的方差分析;组间比较采用独立样本t检验,计数资料比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 2组受试者一般情况比较
2组患儿共20 例均顺利完成手术,术毕带气管导管回新生儿重症监护室。在诊断、性别、年龄、体质量、人工气胸时间和手术时长均无统计学差异 (P>0.05) ,见表1。
2.2 2组患儿各时点HR、MAP、SpO2、PETCO2值的变化
20例患儿T0~T4各时点 HR、MAP和SpO2差异均无统计学意义。P组患儿T1~T3时PETCO2显著高于C组 (P< 0.05) ,T4时2组PETCO2无统计学差异。见表2。
表1 2组患儿一般情况 (n = 10,±s)Tab.1 Baseline characteristics of selected neonates of group P and group C (n = 10,±s)
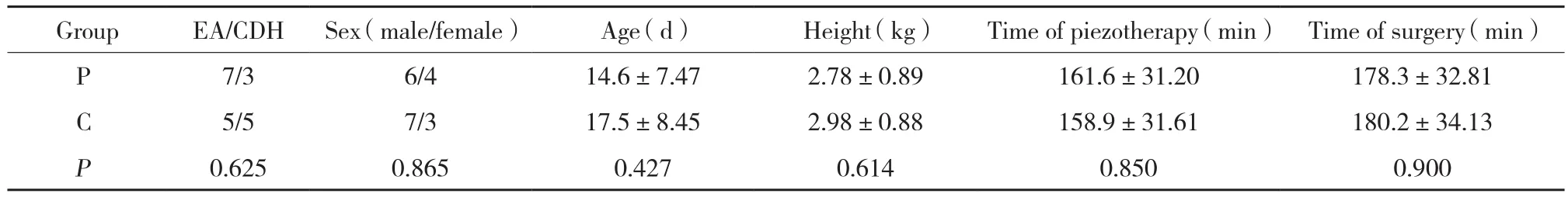
表1 2组患儿一般情况 (n = 10,±s)Tab.1 Baseline characteristics of selected neonates of group P and group C (n = 10,±s)
GroupEA/CDHSex (male/female)Age (d)Height (kg)Time of piezotherapy (min)Time of surgery (min)P 7/3 6/4 14.6±7.47 2.78±0.89 161.6±31.20 178.3±32.81 C 5/5 7/3 17.5±8.45 2.98±0.88 158.9±31.61 180.2±34.13 P 0.625 0.865 0.427 0.614 0.850 0.900
2.3 2组患儿各时点呼吸参数的比较
P组患儿T1~T4时PEEP、RR显著高于C组 (P<0.05) ,PIP在T1、T2和T4显著低于C组 (P< 0.05) ,在T3时2组PIP无统计学差异。见表3。
表2 2组患儿各时点HR、MAP、SpO2、PETCO2值的变化 (±s)Tab.2 Comparison of changes in HR,MAP,SpO2,and PETCO2 values between group P and group C (±s)
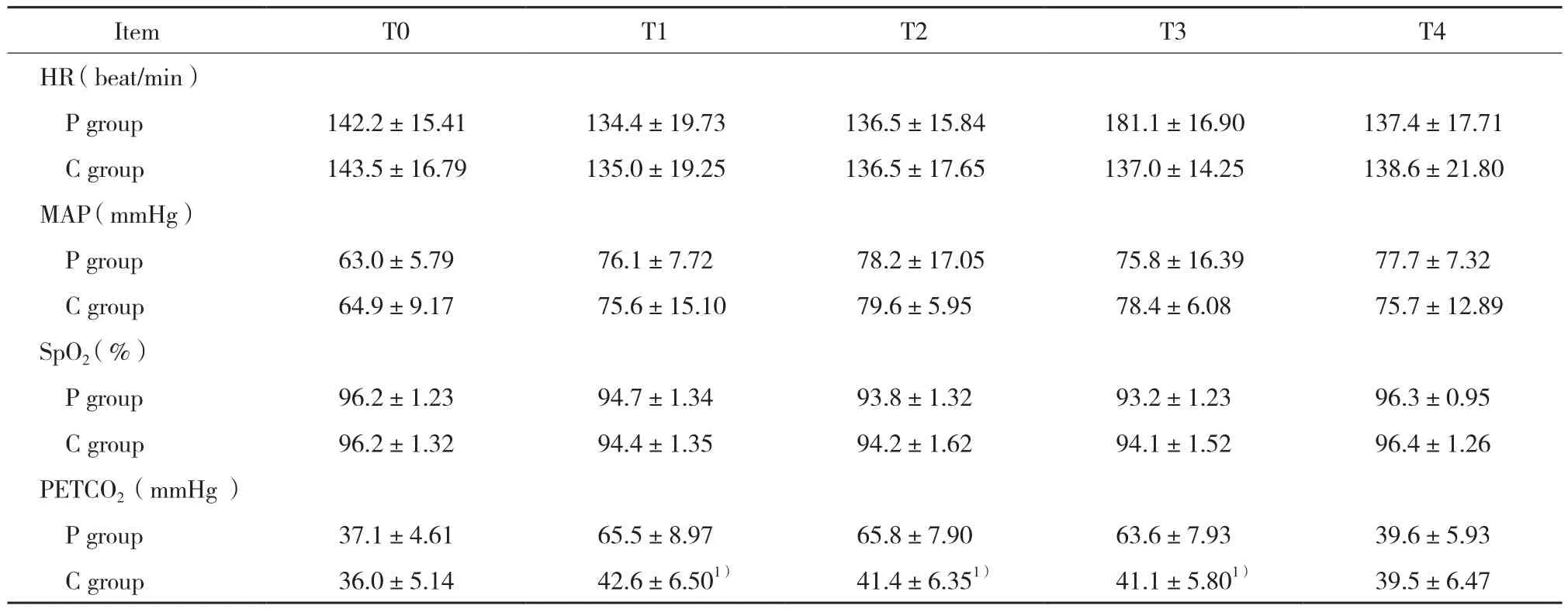
表2 2组患儿各时点HR、MAP、SpO2、PETCO2值的变化 (±s)Tab.2 Comparison of changes in HR,MAP,SpO2,and PETCO2 values between group P and group C (±s)
Compared with P group at the same time point,1) P < 0.05.
Item T0 T1 T2 T3 T4 HR (beat/min)P group 142.2±15.41 134.4±19.73 136.5±15.84 181.1±16.90 137.4±17.71 C group 143.5±16.79 135.0±19.25 136.5±17.65 137.0±14.25 138.6±21.80 MAP (mmHg)P group 63.0±5.79 76.1±7.72 78.2±17.05 75.8±16.39 77.7±7.32 C group 64.9±9.17 75.6±15.10 79.6±5.95 78.4±6.08 75.7±12.89 SpO2(%)P group 96.2±1.23 94.7±1.34 93.8±1.32 93.2±1.23 96.3±0.95 C group 96.2±1.32 94.4±1.35 94.2±1.62 94.1±1.52 96.4±1.26 PETCO2 (mmHg )P group 37.1±4.61 65.5±8.97 65.8±7.90 63.6±7.93 39.6±5.93 C group 36.0±5.14 42.6±6.501) 41.4±6.351) 41.1±5.801) 39.5±6.47
表3 2组患儿各时点呼吸参数的比较 (±s)Tab.3 Comparison of the change in respiratory parameters between group P and group C (±s)
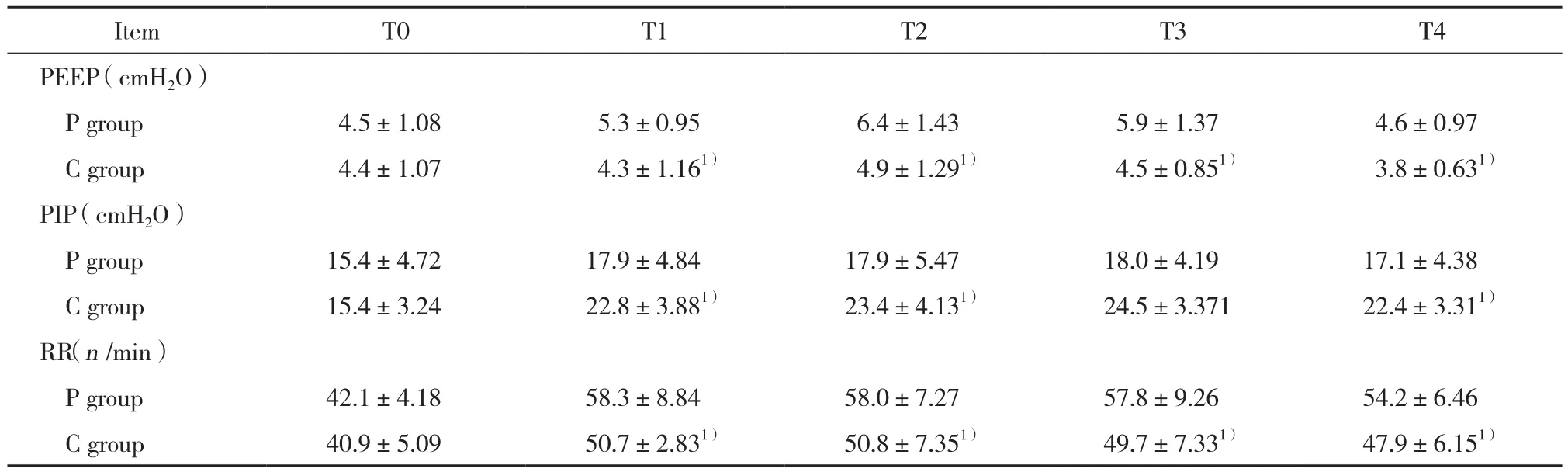
表3 2组患儿各时点呼吸参数的比较 (±s)Tab.3 Comparison of the change in respiratory parameters between group P and group C (±s)
Compared with P group at the same time point,1) P < 0.05.
Item T0 T1 T2 T3 T4 PEEP (cmH2O)P group 4.5±1.08 5.3±0.95 6.4±1.43 5.9±1.37 4.6±0.97 C group 4.4±1.07 4.3±1.161) 4.9±1.291) 4.5±0.851) 3.8±0.631)PIP (cmH2O)P group 15.4±4.72 17.9±4.84 17.9±5.47 18.0±4.19 17.1±4.38 C group 15.4±3.24 22.8±3.881) 23.4±4.131) 24.5±3.371 22.4±3.311)RR(n /min)P group 42.1±4.18 58.3±8.84 58.0±7.27 57.8±9.26 54.2±6.46 C group 40.9±5.09 50.7±2.831) 50.8±7.351) 49.7±7.331) 47.9±6.151)
2.4 2组患儿各时点动脉血气与cSO2的比较
P组患儿T1~T3时动脉血pH、cSO2显著低于C组,而PaCO2显著高于C组 (P< 0.05) ,2组PaO2在各时点差异均无统计学意义,见表4。
表4 2组患儿各时点动脉血气与 cSO2的比较 (±s)Tab.4 Comparison of arterial blood gas and cSO2 values between group P and group C (±s)
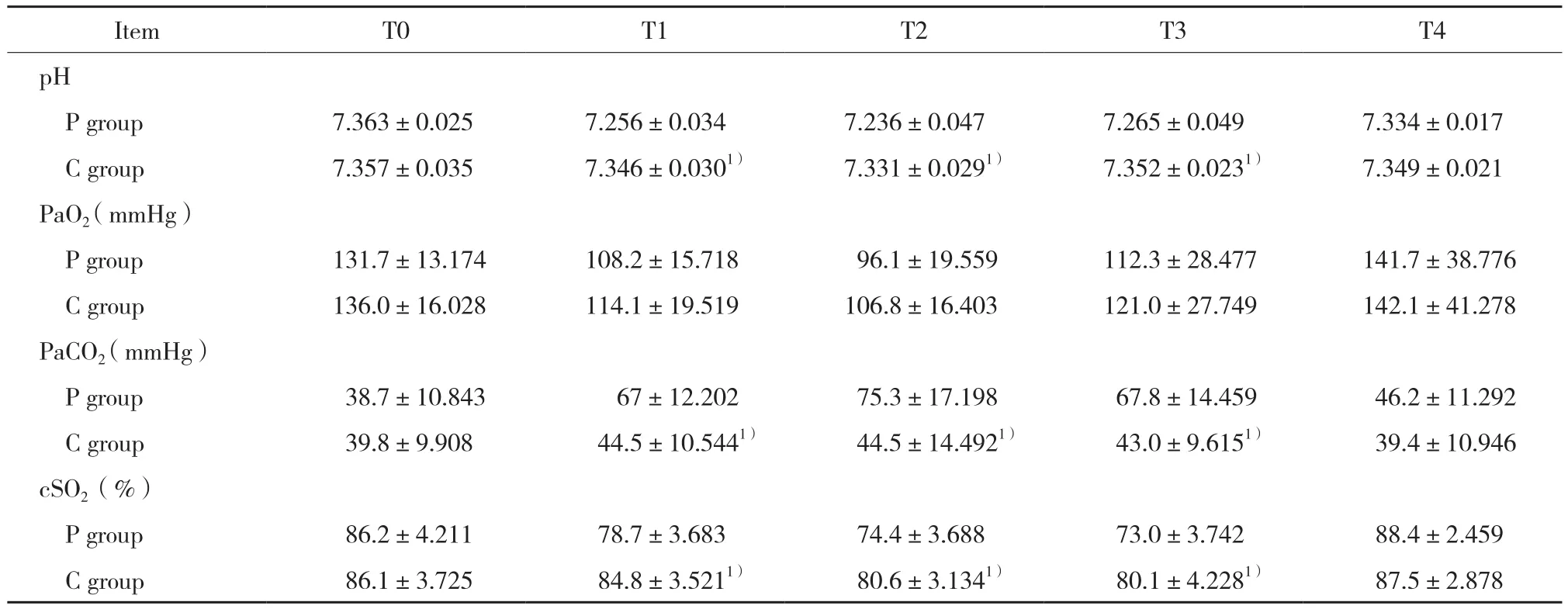
表4 2组患儿各时点动脉血气与 cSO2的比较 (±s)Tab.4 Comparison of arterial blood gas and cSO2 values between group P and group C (±s)
Compared with P group at the same time point,1) P < 0.05.
Item T0 T1 T2 T3 T4 pH P group 7.363±0.025 7.256±0.034 7.236±0.047 7.265±0.049 7.334±0.017 C group 7.357±0.035 7.346±0.0301) 7.331±0.0291) 7.352±0.0231) 7.349±0.021 PaO2 (mmHg)P group 131.7±13.174 108.2±15.718 96.1±19.559 112.3±28.477 141.7±38.776 C group 136.0±16.028 114.1±19.519 106.8±16.403 121.0±27.749 142.1±41.278 PaCO2(mmHg)P group 38.7±10.843 67±12.202 75.3±17.198 67.8±14.459 46.2±11.292 C group 39.8±9.908 44.5±10.5441) 44.5±14.4921) 43.0±9.6151) 39.4±10.946 cSO2 (%)P group 86.2±4.211 78.7±3.683 74.4±3.688 73.0±3.742 88.4±2.459 C group 86.1±3.725 84.8±3.5211) 80.6±3.1341) 80.1±4.2281) 87.5±2.878
3 讨论
继微创手术技术在成人取得成功后,也逐渐在婴幼儿手术中获得开展,目前在新生儿和婴儿中大约70%的EA/TEF或CDH是在胸腔镜下修补。由于胸腔镜下人工气胸和手术操作对患侧肺的机械压迫,使得CV肺内会出现严重的不均匀通气,引起部分肺泡过度充气,产生高潮气量和肺过度牵张引起的肺损伤,增加气压伤和气胸的发生率[10]。胡华琨等[11]的研究表明,在胸腔镜CDH术中应用肺保护性通气(pulmonary protective ventilation,PPV)技术可以降低术中气胸发生率,GUIDRY等[12]研究发现PPV应用于CDH的机械通气治疗可降低死亡率,减少体外膜肺氧合的使用率,且不延长住院时间。但是PPVS中的PHC,在添加胸腔镜这样一个额外的风险因素后,严重酸中毒和高碳酸血症的发生概率大大增加。研究[13-14]指出,胸腔镜手术中新生儿的cSO2有可能会降低,一方面因为在新生儿脑血流自动调节功能不成熟,另一方面与胸内二氧化碳压增高和人工气胸长时间的CO2吸收相关。
近红外光谱技术 (near infrared reflectance spectroscopy,NIRS) 被广泛应用于小儿心脏和成人大血管手术,有证据显示其比其他cSO2监测技术更敏感,并且对于存在潜在的术中cSO2失衡患者,是更准确灵敏的术后神经功能损伤预测指标[15-16]。胸科手术OLV期间绝大多数患者cSO2下降幅度在15%~20%以上,并且常规监测并不能发现cSO2的降低。研究[17]表明,cSO2下降至65%以下术后发生非呼吸器官衰竭的可能性是未降到阈值下患者的2.37倍,发生并发症的概率是其3.19倍。cSO2的降低与术后认知功能障碍密切相关,它可能长期存在并损害记忆力及精细运动功能[18]。因此,cSO2监测在胸腔镜手术期间很有必要。
为避免胸腔镜下EA/CDH的修补术中发生高碳酸血症和酸中毒,有学者提出使用高频振荡通气(high frequency ventilation,HFV) 替代通气策略以减少高碳酸血症,然而这种方式本身可能会增加手术难度和持续时间[19]。因此目前为止,何种通气方式为新生儿胸腔镜手术中的最佳方法仍是未知[20]。
本研究中通过对胸腔镜下EA/CDH施用PPVS,证实了PPVS在新生儿胸腔镜手术中可以降低cSO2。有研究[13]认为胸腔镜手术下胸内PaCO2增高,可降低局部cSO2,并且高碳酸血症和酸中毒会加重此情况[14]。虽然在术毕气胸解除后,患儿cSO2的显著降低随之消失,但鉴于新生儿处于大脑发育早期,对于患儿远期神经发育的影响结果是未知的,需要长期随访以确定。由于本研究的样本量有限,未来需要更大规模的研究来评估不同通气方式在新生儿胸腔镜手术中的效果,而不仅限于EA/CDH。
[1]LOBE TE,ROTHENBERG S,WALDSCHMIDT J,et al. Thoracoscopic repair of esophageal atresia in an infant:a surgical first [J].Pediatr Endosurg Inno Tech,2000,3 (3) :141-148. DOI:10.1089/pei.1999.3.141.
[2]PONSKY TA,ROTHENBERG SS. Minimally invasive surgery in infants less than 5 kg:experience of 649 cases [J]. Surg Endosc,2008,22 (10) :2214-2219. DOI:10.1007/s00464-008-0025-7.
[3]Ure BM,SCHMIDT AI,JESCH NK. Thoracoscopic surgery in infants and children [J]. Eur J Pediatr Surg,2005,15 (5) :314-318. DOI:10.1055/s-2005-865793 .
[4]BLISS D,MATAR M,KRISHNASWAMI S. Should intraoperative hypercapnea or hypercarbia raise concern in neonates undergoing thoracoscopic repair of diaphragmatic hernia of bochdalek? [J]. J Laparoendosc Adv Surg Tech A,2009,19 (4) :55-58. DOI:10.1089/lap.2008.0141.
[5]FISHMAN JR,BLACKBUM SC,JONES NJ,et al. Does thoracoscopic congenital diaphragmatic hernia repair cause a significant intraoperative acidosis when compared to an open abdominal approach?[J]. J Pediatr Surg,2011,46 (3) :458-461. DOI:10.1016/j.jpedsurg.2010.08.062
[6]GOURLAY DM,CCASSIDY LD,SATO TT,et al. Beyond feasibility:a comparison of newborns undergoing thoracoscopic and open repair of congenital diaphragmatic hernias [J]. J Pediatr Surg,2009,44 (9) :1702-1707. DOI:10.1016/j.jpedsurg.2008.11.030.
[7]KROSNAR S,BAXTER A. Thoracoscopic repair of esophageal atresiawith tracheoesophageal fistula:anesthetic and intensive care management of a series of eight neonates [J]. Paediatr Anaesth,2005,15(7) :541-546. DOI:10.1111/j.1460-9592.2005.01594.x.
[8]MCHONEY M,GIACOMELLO L,NAH SA,et al. Thoracoscopic repair of congenital diaphragmatic hernia:intraoperative ventilation and recurrence [J]. J Pediatr Surg,2010,45 (2) :355-359. DOI:10.1016/j.jpedsurg.2009.10.072.
[9]BISHAY M,GIACOMELLO L,RETROSI G,et al. Hypercapnia and acidosis during open and thoracoscopic repair of congenital diaphragmatic hernia and esophageal atresia:results of a pilot randomized controlled trial [J]. Ann Surg,2013,258 (6) :895-900. DOI:10.1097/SLA.0b013e31828fab55.
[10]HIGGINS BD,CMSTELLO JF,CHONGHAILE MN,et al. Permissive hypercapnia in protective lung ventilatory strategies [J].Paediatr Child Health,2007,17 (3) :94-103. DOI:10.1016/j.paed.2007.01.014.
[11]胡华琨,李强,彭夕华. 允许性高碳酸血症在新生儿胸腔镜先天性膈疝修补术中的应用[J]. 临床麻醉学杂志,2014,30 (8) :766-769.
[12]GUIDRY CA,HRANJEC T,RODGERS BM,et al. Permissive hypercapnia in the management of congenital diaphragmatic hernia:our institutional experience [J]. J Am Coll Surg,2012,214 (4) :640-645. DOI:10.1016/j.jamcollsurg.2011.12.036.
[13]NEUNHOEFFER F,WARMANN SW,HOFBECK M,et al. Elevated intrathoracic CO2pressure during thoracoscopic surgery decreases regional cerebral oxygen saturation in neonates and infants-A pilot study [J]. Paediatr Anaesth,2017,27 (7) :752-759. DOI:10.1111/pan.13161.
[14]BISHAY M,GIACOMELLO L. Decreased cerebral oxygen saturation during thoracoscopic repair of congenital diaphragmatic hernia and esophageal atresia in infants [J]. J Pediatr Surg,2011,46 (1):47-51.DOI:10.1016/j.jpedsurg.2010.09.062.
[15]III EHA,JR HLE,AUDEN SM,et al. Benefit of neurophysiologic monitoring for pediatric cardiac surgery [J]. J Thorac Cardiovasc Surg,1997,114 (5) :707-717. DOI:10.1016/S0022-5223 (97)70074-6.
[16]ORIHASHI K,SUEDA T,OKADA K,et al. Near-infrared spectroscopy for monitoring cerebral ischemia during selective cerebral perfusion [J]. Eur J Cardiothorac Surg,2004,26 (5) :907-911. DOI:10.1016/j.ejcts.2004.06.014.
[17]HEMMERLING TM,BLUTEAU MC,KAZAN R,et al. Significant decrease of cerebral oxygen saturation during single-lung ventilation measured using absolute oximetry [J]. Br J Anaesth,2008,101 (6) :870-875. DOI:10.1093/bja/aen275.
[18]NEWMAN MF,GROCOTT HP,MATHEW JP,et al. Report of the substudy assessing the impact of neurocognitive function on quality of life 5 years after cardiac surgery [J]. Stroke,2001,32 (12) :2874-2881. DOI:https://doi.org/10.1161/hs1201.099803.
[19]MORTELLARO VE,FIKE FB,ADIBE OO,et al. The use of high-frequency oscillating ventilation to facilitate stability during neonatal thoracoscopic operations [J]. J Laparoendosc Adv Surg Tech A,2011,21 (9) :877-879. DOI:10.1089/lap.2011.0134.
[20]TADAHARU O,MANABU O,JUNYA I,et al. Intraoperative ventilation during thoracoscopic repair of neonatal congenital diaphragmatic hernia [J]. Pediatr Surg Int,2017,33 (10) :1097-1101. DOI:10.1007/s00383-017-4143-y.

