Von Hippel-Lindau综合征肾脏病变10例诊治分析
董毅 琚官群△ 吴震杰 刘涛 陈杰 何屹 刘冰 王林辉
1海军军医大学附属上海长征医院泌尿外科 200003 上海 2浙江省嘉兴市第一医院泌尿外科 △ 共同第一作者
[摘要]目的:探讨Von Hippel-Lindau综合征(VHL综合征)肾脏病变的临床、影像学、病理特点及处理方法,提高对VHL综合征肾脏病变的认识与处理水平。方法:回顾性分析上海长征医院2014年1月~2017年12月诊治的10例VHL综合征患者肾脏病变的临床特点及治疗方式,复习文献并讨论VHL综合征肾脏病变的评估与处理。结果:8例患多发肾透明细胞癌,6例患多发肾囊肿,8例有视网膜多发血管瘤和(或)中枢神经系统血管瘤,2例有中枢神经系统血管母细胞瘤家病史,据此均符合该疾病临床诊断标准。其中2例行腹腔镜根治性肾切除术,2例行肾部分切除术,1例因合并胰腺多发囊肿导致门脉高压而行“脾切除+肾肿瘤活检术”,1例患者因肿瘤较小而予密切随访。结论:VHL综合征肾脏病变表现为肾透明细胞癌与肾囊肿,可采取积极监测、手术治疗与靶向治疗,目前缺乏处理指南,可在多学科综合治疗协作组的模式下进行个体化治疗,根据患者全身情况,共同制定治疗计划。
[关键词] Von Hippel-Lindau综合征;肾脏病变;肾癌;肾囊肿
[中图分类号] R737.11 [文献标识码] A
[DOI] 10.19558/j.cnki.10-1020/r.2018.03.014
Corresponding author: Wang Linhui, wanglinhui@smmu.edu.com
AbstractObjective: To investigate the clinical features, diagnosis and management of renal lesions in patients with von Hippel-Lindau (VHL) syndrome and improve the current understanding on renal lesions.Methods: The clinical data of ten VHL syndrome patients with renal lesions were analyzed retrospectively, including clinical features, laboratory findings, imaging, pathological features, operation method and follow-up.Results: Eight patients with multiple clear cell renal cell carcinoma, six patients had renal cystic lesions, eight patient had retinal multiple angioma or angioma in central neural system (CNS), and two had family history of hemangioblastoma in CNS. All the ten patients had stable disease status, and followed up by outpatient visits.Conclusions: VHL syndrome can manifest as renal cell carcinoma and renal cystic lesions. Treatment contain active surveillance, surgical intervention and medical treatment. Nowadays there is no guideline specifically focused on VHL disease renal lesions. The optimal individualized treatment should under Multidisciplinary team (MDT), according to the general condition of patient, in order to improve prognosis.
Keywordsvon Hippel-Lindau syndrome; renal lesion; renal cell carcinoma; renal cyst
基金项目:国家自然科学基金重点项目(281730073)
Von Hippel-Lindau综合征(VHL综合征),又称希佩尔-林道综合征,是具有癌变倾向的常染色体显性遗传病,发病率约为1/36 000~1/45 500[1],临床表现包括中枢神经系统血管母细胞瘤(hemangioblastoma, HB)、视网膜血管瘤、肾细胞癌(renal cell carcinoma, RCC)、肾囊肿、嗜铬细胞瘤(pheochromocytoma, PCC)、胰腺肿瘤或囊肿等疾病[2]。
VHL综合征患者中50%~70%会出现肾囊肿, 24%~45%合并RCC[3],双侧累及的多发性病变为其典型病变。2014年1月~2017年12月上海长征医院泌尿外科共诊治10例合并肾脏病变的VHL综合征患者,并在多学科综合治疗协作组(Multidisciplinary team, MDT)的模式下对患者进行全身系统性评估与个体化的诊治,现对病例特点与治疗方式进行回顾性分析,旨在提高对VHL综合征这一罕见疾病的认识,为肾脏病变的临床诊治提供借鉴。
1 资料与方法
1.1 入组标准及观察指标
入组标准:采用Maher提出的标准临床诊断VHL综合征的患者[4],即:①多发性视网膜血管母细胞瘤或小脑血管母细胞瘤;②单发的视网膜或小脑血管母细胞瘤,但有明确的家族史;③若无血管母细胞瘤家族史,但伴有肾上腺嗜铬细胞瘤或肾脏、胰腺、附睾囊肿(或肿瘤)者。不合并其他恶性肿瘤。病历资料完整。
观察指标:患者就诊年龄、性别、首发临床症状、肾脏病灶数目、位置、其他脏器表现、病理及治疗方法等。
1.2 临床资料
收集2014年1月~2017年12月就诊的10例临床诊断VHL综合征的患者的临床资料(表1),其中男1例,女9例,就诊时年龄17~55岁。7例患者因腹部症状就诊,1例患者因腰椎转移症状导致骨相关事件(skeletal related event, SRE)就诊(图1),2例为体检发现。
1.3 影像学检查
根据影像学进行评估肾脏肿瘤与囊性病灶的数目和部位,包括CT(图2)、MRI(图1),同时评估胰腺、肾上腺等脏器,并行头颅MRI、全脊髓MRI或血管造影(图3)评估患者是否存在中枢神经系统血管母细胞瘤等其他病变。

表1 患者一般情况及肾脏病变情况

图1增强MRI示腰1椎体肿瘤性病变(*),双肾多发囊肿
2 治疗方法与结果
VHL综合征呈现多系统累及,病例均MDT模式下进行系统性评估与个体化治疗(表2)。对2例单纯多发肾囊肿患者的肾脏病变进行积极监测,针对RCC患者的手术方式尽量行保留肾单位手术(Nephron sparing surgery, NSS),通常采用肾部分切除术(partial nephrectomy, PN),手术过程中可一并处理肾脏其他病变,如行肾囊肿去顶减压术等,2例因单侧多发肾肿瘤,评估行NSS困难,而采用单侧肾脏根治性切除术(radical nephrectomy, RN),1例因合并胰源性门脉高压伴上消化道出血(图2),在普外科行“脾切除+左肾肿瘤活检术”,所有切除的肾肿瘤经病理诊断均为肾透明细胞癌(clear cell RCC, ccRCC), Fuhrman分级Ⅰ或Ⅱ级。
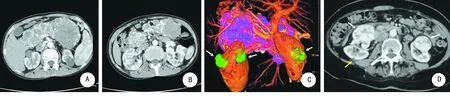
A:增强CT示双肾多发囊性病变;B:增强CT示多发肾肿瘤,胰腺多发囊肿伴钙化;C:CT三维重建示肾脏多发肿瘤(白色箭头),肾脏多发囊肿;D:增强CT示双肾多发肿瘤(白色箭头),多发囊肿(黄色箭头)。

图2 影像学资料

图3 颅脑血管造影可见小脑占位(白色箭头)
患者均纳入上海长征医院泌尿外科随访系统进行规范化随访,目前10例患者中9例生存,均在进行密切随访,1例VHL综合征合并RCC骨转移患者于腰椎转移瘤切除术后第15个月死亡。
3 讨论
VHL综合征表现为多器官累及的肿瘤征候群,多数是以血管过度增生为特征的良性肿瘤,但RCC与胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNETs)表现为具有转移潜能的恶性肿瘤。VHL综合征发病呈现年龄依赖性,高峰年龄为25~40岁,65岁时疾病外显率达90%以上,未经治疗的患者自然死亡年龄<50岁[1,5],目前中国患者的平均死亡年龄为62岁[6],主要死因是中枢神经系统HB破裂出血、RCC和PCC引起的恶性高血压。
VHL综合征的分子基础是位于3染色体短臂(3p25~26)的VHL基因突变导致VHL蛋白(protein VHL, pVHL)合成障碍[7],其不同的突变形式和部位会导致不同的疾病表型,其中VHL1型不合并PCC,VHL1b型是VHL基因大片段突变导致的特殊类型,无RCC及PCC。 VHL2型分成3个亚型,VHL2a型除发生PCC外还伴发CNS血管母细胞瘤,但不伴RCC;VHL2b型与2a型相比还可伴发RCC;而VHL2c型仅存在PCC而不合并其他疾病(表3)。
目前VHL综合征主要依据临床诊断,由于并非所有患者均有明确家族史和特征性的临床表现,以及存在无血管瘤型等特殊VHL综合征亚类型[8],对疑似患者及高危人群应进行基因检测或有助于早期诊断,高危人群包括[9]:①VHL综合征家族中所有成员;②有家族史的HB、ccRCC、PC患者;③双侧、多发性或较年轻的HB、RCC、PCC患者,但目前VHL基因检测价格较为昂贵,尚未在临床中大规模开展,基因检测也可能出现误差,本组1例患者行高通量基因测序,并未检测到可以解释遗传肿瘤的致病突变。

表3 VHL综合征分型
HB:血管母细胞瘤;RCC:肾细胞癌;PCC:嗜铬细胞瘤。
VHL综合征肾囊肿恶变风险很低,典型表现为双肾多发囊肿[10],与常染色体显性遗传的多囊肾不同,肾囊肿即使双侧弥漫分布也极少出现肾功能不全。不合并RCC的肾囊肿均不建议手术干预,手术是针对合并疼痛或压迫症状的囊肿唯一的治疗手段,本组2例无症状性单纯肾囊肿患者均未进行手术干预。
VHL综合征RCC是最常见的遗传性肾癌(Hereditary, RCC),常起病于青年,典型表现为双肾多发性ccRCC[7], 肿瘤增长速度(0.26~0.30 cm/y)较散发RCC缓慢(1.6 cm/y),但转移发生率随体积增大而升高,肿瘤直径<3 cm时极少发生转移,可采取观察等待的方法,每6个月复查腹部平扫+增强CT、血肌酐等[11];当肿瘤直径≥3 cm时因转移风险较高,因此需积极手术治疗,基本原则是尽可能保留正常肾脏组织[12],NSS术后10年生存率可达81%[3],对于局部复发的肾脏肿瘤,可继续采取NSS术。双侧多发RCC患者,可采取同期或分期手术方式,同期NSS难度较大且会增加短期肾功能下降的风险,双侧分期行NSS术后短期肾功能保护效果较好[13],射频消融、冷冻消融等能量切除疗法可用于无法耐受PN的患者[14, 15]。RCC曾是该病最常见的死亡原因,随着严密随访与积极的外科处理,RCC相关死亡已经逐渐下降[6]。
VHL综合征RCC中92%~97%病理结果提示低度恶性[16, 17],但表现出高局部复发率及低远处转移的生物学特性,本组所切除RCC的病理均为Fuhrman分级Ⅰ或Ⅱ级。虽然双侧根治性肾切除能实现消除RCC复发及转移的风险,但术后需行肾脏移植或透析等替代治疗,显著降低患者的生活质量。有症状的VHL综合征RCC患者中30%~50%会发生远处转移[18],本组1例患者因骨转移瘤导致的SRE就诊,L1椎体肿瘤切除后病理提示转移性ccRCC,结合颅内血管母细胞瘤切除术与双肾部分切除术病史,继而明确VHL综合征诊断。
VHL综合征发病机制的研究带动了肾癌靶向药物的发展,因为VHL基因不仅是家族性ccRCC的致病基因,而且90%的散发性ccRCC患者也存在VHL基因的突变或甲基化[19]。舒尼替尼、培唑帕尼等TKI类药物主要作用于VEGFR从而发挥抗肿瘤血管生成作用,目前已有舒尼替尼治疗VHL综合征转移性肾细胞癌(metastatic RCC,mRCC)获得长期存活的报道,且治疗效果优于其他VHL相关肿瘤[20, 21],但疗效尚需大规模临床实验证实。
VHL综合征肾脏病变可表现为肾囊肿与RCC,需综合考虑病变类型、临床表现与转移风险而制定个体化的治疗方案。肾囊肿一般仅需要规范化的随访与观察。VHL综合征RCC需要严密随访,>3 cm肿瘤应积极手术治疗,NSS可降低RCC转移风险并保留患肾功能,局部晚期或mRCC可进行靶向治疗,转移灶伴有相关压迫症状者,可行转移灶切除术以改善患者生活质量。由于多器官累及的特性,在MDT的模式下对患者进行全身系统性评估与个体化的诊治,或能带来更好的预后[22]。
[参考文献]
[1] Lonser RR, Glenn GM, Walther M, et al. Von Hippel-Lindau disease. Lancet, 2003,361(9374):2059-2067.
[2] Varshney N, Kebede AA, Owusu-Dapaah H, et al. A review of Von Hippel-Lindau syndrome. J Kidney Cancer VHL, 2017,4(3):20-29.
[3] Chittiboina P, Lonser RR. Von Hippel-Lindau disease. Handb Clin Neurol, 2015,132:139-156.
[4] Maher ER, Yates JR, Harries R, et al. Clinical features and natural history of von Hippel-Lindau disease. Q J Med, 1990,77(283):1151-1163.
[5] Kim JJ, Rini B, Hansel DE. Von hippel lindau syndrome. Adv Exp Med Biol, 2010,685:228-249.
[6] Wang JY, Peng SH, Li T, et al. Risk factors for survival in patients with von Hippel-Lindau disease. J Med Genet, 2018,55(5):322-328.
[7] Maher ER, Neumann HP, Richard S. von Hippel-Lindau disease: a clinical and scientific review. Eur J Hum Genet, 2011,19(6):617-623.
[8] 李金雨,韩聪祥,林吓聪,等.无血管瘤的von Hippel-Lindau病二例报告并文献复习.中华泌尿外科杂志,2015,36(9):669-671.
[9] Hes FJ, Lips CJ, van der Luijt RB. Molecular genetic aspects of Von Hippel-Lindau(VHL)disease and criteria for DNA analysis in subjects at risk. Neth J Med, 2001,59(5):235-243.
[10] 董毅,纪明哲,陈军,等.Von Hippel-Lindau病胰腺病变三例临床分析.中华胰腺病杂志,2017,17(3):189-192.
[11] Feletti A, Anglani M, Scarpa B, et al. Von Hippel-Lindau disease: an evaluation of natural history and functional disability. Neuro Oncol, 2016,18(7):1011-1020.
[12] 李世超,黄庆波,巩会杰,等.Von Hippel-Lindau综合征并发肾细胞癌的外科治疗方式(附9例报告).微创泌尿外科杂志,2015,4(2):71-74.
[13] 杨启维,王志向,许传亮,等.同时性散发性双肾癌的手术治疗策略.中华泌尿外科杂志,2016,37(2):90-94.
[14] Allasia M, Soria F, Battaglia A, et al. Radiofrequency ablation for renal cancer in Von Hippel-Lindau syndrome patients: a prospective cohort analysis. Clin Genitourin Cancer, 2018,16(1):28-34.
[15] 王林辉,徐斌,刘冰,等.单孔多通道后腹腔镜肾脏肿瘤冷冻消融术2例报告.第二军医大学学报,2012,33(7):707-711.
[16] Roupret M, Hopirtean V, Mejean A, et al. Nephron sparing surgery for renal cell carcinoma and von Hippel-Lindau's disease: a single center experience. J Urol, 2003,170(5):1752-1755.
[17] Ploussard G, Droupy S, Ferlicot S, et al. Local recurrence after nephron-sparing surgery in von Hippel-Lindau disease. Urology, 2007,70(3):435-439.
[18] Crespigio J, Berbel LCL, Dias MA, et al. Von Hippel-Lindau disease: a single gene, several hereditary tumors. J Endocrinol Invest, 2018,41(1):21-31.
[19] Moore LE, Nickerson ML, Brennan P, et al. Von Hippel-Lindau (VHL) inactivation in sporadic clear cell renal cancer: associations with germline VHL polymorphisms and etiologic risk factors. PLoS Genet, 2011,7(10):e1002312.
[20] Kobayashi A, Takahashi M, Imai H, et al. Attainment of a long-term favorable outcome by sunitinib treatment for pancreatic neuroendocrine tumor and renal cell carcinoma associated with von Hippel-Lindau disease. Intern Med, 2016,55(6):629-634.
[21] Oudard S, Elaidi R, Brizard M, et al. Sunitinib for the treatment of benign and malignant neoplasms from von Hippel-Lindau disease: A single-arm, prospective phase II clinical study from the PREDIR group. Oncotarget, 2016,7(51):85306-85317.
[22] Signorelli F, Piscopo G, Giraud S, et al. Von Hippel-Lindau disease: when neurosurgery meets nephrology, ophthalmology and genetics. J Neurosurg Sci, 2017. doi: 10.23736/S0390-5616.17.04153-4.

