睾丸转染miR-383对KM小鼠精子凋亡的影响*
董涵 侯开领 周静 袁明铭 夏介英 洪杨 张磊
(四川省中医药科学院实验动物中心,四川 成都 610041)
由于环境污染加重、人们工作和精神压力增大等因素,人类不孕不育率显著增加。研究表明每6对夫妻就有1对不育,其中由男方因素引起的约占50%[1]。大量研究表明,miRNAs在生物生长、发育、繁殖和凋亡等过程中起着重要的调控作用,miRNAs也调控着睾丸的正常发育和精子生成过程[2-3]。Lian等[4-5]发现miRNA-383在成熟停滞型男性不育(maturation arrest,MA)患者和非梗阻性无精症(non-obstructive azoospermia, NOA)患者的睾丸样品中明显下调。目前国内外对miRNA-383研究报道相对较少,已有的研究主要集中在不育症患者体内的表达情况和相关作用机制以及与肿瘤发生的关系[4-7]上。无直接在小鼠睾丸上转染miRNA-383以观察其对精子凋亡影响的,也没有研究尝试利用miRNA-383对健康动物的繁殖能力进行干预的。
本研究通过监测转染后雄鼠生活状态,以及检查部分器官病理变化和部分血液生化指标来观察其对动物机体的影响,为建立完善的活体动物体内转染技术平台,继而进一步利用miRNAs数据库建立各种动物模型奠定基础。
1 资料与方法
1.1 一般资料
1.1.1 试验动物 SPF级KM小鼠64只雌雄各半,10 周龄,由四川省中医药科学院实验动物中心提供(生产许可证号:SCXK川 2013-19,使用许可证号:SYXK 川 2013-100)。若干只10 周龄SPF级KM小鼠适应性饲养1周后,雌雄按照1:1比例随机组成家庭,选取第一胎产子数为10只左右的32个家庭,随机分成4组,分别标记为:①miRNA-383过表达组。②miRNA-383抑制组。③转染对照组。④空白对照组,每组8个家庭。
1.1.2 主要试剂 Mum-mimic-miRNA-383、inhibitormiRNA-383,由上海吉玛制药技术有限公司合成;EntransterTM- in vivo(动物体内RNA转染试剂),购自北京英格恩生物科技有限公司,批号18668-11-1;TaKaRa MiniBEST Universal RNA Extraction Kit,购自 TaKaRa,批号9767-AK901;TaqManTMMicroRNA Assays Data Sheet、TaqMan®Universal Master Mix Ⅱ、TaqMan®MicroRNA Reverse Transcription Kit,均购自Applied Biosystems;Annexin V-FITC/PI凋亡检测试剂盒,购自BD;HEPES,购自SIGMA。孵育缓冲液:10mmol/L HEPES、140mmol/L NaCl、2.5mmol/L CaCl2、pH=7.4。
1.1.3 主要仪器 生物安全柜,购自AIRTECH,型号BSS-130011A2;离心机,Thermo,LEGEND MICRO 17R;荧光定量PCR仪,Applied Biosystems,Step One;流式细胞仪,beckman,FC500;电子天平,梅特勒-托利多仪器(上海)有限公司,ML203/02;微量进样器,上海安亭微量进样器厂,MC10uL;电热恒温培养箱,上海跃进医疗,HH·BII·420-BS-Ⅱ;Venus镊。
1.2 方法
1.2.1 睾丸转染与观察记录 miRNA稀释:将含有1OD Mum-mimic-miRNA-383和inhibitormiRNA-383干粉的EP管用10μlDEPC水稀释,稀释后miRNA浓度约为3.3μg/μl。各组KM小鼠家庭在雌鼠第一胎产子前雌雄分开,最后一只雌鼠产子后5d定义为第0d,然后分别在第1、4、7d对①~④组雄鼠进行睾丸转染,每支睾丸注射转染混合物10μl,不同组别转染混合物构成(见表1)。第1d完成注射后12h再次将4组雄鼠与原配偶合笼,第10d将雄鼠取出用于采样及后续步骤。期间每天对雄鼠进行观察、称重。雌鼠继续饲养,直至第二胎出生,记录产子数后脱颈处死。

表1 不同组别转染混合物构成情况 Table 1 Composition of transfected mixture in different groups
注:表内混合物剂量是每支睾丸用量;每组转染混合物充分混合后室温静置15分钟
1.2.2 实验动物取样与内脏病理切片检测 解剖取心、肝、脾、肺、肾、肾上腺、睾丸、附睾称重,计算脏器指数。肝、肾、肾上腺和睾丸放入福尔马林溶液中固定1周,常规石蜡包埋,切片备用,HE染色,光镜观察。
1.2.3 荧光定量检测 每组随机选两只雄鼠用于荧光定量检测,每只雄鼠取1支睾丸。用TaKaRa MiniBEST Universal RNA Extraction Kit试剂盒提取总RNA,然后利用TaqManTMMicroRNA Assays Data Sheet、TaqMan®MicroRNA Reverse Transcription Kit、TaqMan®Universal Master Mix Ⅱ完成对Mum-miRNA-383和内参基因U6的反转录和荧光定量。
1.2.4 精子凋亡率检测 双侧附睾置于洁净的培养皿内,事先放入孵育缓冲液。剪刀剪破附睾管并用Venus镊挤出精子团,经四层擦镜纸过滤去除杂质,获得精子悬液。取1×106个精子细胞于试管中,1500rpm离心5分钟,小心弃去液体,加4℃ PBS洗涤3次利用Annexin V-FITC/PI双染色后,用流式细胞仪检测精子凋亡情况。
1.2.5 血液生化指标检测 雄鼠用摘眼球法取血,然后脱颈处死,血液1500rpm离心5分钟,取血清检测与肝功、肾功密切相关的ALTL(谷丙转氨酶)、ASTL(谷草转氨酶)、CREA(肌酐)、UREAL(尿素)以及UA2(尿酸)的含量。

2 结果
2.1 荧光定量结果 不论与空白对照组还是转染对照组相比(定义空白对照组Mum-miRRNA-383表达量为1),miRNA-383过表达组平均表达量极显著升高(P<0.01),miRNA-383抑制组显著降低(P<0.01),其中miRNA-383过表达组平均表达量是转染对照组的16.89倍,而转染对照组又是miRNA-383抑制组的15.75倍。而空白对照组和转染对照组之间表达量差异不显著(P>0.05)。说明各组睾丸成功转染miRNA-383,其在miRNA-383过表达组中被高表达,在miRNA-383抑制组中被抑制表达,见图1。
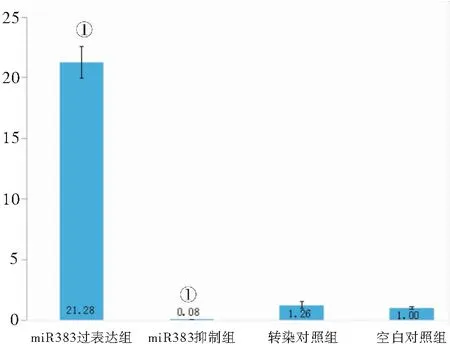
图1 各组Mum-miRNA-383相对表达量 Figure 1 Relative expression of Mum miRNA 383 in each group注:与空白对照组比较,①P<0.05
2.2 睾丸转染miRNA-383对雄性KM小鼠产子数的影响 各组在进行睾丸转染后平均产子数都与转染前有不同程度的下降,其中miRNA-383抑制组下降最多,与空白对照组比较差异有统计学意义(P<0.05);其余各组比较差异无统计学意义(P>0.05)。miRNA-383过表达组下降最少,并与转染对照组相比有增加趋势,见表2。

表2 转染前后各组产子数 Table 2 The number of output number before and after transfection
注:与空白对照组比较,①P<0.05
2.3 睾丸转染miRNA-383对雄性KM小鼠精子凋亡的影响 流式细胞仪检测精子凋亡。miRNA-383过表达组精子凋亡率平均数为(10.60±3.27)%,miRNA-383抑制组为(919.28±3.06)%,转染对照组为(15.15±1.34)%,空白对照组为(7.20±0.71)%。从结果可以看出与空白对照组相比,miRNA-383过表达组、miRNA-383抑制组和转染对照组精子凋亡率平均数均有增加的趋势,其中miRNA-383过表达组差异无统计学意义(P>0.05),miRNA-383抑制组差异有统计学意义(P<0.01),转染对照组差异有统计学意义(P<0.05);与转染对照组相比,miRNA-383过表达组凋亡率下降且差异有统计学意义(P<0.05),miRNA-383抑制组凋亡率增加差异有统计学意义(P<0.05)。说明转染试剂对精子有一定毒性,能增加精子凋亡率,但miRNA-383过表达能一定程度对抗该影响,起到抑制精子凋亡的作用,抑制miRNA-383的表达能加剧精子凋亡。
2.4 雄性KM小鼠生活状态与体重变化情况 各组雄性小鼠无论在睾丸转染前还是后均活泼好动、正常采食饮水和自由梳理毛发,主动与雌性相互闻嗅舔舐追逐,并且具有正常的交配行为。睾丸转染期间雄性KM小鼠体重变化情况,每组平均体重均根据该组给药前体重进行校正。从图中可以看出各组在给药后平均体重都出现一定程度的下降趋势,其中miRNA-383过表达组校正后平均体重在给药第4~9d与空白对照组差异有统计学意义(P<0.05),第8d和9d与转染对照组比较差异有统计学意义(P<0.05),其余各组差异均无统计学意义(P>0.05),见图2。
2.5 内脏病理切片检测结果 KM小鼠肝、肾、肾上腺和睾丸病理组织切片结果,见图3。
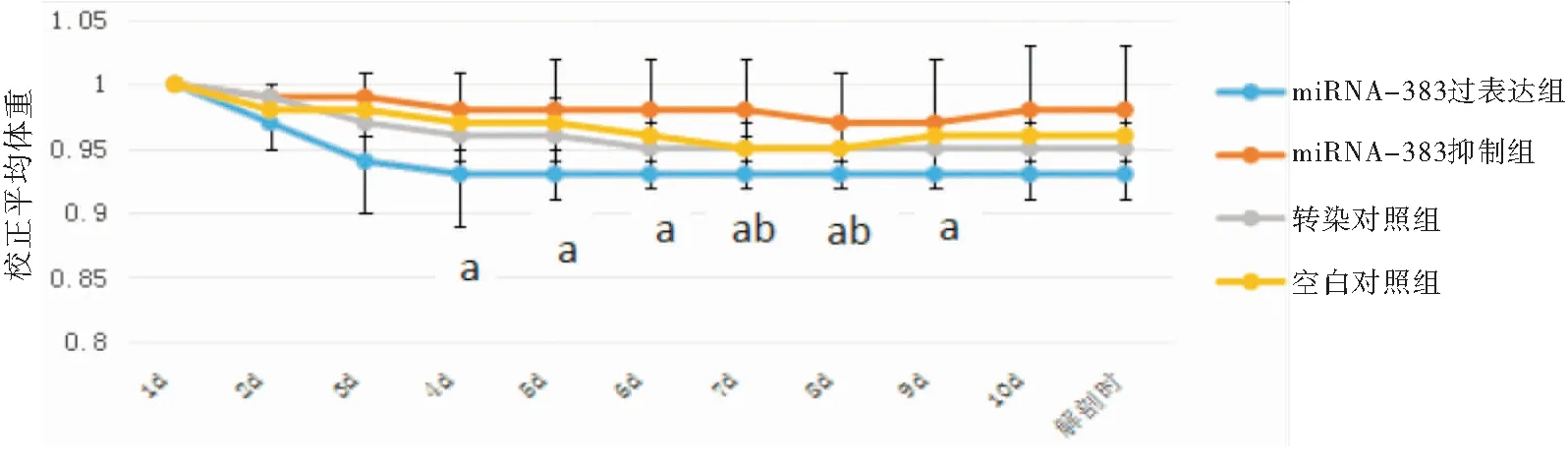
图2转染期间雄性KM小鼠体重变化情况Figure2WeightchangesofmaleKMmiceduringtransfection

图3 病理组织学HE染色显示(400×) Figure 3 Histopathologoical HE stacining
注:图①、②、③、④分别为miR383过表达组、miR383抑制组、转染对照组和空白对照组肝脏组织切片图,各组未见明显异常;图⑤、⑥、⑦、⑧分别为miR383过表达组、miR383抑制组、转染对照组和空白对照组肾脏组织切片图,miRNA-383过表达组和空白对照组未见明显异常;miRNA-383抑制组和转染对照组观察到轻微肾间质血管周围炎;图⑨、⑩、、分别为miR383过表达组、miR383抑制组、转染对照组和空白对照组肾上腺组织切片图,miRNA-383过表达组肾上腺内细胞坏死伴炎细胞浸润,其余各组未见明显异常;图、、、分别为miR383过表达组、miR383抑制组、转染对照组和空白对照组睾丸组织切片图,miRNA-383过表达组、miRNA-383抑制组和转染对照组都发现一定程度的精曲小管急性坏死,间质内炎细胞浸润、纤维组织增生;空白对照组未见明显异常
2.6 小鼠血液生化指标 转染对照组ALTL含量高于空白对照组,差异有统计学意义(P<0.05);miRNA-383过表达组和miRNA-383抑制组UA2含量均低于空白对照组,差异有统计学意义(P<0.05);而miRNA-383过表达组和miRNA-383抑制组与转染对照组相比各项指标差异无统计学意义(P>0.05),见表3。
2.7 小鼠主要脏器指数 与空白对照组相比,miRNA-383过表达组肾上腺指数偏低且差异极显著(P<0.01);转染对照组心脏指数偏高且差异显著(P<0.05)。与转染对照组相比,miRNA-383抑制组肺脏指数和肾脏指数差异有统计学意义(P<0.05);其余指标比较差异无统计学意义(P>0.05),表明降低睾丸中miRNA-383表达量可能对小鼠肺脏和肾脏有一定影响,见表4。

表3 各组血液生化指标检测结果 Table 3 Biochemical indexes of blood in each group
注:与空白对照组比较,①P<0.05

表4 内脏指数 Table 4 Visceral index
注:与空白对照组比较,①P<0.05;与转染对照组比较,②P<0.05
3 讨论
精子发生过程中,转录后调控非常活跃,介导的调控机制在有序调控基因表达中扮演重要角色。对基因表达的精确时空调控是精子发生正常进行的根本条件,这种调控主要是发生在转录和表观遗传学水平上的[8]。所以对于繁殖相关microRNA调控机制的深入研究以及如何开发应用具有重要意义。Lian等[4-5]发现miRNA-383的上调和IRF1的下调与MA型男性不育患者的生精细胞有丝分裂活性相关,并且miR-383-IRF1-pRb通路与睾丸生殖细胞肿瘤细胞NT-2的存活关联,总之miRNA-383抑制以IRF1为靶向的系列细胞周期相关基因。Huang等[9]发现正常男性miRNA-383主要表达于精原细胞和初级精母细胞,在精子中表达较少。miRNA-383能诱导γH2AX的下降,参与到DNA损伤通路的调控。而本试验结果显示与转染对照组相比,增加雄鼠睾丸内miRNA-383表达量能显著降低精子凋亡率,产子数有增加趋势;抑制miRNA-383的表达量精子凋亡率则显著增加,产子数有降低趋势。该结果与Lian等[4,5]有同一性,但角度不同。这说明miRNA-383对雄鼠繁殖力起重要的正向调控作用,过表达miRNA-383能促进其繁殖力,而睾丸中缺乏miRNA-383能降低繁殖力。同时该结果还提示能够通过睾丸转染的方式,利用miRNAs对雄鼠繁殖力进行干预,为进一步制作不育动物模型或者不孕症治疗研究提供基础。
与空白对照组相比,其余三组精子凋亡率都升高,产子数都有下降趋势,睾丸内部组织也都出现了一定程度损伤。说明转染试剂本身对小鼠睾丸有一定毒性。本文转染条件源于试剂说明书的推荐,但能否通过进一步优化转染试剂用量以及miRNA用量来减小局部转染对组织的毒性有待进一步研究。
活体基因局部转染排除了传统动物转基因不稳定、影响因素过多等多种弊端,试验效果能更直接反应目的基因对靶标组织的影响,具有直观方便等多种优点,在分子医学研究领域受到广泛应用[10-12]。miRNA-383非睾丸特异性microRNA,已有大量研究表明其对多种组织功能的发挥以及肿瘤细胞的生成和凋亡其重要调控作用[13-15],本文采取睾丸局部转染的方式最大程度降低其对其它组织、其它系统的影响。miRNA-383过表达组8d和9d校正后平均体重比转染对照组显著下降,肾上腺有一定程度异常;miRNA-383抑制表达组,肾脏观察到一定程度异常,肺脏指数和肾脏指数与转染对照组差异显著。说明睾丸转染miRNA-383对健康KM小鼠正常机体有一定影响,而该影响具体发生机制和对机体影响程度有待进一步研究。但转染前后4组小鼠生理生活、行为习惯等表现正常,没有出现死亡、器官衰竭等其它严重病症,表明该操作对小鼠机体总体影响不大。对比利用多种常见方法制作睾丸性不育小鼠模型后小鼠机体状态[18-19],可以看出该操作对小鼠正常机体影响较小。
4 结论
健康可育小鼠睾丸内miRNA-383表达量增加能显著降低精子凋亡率,反之则增加。miRNA-383对雄鼠繁殖力起重要的正调控作用,通过睾丸转染有望对雄鼠繁殖力进行人为干预。
【参考文献】
[1]Gudeloglu A, Parekattil S J. Update in the evaluation of the azoospermic male[J]. Clinics, 2013, 68: 27-34.
[2]Hayashi K, Lopes SMCDS, Kaneda M,etal. MicroRNA biogenesis is required for mouse primordial germ cell development and spermatogenesis[J]. Plos One, 2008, 3(3):1738.
[3]Yang Q, Hua J, Wang L,etal. MicroRNA and piRNA profiles in normal human testis detected by next generation sequencing[J]. PloS one, 2013, 8(6): 66809.
[4]Lian J, Tian H, Liu L,etal. Downregulation of microRNA-383 is associated with male infertility and promotes testicular embryonal carcinoma cell proliferation by targeting IRF1[J]. Cell death & disease, 2010, 1(11): 94.
[5]Lian J, Zhang X, Tian H,etal. Altered microRNA expression in patients with non-obstructive azoospermia[J]. Reproductive Biology and Endocrinology, 2009, 7(1): 1-10.
[6]Tian H, Cao Y X, Zhang X S,etal. The targeting and functions of miRNA-383 are mediated by FMRP during spermatogenesis[J]. Cell death & disease, 2013, 4(5): 617.
[7]Azarbarzin S, Safaralizadeh R, Kazemzadeh M,etal. The Value of MiR-383, an Intronic MiRNA, as a Diagnostic and Prognostic Biomarker in Intestinal-Type Gastric Cancer[J]. Biochemical Genetics, 2017: 1-9.
[8]田卉. miRNA 和遗传因素在男性不育发生中的功能研究[D]. 中国科学技术大学, 2014.
[9]Huang H, Tian H, Duan Z,etal. microRNA-383 impairs phosphorylation of H2AX by targeting PNUTS and inducing cell cycle arrest in testicular embryonal carcinoma cells[J]. Cellular signalling, 2014, 26(5): 903-911.
[10] Qin Q, Shi Y, Zhao Q,etal. Effects of CD25siRNA gene transfer on high-risk rat corneal graft rejection[J]. Graefe's Archive for Clinical and Experimental Ophthalmology, 2015, 253(10): 1765-1776.
[11] Jiang Z, Chen C H, Chen Y Y,etal. Autophagic effect of programmed cell death 5 (PDCD5) after focal cerebral ischemic reperfusion injury in rats[J]. Neuroscience letters, 2014, 566:298-303.
[12] Tan C C, Zhang J G, Tan M S,etal. NLRP1 inflammasome is activated in patients with medial temporal lobe epilepsy and contributes to neuronal pyroptosis in amygdala kindling-induced rat model[J]. Journal of neuroinflammation, 2015, 12(1): 18.
[13] Jiang Y, Sang Y, Qiu Q. microRNA-383 mediates high glucose-induced oxidative stress and apoptosis in retinal pigment epithelial cells by repressing peroxiredoxin 3[J]. American Journal of Translational Research, 2017, 9(5): 2374.
[14] Ma H, Liu B, Wang S,etal. MicroRNA-383 is a tumor suppressor in human lung cancer by targeting endothelial PAS domain-containing protein 1[J]. Cell Biochemistry and Function, 2016, 34(8): 613-619.
[15] Fateh A, Hosseinpour Feizi M A, Safaralizadeh R,etal. Prognostic and Predictive Roles of MIR-383 in Colorectal Cancer[J]. 2016, 2016:1-14.
[16] 刘风华, 杨冬梓, 王沂峰, 等. 睾丸性不育动物模型的建立[J]. 中华男科学杂志, 2007, 13(2): 125-129.
[17] 曲荣凤. 腺嘌呤诱导小鼠精原干细胞移植受体模型的建立[D]. 西北农林科技大学, 2014.

