缺氧盒在建立新生鼠神经干细胞缺氧细胞模型中的应用
陈长春 周勤 尹晓娟
神经干细胞(neural stem cells,NSCs)具有多向分化和自我更新功能,目前NSCs治疗神经系统退行性疾病主要采用NSCs移植和诱导自身的NSCs增殖分化两种方法[1-2]。人类采用NSCs治疗的疾病越来越多,基础研究采用动物和细胞模型模拟人类缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)进行模式研究,目前,有很多建立缺氧NSCs模型的方法[3-4],但由于不同的研究单位条件不同,有些方法对设备要求高,造价也高,因而不能普遍实用。若能寻找一种要求的设备简单、成本又低、操作简单而有效方法,那将是人类的福气。为此,本研究采用细胞培养及自制缺氧盒等技术,建立新生鼠(sprague dawley,SD)的NSCs缺氧细胞模型,旨在为开展NSCs与HIBD的相关研究提供新思路。
材料与方法
1.材料:健康新生1 d体重分别为8 g、9 g的SD大鼠2只,雌雄不限,购自中国人民解放军军事医学科学院(SCXK-(军)-2012-0004)。95% N2+ 5% CO2的混合气体(北京兆格气体科技有限公司),兔抗大鼠Nestin单克隆抗体(Santa)、表皮生长因子(EGF)、N2、新生的小牛血清(GibcoBRL)、B27、碱性成纤维细胞生长因子(bFGF)、细胞培养基DMEM/F12,SP通用抗体试剂盒,DAB试剂盒、细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)由碧云天公司提供,DMEM无糖培养基(Neuronbc),其它试剂为国产分析纯;乐扣矩形保鲜盒(HPL825-CHM),二氧化碳培养箱(SANYO,MCO-18AIC),迷你离心机(昊诺斯生物科技有限公司,10512425),摇床(其林贝尔,TS-1000)。
2.方法:
(1)分离SD乳鼠的海马组织。SD鼠用乙醚麻醉,脱颈处死,放入75%乙醇中浸泡消毒,移至超净工作台上,取出海马,将海马组织移入另一只冰浴的盛有D-hank′s液的平皿剪碎吹打,用200目钢丝网过筛,至10 ml试管中,加入0.25%的胰蛋白酶3 ml,放入37℃水浴箱水浴5 min,消化并充分吹打,用胎牛血清终止消化,以1 000 r/min转速,离心8 min,去除上清,留取管底白色沉淀物,即单细胞悬液,台盼蓝活细胞计数。
(2)NSCs体外培养及鉴定。参照文献[2]NSCs体外培养技术、鉴定方法,将获得的单细胞加入含血清培养基,充分吹打混匀,培养24 h后换无血清培养基培养,按5×105/ml细胞密度接种于25 ml培养瓶,37℃,5% CO2孵箱中培养,5~7 d进行传代培养,将传代第3代NSCs一部分按5×105活细胞/毫升的密度接种于25 ml培养瓶,一部分细胞接种于35 mm培养皿中培养,用于免疫细胞化学鉴定。取出细胞爬片放入6孔板内,漂洗,加入4%多聚甲醛溶液、0.5% Txiton X-100 溶液、3%H2O2,血清封闭,加入一抗Nestin(1:100),阴性对照用PBS代替,放入湿盒37°C孵育1-2 h,加入二抗,DAB显色,镜下观察并摄片。
(3)制作NSCs缺氧细胞模型。缺氧培养盒制作,参照文献[2],并加以改良,通入的混合气体密度相对较大,因此用钻孔器在保鲜盒上外处(出气孔)、里下位置(进气孔)分别凿1个孔,两个橡胶导管分别插入进出口中,用透明胶带严格固定封闭,进气孔通过吸氧管与湿化瓶连接,再通过橡胶导管与混合气体瓶连接,并用透明胶带严格固定封闭。将传代的NSCs重悬,按密度为5×105活细胞/ml加至一次性培养皿中;缺氧组更换为无糖DMEM培养基,放入自制缺氧盒中;对照组培养基仍不含血清,移入37℃、5% CO2温箱中培养。先用真空棒抽出装置内空气,抽完空气后立即夹住出气孔的橡胶导管,将其轻轻插入测氧仪的氧电极导管,当测氧仪显示氧气浓度<1%时,迅速打开阀门通入95% N2+ 5% CO2的混合气体,调节气体流量为1 L/min,在每个时相点持续通气,通过测氧仪持续监测氧气浓度,根据测氧仪显示氧浓度结果,动态调节通入95% N2+5%CO2的混合气体流量,使测氧仪显示氧气浓度<1%。选择通气体时间30 min、1 h及2 h为检测时相点,在各时相点取出细胞在显微镜下观察细胞形态、台盼蓝细胞计数和CCK-8法检测NSCs细胞活性,复氧同时更换无血清培养基。见图1。

图1 NSCs缺氧细胞模型装置
3.NSCs细胞缺氧模型建立成功标准:缺氧后NSCs数量减少,形态不规则,边界不清楚,折光性减弱,胞体肿胀,甚至出现核固缩、细胞膜破裂;各时相点缺氧组和对照组细胞分别加入0.4%的台盼蓝溶液,各组细胞在0.5 h、1 h、2 h等时相点行细胞染色,各时相点染色五次,记录死亡细胞数;取出两组部分细胞按2×104活NSCs/ml密度加入96孔酶标板内,滴加100 μl,各时相点滴加五个孔,每个孔内滴加10 μl CCK-8溶液充分混匀,置于37℃、5% CO2培养箱中培养4 h,打开酶标仪器,选择450 nm波长和630 nm参比波长,记录两组光密度值(optical density,OD)。 两组若在NSCs形态改变、台盼蓝死亡细胞计数、CCK-8检测细胞活性,以上三点中存在差异,则表明缺氧NSCs模型制作成功。
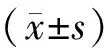
结果
1.NSCs细胞的形态:经Nestin抗体鉴定该细胞为NSCs,见图2。缺氧前NSCs细胞形态规则,遮光性较强,边界较清楚,缺氧后细胞形态不规则,数量明显减少,缺氧时间的延长,细胞出现破裂,皱缩,见图3、图4。复氧复糖72 h后细胞形态不规则,数量减少,可见大小不等的克隆神经球,见图5。
2.各缺氧时相点台盼蓝NSCs计数:缺氧30 min NSCs死亡细胞数量(2.000±0.707)与对照组(2.200 ±0.837)比较,差异无统计学意义;缺氧1 h NSCs死亡细胞数量(9.200±2.387)与对照组(2.600 ±0.548)比较,差异具有统计学意义;缺氧2 h NSCs死亡细胞数量(21.000±1.581)与对照组(1.800 ±0.447)比较,差异有统计学意义;缺氧时间越长,死亡细胞数越多。
3.各缺氧时相点CCK-8法检测NSCs活性:缺氧30 minNSCs活性与对照组比较,差异无统计学意义;缺氧1 h、2 h NSCs的活性与对照组比较,差异均有统计学意义;缺氧1 h、2 h组与其他各组比较,差异均有统计学意义。见表1。
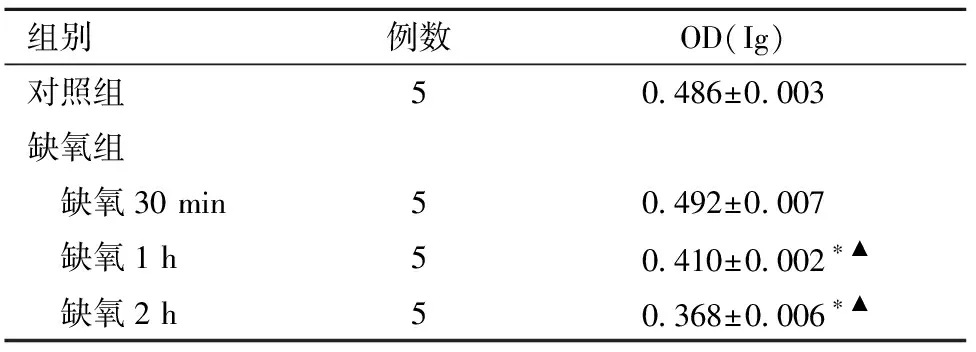
表1 NSCs细胞活性比较
注:与对照组比较,*P<0.05;组间比较,▲P<0.05
4.各复氧复糖时相点CCK-8法检测NSCs活性:复氧复糖24 h缺氧组OD值(0.409±0.002)与对照组(0.486±0.002)比较,差异具有统计学意义;复氧复糖72 h缺氧组OD值(0.483±0.003)与对照组(0.511±0.002)比较,差异具有统计学意义。
讨论
目前,国内外建立了多种细胞缺氧方法,化学性缺氧包括碱性焦性没食子酸溶液、厌氧产气袋等,碱性焦性没食子酸溶液法的优点是不与培养基接触、同时清除培养盒及培养基中的氧,缺点是废液可对水体环境产生污染、配制碱性液体时氢氧化钠可对操作人员、物品等造成危害[3]。厌氧产气袋法优点是不会产生压差和高温、废弃物处理方便、无污染,但存在缺氧时间长、费用高的缺点[4]。化学方法设备简单,制备迅速,但化学药物不可避免会对细胞产生损伤,且与真实缺氧有一定差异[5]。物理性缺氧是将培养的细胞置于充有N2和C02混合气体的低氧环境中培养。三气培养箱具有精确控制培养环境中O2及CO2浓度、波动幅度极小、稳定性高等优点,但具有成本高、缺氧时间长、占据一定空间等缺点[5]。
建立细胞缺氧模型的关键是控制作用时间、氧浓度,时间短、浓度低则达不到建模效果,时间长、浓度高则导致细胞死亡。低氧和缺氧对NSCs增殖及分化有不同的影响,NSCs处于相对低氧(氧浓度1%~8%)环境,3%~5%氧气浓度能够促进NSCs增殖和分化;缺氧(氧浓度 本研究设置3个缺氧时相点,采用CCK-8法及台盼蓝染色法检测细胞活性及死亡细胞数,当缺氧30 min时,NSCs死亡细胞数及活性与对照组比较均无明显变化;当缺氧时间达到1 h、2 h,NSCs死亡细胞数及活性与对照组比较,差异具有统计学意义;故认为缺氧1 h为建立NSCs细胞缺氧模型的最佳时间点,这样既节省了实验时间又达到了实验目的。 谭盛等[5]实验结果表明缺氧2 h可促进NSCs增殖且存活率有一定增长,而本实验缺氧2 h NSCs死亡细胞数增多且活性明显降低;出现此相反结果的原因可能是:(1)本装置内氧浓度更低,能在短时间内达到缺氧效果;(2)DMEM无糖培养基类似于活体发生低张性和循环性缺氧,而无糖Earle,S平衡盐溶液适合与NSCs增殖;(3)成年大鼠海马NSCs与生后1天大鼠NSCs生理状况存在差异。本装置采用真空棒抽气法清除装置内的氧,这与谭盛等[5]除氧法相比,本方法明显缩短清除氧气的时间。 本实验装置及方法具有经济、实用易操作、实验时间短、占据空间小、清洗方便、可重复使用、氧气清除率高、稳定性及安全性高等优点,所以该方法经济实用易操作、仪器简单、效率及成功率高。 (图2~图5见封底) 1 Yin XJ,Li H,Zhang XY,et al.Development of neural stem cells at different sites of fetus brain of different gestational age.Int J Clin Exp Pathol,2013,6:2757-2764. 2 王钰,尹晓娟.锂对缺氧状态下新生鼠神经干细胞损伤的影响.中国儿童保健杂志,2013,21:1045-1048. 3 韩宁,殷安安,章翔,等.缺氧盒在神经干细胞氧糖剥夺培养中的应用.中华神经外科疾病研究杂志,2013,12:5-7. 4 Katoh C,Osanai T,Tomita H,et al.Brain natriuretic peptide is released from human astrocytoma cell line U373MG under hypoxia:a possible role in anti-apoptosis.J Endoerinol,2011,208:51-57. 5 谭盛,陈健,郭阳,等.大鼠成年海马神经干细胞体外氧糖剥夺/复氧模型的建立.中华神经医学杂志,2011,10:1238-1242. 6 Binh NH,Aoki H,Takamatsu M,et al.Time-sensitive effects of hypoxia on differentiation of neural stem cells derived from mouse embryonic stem cells in vitro.Neurol Res,2014,36:804-813. 7 Liu Q,Fan X,Zhu J,et al.Co-culturing improves the OGD-injured neuron repairing and NSCs differentiation via Notch pathway activation.Neurosci Lett,2014,559:1-6. 8 Yao L,Chen X,Tian Y,et al.Selection of housekeeping genes for normalization of RT-PCR in hypoxic neural stem cells of rat in vitro.Mol Biol Rep,2012,39:569-576. 9 Park J,Park HH,Choi H,et al.Coenzyme Q10 protects neural stem cells against hypoxia by enhancing survival signals.Brain Res,2012,1478:64-73. 10 Liu SP,Fu RH,Wu DC,et al.Mouse-induced pluripotent stem cells generated under hypoxic conditions in the absence of viral infection and oncogenic factors and used for ischemic stroke therapy.Stem Cells Dev,2014,15,23:421-433.

