甘肃不同产地甘肃黄芩解热、抗炎的研究*
孙向阳, 罗小明, 王琳萍
(临夏回族自治州人民医院,甘肃 临夏 731100)
甘肃黄芩ScutellariarehderianaDiels作为唇形科植物黄芩ScutellariabaicalensisGeorgi的替代药材使用,具有较久的使用历史[1-2], 主要功效为清热燥湿、泻火解毒、止血安胎,是十大陇药之一,甘肃省为甘肃黄芩的主产区[3]。基于此,本研究收集了张家川县、泾川县[4]、和政县、临夏县4个产地的甘肃黄芩,从解热、抗炎两个角度反映甘肃黄芩的药理作用,为其临床运用及开发提供参考。
1 材料与方法
1.1 动 物
SPF级小鼠60只,雌雄各半,体质量18~22 g,动物合格证号SCXK(甘)2015-0001;SPF级大鼠49只(雌性24只,雄性25只),体质量180~220 g,动物合格证号SCXK(甘)2015-0001。均购自中国农业科学院兰州兽医研究所实验动物中心。
1.2 药品、试剂与仪器
临夏县甘肃黄芩、泾川县甘肃黄芩、和政县甘肃黄芩,张家川县甘肃黄芩分别购自各产地,由临夏市益生中药饮片厂炮制。取甘肃黄芩饮片适量,加10倍水浸泡30 min,第一次煎煮1.5 h,第二次煎煮1 h,合并两次煎煮液,减压浓缩成含生药1 g/mL的煎煮液,于冰箱4 ℃保存备用[5]。食母生片,规格0.2 g/片,广东五洲药业有限公司产品,批号1610315;吲哚美辛片,规格25 mg/片,山西云鹏制药有限公司产品,批号A160302;阿司匹林肠溶片,规格25 mg/片,石药集团欧意药业有限公司产品,批号018140295,用生理盐水配制成质量分数为9.0 g/L的混悬液。二甲苯,南京化学试剂厂产品,批号010920;生理盐水,石家庄四药有限公司产品,批号1705133202;其余试剂均为分析纯;水为纯净水。XB-8656型电子体温计,无锡新中瑞婴儿用品有限公司产品;PL303型电子天平,瑞士梅特勒托利多有限公司产品。
1.3 统计学方法
2 方法与结果
2.1 解热实验
实验开始前测大鼠肛温,1 d 3次,连续3 d,使大鼠适应该测温操作。实验开始当日每隔1 h测量体温,复制模型前各组大鼠基础肛温在36.56~37.17 ℃,平均肛温(36.85±0.37)℃,各组大鼠基础体温差别无统计学意义(P>0.05)。取自身体温变化≤0.3 ℃的大鼠进行实验。采用大鼠背部皮下注射200 g/L酵母悬液(取食母生10 g,逐渐加入纯化水并研磨制成混悬液,定容至50 mL,即得。注射剂量为2.0 mL/100 g)的方法复制发热模型,正常组皮下注射等容量的生理盐水,注射完成后测肛温,选肛温升高>0.8 ℃的大鼠进行实验。按照随机数字表法进行分组,每组7只,分为正常对照组、模型对照组、阿司匹林组(0.1 g/kg)、临夏县组(相当于生药量10 g/kg)、泾川县组(相当于生药量10 g/kg)、和政县组(相当于生药量10 g/kg)、张家川县组(相当于生药量10 g/kg)。
正常对照组和模型对照组每日按10 μL/g生理盐水灌胃,阿司匹林组灌胃阿司匹林肠溶片混悬液9.4 μg/g[6-7];各产地黄芩组均按照相当于生药量10 g/kg的剂量灌胃给药。1 d 1次,连续7 d。测量末次给药后 1-4 h大鼠的肛温,分别计算不同时间点大鼠体温升高值,并进行组间对比。结果:阿司匹林组和各产地甘肃黄芩组均能不同程度地抑制酵母所致大鼠体温升高,使大鼠体温在致热2 h后逐步降低。见表1。考虑到是同一主体不同时间点的体温变化,数据分析采用重复测量数据的方差分析(见表2、表3、图1)。表2为不同时间点数据的球形检验,结果显示:不同时间点(该不同时间点是指所有组的各检测点的总体比较,不确指某个检测点的两两比较)P<0.05,所以不满足球形分布假设,即不同时间点之间差别有统计学意义(P<0.05)。表3反映的是不同组别和不同时间点之间的交互作用;多变量方差分析的结果给出了4种统计量,它们的检验结果一致,各时间点的P<0.05,说明各个时间点的数据的差别有统计学意义,时间点和组别交互作用的P>0.05,说明时间和分组无交互作用,说明时间因素(即0.5,1,2,3,4 h)的作用不随分组(即各给药组)的不同而不同。由图1可以直观地看出测量指标随时间的变化趋势。各给药组随时间变化的趋势大致相同,其中模型对照组数据明显偏高(P<0.05),张家川县组在2 h后的体温升高程度明显高于临夏县组、泾川县组、和政县组(P<0.05)。
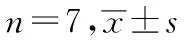

组 别剂量(g/kg)基础体温给药后体温升高值/Δ℃0.5 h1 h2 h3 h4 h正常对照组—37.15±0.370.01±0.060.02±0.08-0.12±0.14-0.12±0.17-0.12±0.14模型对照组—36.95±0.281.64±0.161.62±0.151.63±0.171.61±0.161.59±0.12阿斯匹林组0.136.98±0.350.65±0.17*0.77±0.21*0.81±0.16*0.86±0.14*0.79±0.12*临夏县组1036.92±0.470.72±0.15*0.79±0.16*0.85±0.14*0.78±0.16*0.62±0.17*泾川县组1037.07±0.380.79±0.22*0.83±0.11*0.89±0.21*0.95±0.15*0.87±0.13*和政县组1037.15±0.410.84±0.24*0.89±0.20*0.93±0.22*0.89±0.27*0.85±0.21*张家川县组1036.95±0.440.98±0.18*#△1.01±0.18*#△1.12±0.26*#△*1.23±0.18*#△*▲1.08±0.16*#△*
注:与模型对照组对比,*P<0.05;与阳性组对比,#P<0.05;与临夏县组对比,△P<0.05;与泾川县组对比,*P<0.05;与和政县组对比,▲P<0.05

表2 不同测定点重复测量数据球形检验结果
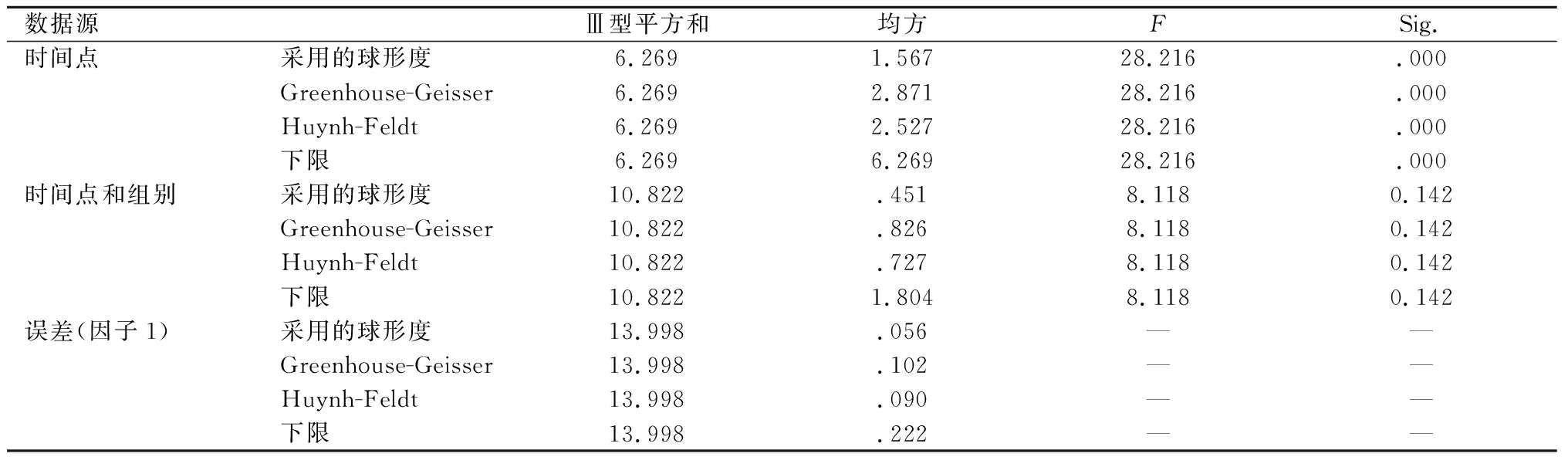
表3 不同时间点多变量检验

1.正常对照组; 2.模型对照组;3.阿斯匹林组; 4.临夏县组; 5.泾川县组;6.和政县组; 7.张家川县组图1 不同时间点测量值边界估计
2.2 抗炎实验
取小鼠60只,按随机数字表法分为6组,即模型对照组、吲哚美辛组、临夏县组、泾川县组、和政县组、张家川县组。吲哚美辛组给以吲哚美辛片混悬液(使用前用生理盐水配制成质量分数为0.75 g/L
的混悬液),以9.4 μg/g的剂量灌胃给药;黄芩各给药组按照10 g/kg的剂量给予不同产地黄芩饮片煎煮液;模型对照组小鼠灌胃9 g/L生理盐水0.02 mL/g。1 d 1次,连续3 d。末次给药1 h后,每只小鼠右耳廓两面涂抹二甲苯20 μL,复制小鼠耳肿胀炎症模型,并以左耳做对照。采用直径6 mm的打孔器分别在左右两耳对称部位打下圆形耳片,精密称定,计算肿胀度和肿胀抑制率。肿胀度=右耳片重-左耳片重;肿胀抑制率=(给药组小鼠耳片肿胀度/对照组小鼠耳片肿胀度)×100%[8-9]。结果:与模型对照组对比,吲哚美辛组和4个黄芩饮片组的小鼠耳肿胀度降低,差别有统计学意义(P<0.05)。表明:各药物能明显抑制小鼠耳廓肿胀。与吲哚美辛组对比,临夏县组、泾川县组、和政县组、张家川县组小鼠耳廓肿胀的抑制程度明显偏低(P<0.05)。临夏县组、泾川县组、和政县组3个组组间对比,差别无统计学意义(P>0.05);张家川县组与临夏县组、泾川县组、和政县组3个组对比,差别有统计学意义(P<0.05)。见表4。
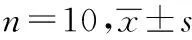

组 别剂量/(g·kg-1)耳片质量/mg左右肿胀度/mg肿胀抑制率/%模型对照组—16.58±1.8142.68±1.6825.86±1.86—吲哚美辛组0.117.05±1.4228.04±1.8210.05±1.04*57.25临夏县组1015.93±1.7530.25±2.3614.13±1.24*#46.11泾川县组1016.85±1.8832.57±2.0216.33±1.86*#37.95和政县组1016.77±1.9633.25±2.6716.47±1.75*#38.46张家川县组1016.34±1.7436.54±2.0119.22±1.05*#△*▲26.83
注:与模型对照组对比,*P<0.05;与吲哚美辛组对比,#P<0.05;与临夏县组对比,△P<0.05;与泾川县组对比,*P<0.05;与和政县组对比,▲P<0.05
3 讨 论
发热是人体病态体征的表现,主要是细菌、病毒、内毒素等外源性致热物质侵袭机体巨噬细胞产生内源性致热源,内源性致热源通过刺激下丘脑体温调节中枢而上移体温调定点,从而导致体温升高。酵母菌混悬液致热机制是:酵母菌中所含的荚膜多糖和蛋白质使大鼠注射部位局部溃烂,引起炎症,从而发热。该致热过程与临床上由内脏或皮肤明显炎症所致发热情况相类似,因此本实验中以酵母菌复制大鼠发热模型以考察不同产地黄芩饮片及其炮制品的解热作用。二甲苯可迅速扩张小鼠耳廓毛细血管,增加血管通透性导致炎症介质渗出,因此,本实验采用二甲苯复制急性炎症模型。
重复测量方差分析是针对同一观察对象的同一指标在不同时间点或环境下进行的多次测量分析,主要用于分析观察指标的变化趋势及相关影响因素对其干扰程度,通过建立精确度数学模型反应效应值随时间变化的统计学趋势。本研究考察了不同时间点大鼠的体温升高程度,在评价各给药组体温升高的同时,还反映出影响体温变化的因素,数据间的变量关系有一定的相关性,因此,本研究未采用常用的组间比较的t检验或单因素方差分析。
本研究结果显示:4个不同产的甘肃黄芩饮片均能抑制干酵母导致的大鼠体温升高,均显著低于模型对照组大鼠的体温升高程度(P<0.05)。临夏县组、泾川县组、和政县组的解热作用明显强于张家川县组,该作用强度的反差主要体现在不同产地黄芩解热活性成分的含量上;不同时间的体温升高值的球形检验结果提示不同时间点的体温变化有显著差异(P<0.05),而各时间点与不同分组之间没有交互作用(P>0.05),提示体温的变化与组间给药物质有显著性关系;在给药2-3 h后,各组大鼠体温出现下降趋势,可能与药物性体温调节有关。从抗炎情况来看,不同产地的黄芩均有一定的抗炎作用,临夏县组、泾川县组、和政县组3组之间抗炎作用对比差别无统计学意义(P>0.05),张家川县组抗炎作用明显低于上述3个产地的甘肃黄芩(P<0.05)。综上所述,临夏县、泾川县、和政县所产甘肃黄芩的解热、抗炎作用强于张家川县所产甘肃黄芩,可能与甘肃黄芩产地及化学组分的积累有关。
4 参考文献
[1]谢宗万.中药材品种论述:中册[M].上海:上海科学技术出版社,1984:177.
[2]甘肃省卫生局.甘肃中草药手册[M].兰州:甘肃人民卫生出版社,1971:401.
[3]高慧琴,晋玲.十大陇药(七)-黄芩[J].甘肃中医学院学报,2014,31(3):2.
[4]杨全,白音,陈千良,等.黄芩资源现状及可持续利用的研究[J].时珍国医国药,2006,17(7):1159-1160.
[5]丁长玲,邱世翠,宫照龙,等.甘草的体外抑菌作用研究[J].时珍国医国药,2002,13(9):518.
[6]刘静,吕晓静,田兴美,等.新癀片对动物发热模型的解热作用研究[J].现代药物与临床,2015,30 (4):375-379.
[7]李兴平,白筱璐,雷玲,等.金银花的解热作用[J].中药药理与临床.2012,28(2):36-39.
[8]杨艳,韦余,王玉和,等.黔产毛蒟挥发油抗炎镇痛活性研究[J].中国药师,2016,19(10):1837-1840.
[9]沈磊,谢文菠,王修波,等.滇龙胆不同部位提取物保肝抗炎作用的研究[J].中成药,2017,39 (4 ):701-705.

