I-/Fe3+体系查尔酮和β-烯胺酮[3+2]反应研究
, ,
(浙江工业大学 绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014)
二氢吡咯及其衍生物是一类重要的五元含氮杂环化合物,广泛存在于各类天然产物和具有生物活性的分子中,展现出了非常重要的应用[1],这类化合物不仅是用于合成高度功能化的吡咯(它们的完全氧化产物)和四氢吡咯(它们的完全还原产物)的关键中间体,同时也被当作重要的骨架应用到许多全合成中去构建活性分子[2-3].正因为如此,关于合成二氢吡咯及其衍生物的方法很有很多,其主要的合成方法主要有金属催化反应[4-13]、环加成反应[14-16]和串联环合反应[17-18].
课题组研究了以查尔酮和β-烯胺为原料,在碘引发条件下通过Michael加成/环合反应合成了一些列多取代的2,3-二氢吡咯类化合物[18].得出了以碳酸钾为碱,在碘存在下,二氯甲烷为溶剂,反应温度为80 ℃,以23%~93%的收率合成24 个多取代的二氢吡咯化合物,提出了碘引发的串联环合反应机理.在此研究的基础上,考虑用I-和氧化剂代替方法中的碘合成多取代的2,3-二氢吡咯类化合物.
1 实验部分
1.1 实验试剂与仪器
X-4数字显示显微熔点仪;低温恒温搅拌反应浴DHJF-8002(郑州长城科工贸有限公司);旋转蒸发仪RE-52AA(上海亚荣生化仪器厂);红外线快速干燥器WS70-1(上海锦屏仪器仪表有限公司);GC-MS(Varian431GC-210MS);1H NMR在Bruker-AV-500(500 MHz)核磁共振仪上测定,13C NMR在Mercuryplus 400(100 MHz)或Bruker-AV-500(125 MHz)核磁共振仪上测定,溶剂为氘代氯仿,内标为四甲基硅烷(TMS);红外光谱在Bio Rad FTS-185型仪器上测定;HRMS在TOF仪器上测定;柱层析使用300~400 目硅胶.TLC使用自制硅胶板或者GF254高效薄层层析硅胶板.常用显色条件:紫外灯、碘缸、高锰酸钾溶液和茚三酮等.
所有溶剂和试剂除特别说明外均按标准方法进行纯化或处理.
1.2 查尔酮(Ⅰ)的合成方法
以Ⅰa为例,在低温恒温搅拌反应浴中向苯甲醛(1.06 g,10 mmol)和苯乙酮(1.20 g,10 mmol)的乙醇(30 mL)混合溶液中滴加30 mL的NaOH水溶液(0.80 g,20 mmol)并保持温度在0 ℃以下.滴加完毕后,将圆底烧瓶转移到室温下搅拌3 h,并用TLC检测反应进程,当原料反应完全后,对混合反应液进行抽滤处理,抽滤结束后用乙醇和水溶液(体积比为1︰1)洗涤滤饼,干燥,得到目标查尔酮1.77 g,收率为85%.反应式为

1.3 β-烯胺(Ⅱ)的合成合成方法
以Ⅱa为例,向25 mL圆底烧瓶中加入乙酰乙酸乙酯(1.30 g,10 mmol),苯胺(1.12 g,12 mmol)
和无水乙酸镍(0.352 g,2 mmol)在室温下搅拌,并用TLC检测反应的进程,待原料完全反应后,抽滤(将乙酸镍除去),滤液旋干,再进行柱层析分离,便得到无色油状物1.81 g,收率为88%.反应式为

1.4 目标化合物(Ⅲ)的合成方法
以Ⅲa为例,向25 mL反应管中加入查尔酮(0.104 g,0.5 mmol),β-烯胺酯(0.123 g,0.6 mmol),碳酸钾(0.069 g,0.5 mmol),氯化铁(0.121 g,0.75 mmol)和碘化锌(0.240 g,0.75 mmol),在2 mL 80℃的DCE溶剂中用氮气保护搅拌反应8 h,并用TLC检测反应的进程,待原料完全反应后,反应液用水萃取并用无水硫酸镁干燥,然后用旋转蒸发仪除去溶剂,之后用柱层析分离(V(乙酸乙酯)︰V(石油醚)=1∶6),得到目标产物Ⅲa.
2 结果与讨论
2.1 条件优化
在上述实验操作下选用了查尔酮Ⅰa和β-烯胺酯Ⅱa作为原料进行实验,研究了不同氧化剂对反应的选择性的影响(表1).反应式为

表1 优化反应条件1)Table 1 Optimization of reaction conditions

序号催化体系比例2)溶剂收率3)/%ⅢaⅣa1乙醇45152n(KI )∶n(H2O2 )∶n(K2CO3 )2.4∶2.0∶1.0甲苯——3二氯乙烷——4乙醇——5n(KI)∶n(FeCl3)∶n(K2CO3)0.5∶2.0∶1.0甲苯1036二氯乙烷1737乙醇5258n(KI)∶n(Na2S2O8)∶n(K2CO3)0.5∶1.0∶1.0甲苯——9二氯乙烷——
注:1) 化合物Ⅰa(0.5 mmol),Ⅱa(0.6 mmol)在2 mL溶剂中搅拌反应直到Ⅰa反应完;2) 催化体系中各物质的量比;3) 分离收率.
对不同的氧化剂体系进行了溶剂的筛选.由表1可以看出:双氧水以及过硫酸钠作为氧化剂时在乙醇溶剂中得到了目标产物(表1序号1,7),其他溶剂如氯仿、甲苯等都没有得到相应的产物.在得到二氢吡咯的同时还有进一步氧化的产物吡咯的生成.氯化铁做氧化剂时在二氯乙烷和甲苯中能得到目标产物(表1序号5,6).然后对得到的产物用气质联用仪检测判断两种产物的比例,经过检测知道当用氯化铁做氧化剂时在二氯乙烷溶剂中二氢吡咯的比例较大,此时氧化产物吡咯化合物的含量很少,因此选择氯化铁作为氧化剂进行继续研究优化条件.反应式为

以氯化铁作为氧化剂,反应产物中仍然有进一步氧化吡咯类化合物生成,考虑到该氧化过程可能是氧气参与的结果,虽然用氯化铁做氧化剂时二氢吡咯化合物的比例较大,但还是有少量的吡咯化合物,因此尝试了在氮气保护下的反应,经过对得到的产物检测,产物中只有二氢吡咯化合物,没有进一步氧化的吡咯化合物,但是目标产物的收率只有43%(表2序号1).当反应中不加入碘化钾时收率有了明显的下降,说明只是氯化铁和碳酸钾的作用下不能得到好的收率(表2序号2).为了进一步提高产物的收率,对碘化钾和氯化铁的不同比例进行了研究,在碘化钾和氯化铁的体系中收率最高达到了49%(表2序号4).尝试了其他的碘化物来提供I-,当用碘化锌代替碘化钾在之前的最优条件下(表2序号4),收率稍微有所提高为54%(表2序号13).之后,尝试了不同溶剂和催化剂的比例都没有提高产物的收率,到此优化得到的最优条件是1.5 倍量的碘化锌、1.5 倍量的氯化铁及1 倍量的碳酸钾用二氯乙烷作溶剂在氮气氛围下反应8 h.

表 2 优化反应条件1)Table 2 Optimization of reaction conditions
注:1) 化合物Ⅰa(0.5 mmol),Ⅱa(0.6 mmol)在2 mL溶剂中搅拌反应直到Ⅰa反应完;2) 催化体系中各物质的物质的量比;3) 分离收率;4) 干燥的二氯乙烷.
2.2 底物拓展
在最优条件下对该反应进行了一系列底物拓展,反应式为

共合成了16 个化合物,收率在10%~54%之间,具体如下:
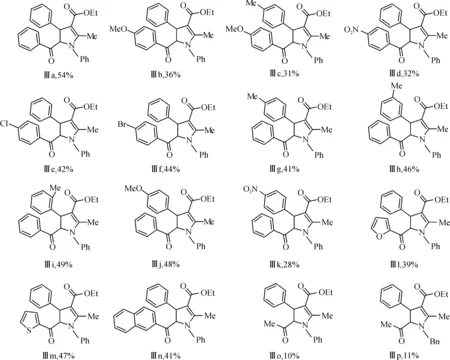
实验中各类取代的查尔酮都进行了尝试,包括吸电子基取代的查尔酮,供电子基取代的查尔酮,稠杂环查尔酮以及苄叉丙酮.实验发现:当查尔酮的芳环上连有强吸电子基团—NO2时,相对应的产物收率有很大的降低(Ⅲd,Ⅲk).当查尔酮的芳环上连有供电子基团(—CH3,—OCH3)时,相对应产物的收率也有所降低(Ⅲb,Ⅲc,Ⅲg,Ⅲj).卤素取代的查尔酮能够很好的和β-烯胺酯反应,当R2分别为氯-和溴-取代的芳环时,相对应的二氢吡咯Ⅲe,Ⅲf的收率分别为42%,44%.空间效应影响也做了研究,间位和邻位取代的查尔酮同样能够有效的参与反应,并取得了很好的收率(Ⅲh,Ⅲi),影响不大.
2.3 代表化合物表征
(Ⅲa):1H NMR (500 MHz,CDCl3)δ7.88~7.84(m,2H),7.60(t,J= 7.4 Hz,1H),7.45(t,J= 7.8 Hz,2H),7.39~7.28(m,7H),7.22~7.15(m,3H),5.42(d,J= 3.7 Hz,1H),4.11(d,J= 3.1 Hz,1H),4.04~3.88(m,2H),2.49(s,3H),1.03(t,J= 7.1 Hz,3H);13C NMR(125 MHz,CDCl3)δ194.38,166.19,158.80,144.10,140.88,133.82,133.77,129.31(2C),129.12(2C),128.82(2C),128.72(2C),127.33(2C),127.14,125.83,125.59(2C),104.49,77.57,58.72,51.03,14.29,14.25; IR(KBr)2 978,1 691,1 664,1 588,1 500,1 412,1 222 cm-1; HRMS(ESI-TOF)m/zcalcd for C27H26NO3[M+H]+412.191 3,found 412.192 4.
(Ⅲb):1H NMR(500 MHz,CDCl3)δ7.83(d,J= 8.9 Hz,2H),7.39~7.28(m,7H),7.20~7.15(m,3H),6.92(d,J= 8.9 Hz,2H),5.37(d,J= 3.8 Hz,1H),4.10(d,J= 3.0 Hz,1H),4.02~3.89(m,2H),3.88(s,3H),2.48(s,3H),1.03(t,J= 7.1 Hz,3H);13C NMR(125 MHz,CDCl3)δ193.10,166.18,164.07,158.77,144.28,140.98,131.35(2C),129.25(2C),128.65(2C),127.34(2C),127.03,126.74,125.69,125.49(2C),114.03(2C),104.53,77.38,58.62,55.50,51.36,14.25,14.21; IR(KBr)2 980,1 676,1 601,1 574,1 503,1 392,1 238 cm-1; HRMS(ESI-TOF)m/zcalcd for C28H28NO4[M + H]+442.201 8,found 442.201 6.
(Ⅲc):1H NMR(500 MHz,CDCl3)δ7.84(d,J= 8.9 Hz,2H),7.33(t,J= 7.9 Hz,2H),7.22~7.13(m,7H),6.92(d,J= 8.9 Hz,2H),5.33(d,J= 3.6 Hz,1H),4.06(d,J= 2.8 Hz,1H),4.01~3.90(m,2H),3.88(s,3H),2.47(s,3H),2.37(s,3H),1.05(t,J= 7.1 Hz,3H);13C NMR(125 MHz,CDCl3)δ193.12,166.25,164.02,158.48,141.27,141.00,136.55,131.37(2C),129.35(2C),129.22(2C),127.18(2C),126.67,125.56,125.35(2C),114.01(2C),104.72,77.47,58.66,55.52,50.90,21.14,14.32,14.27; IR(KBr)2 979,1 678,1 600,1 575,1 501,1 406,1 237 cm-1; HRMS(ESI-TOF)m/zcalcd for C29H30NO4[M + H]+456.217 5,found 456.217 3.
(Ⅲl):1H NMR(500 MHz,CDCl3)δ7.60(d,J= 1.1 Hz,1H),7.37~7.25(m,7H),7.21~7.15(m,3H),7.09(d,J= 3.6 Hz,1H),6.53(dd,J= 3.6,1.7 Hz,1H),5.15(d,J= 4.1 Hz,1H),4.20(d,J= 3.4 Hz,1H),4.04~3.90(m,2H),2.45(s,3H),1.03(t,J= 7.1 Hz,3H);13C NMR(125 MHz,CDCl3)δ184.15,166.16,159.02,150.52,147.30,144.38,140.80,129.28(2C),128.58(2C),127.23(2C),126.95,126.05 125.92(2C),119.03,112.47,104.06,77.69,77.29,58.68,51.37,14.21,14.12; IR(KBr)2 976,1 684,1 659,1 578,1 494,1 400,1 223 cm-1; HRMS(ESI-TOF)m/zcalcd for C25H24NO4[M + H]+402.170 5,found 402.170 4.
(Ⅲm):1H NMR(500 MHz,CDCl3)δ7.71(dd,J= 4.9,0.9 Hz,1H),7.47(dd,J= 3.8,0.8 Hz,1H),7.38~7.27(m,7H),7.22~7.17(m,3H),7.10(dd,J= 4.8,3.9 Hz,1H),5.18(d,J= 4.2 Hz,1H),4.23(d,J= 3.5 Hz,1H),4.04~3.90(m,2H),2.45(s,3H),1.03(t,J= 7.1 Hz,3H);13C NMR(125 MHz,CDCl3)δ188.27,166.13,158.81,144.23,140.88,134.89,132.86,129.36(2C),128.70(2C),128.34,127.32(2C),127.10,126.08,125.80(2C),104.45,78.52,58.74,51.85,14.22(2C); IR 2 974,1 656,1 578,1 493,1 402,1 232(KBr)cm-1; HRMS(ESI-TOF)m/zcalcd for C25H24NO3S [M + H]+418.147 7,found 418.148 8.
(Ⅲq):1H NMR(500 MHz,CDCl3)δ7.87(dd,J= 8.3,1.1 Hz,2H),7.61(t,J= 7.4 Hz,1H),7.46(t,J= 7.8 Hz,2H),7.33(t,J= 7.3 Hz,2H),7.28~7.25(m,1H),7.23~7.19(m,2H),5.06(d,J= 4.0 Hz,1H),4.02(d,J= 3.8 Hz,1H),3.96~3.80(m,2H),3.57~3.49(m,1H),3.05~2.97(m,1H),2.50(s,3H),1.57~1.44(m,2H),1.41~1.30(m,2H),0.98~0.90(m,6H);13C NMR(125 MHz,CDCl3)δ195.01,166.33,161.47,144.94,133.99,133.72,129.07(2C),128.80(2C),128.55(2C),127.33(2C),126.85,99.81,74.03,58.24,50.61,44.99,30.77,20.18,14.26,13.80,12.26; HRMS(ESI-TOF)m/zcalcd for C25H30NO3[M + H]+392.222 6,found 392.223 6.
2.4 机理探究
根据基于实验结果和文献报道,推测的反应机理如下:

首先碘负离子在三价铁的氧化下得到碘分子,然后查尔酮(Ⅰa)在碘的诱导下与β-烯胺酯(Ⅱa)发生Michael加成反应生成中间体A,期间β-烯胺酯(Ⅱa)可能发生共振以Ⅱa′形式存在,然后中间体A发生碘代,生成中间体B,接着,中间体B中氮上的孤对电子进攻碘代的碳,同时碘离去,发生了环合反应生成产物Ⅲa.
3 结 论
用查尔酮和β-烯胺酯作为原料研究发现了合成多取代二氢吡咯化合物的新方法,通过碘化锌和氯化铁引发发生串联的迈克尔加成和分子内环化反应,得到了目标产物.此方法采用常见的底物和温和的反应条件,为合成功能化二氢吡咯化合物提供了方便的路径.通过控制不同的反应条件如添加剂、溶剂、温度以及投料顺序,在经过条件的筛选和优化后查尔酮和β-烯胺在碘化锌催化下经过氯化铁的氧化得到二氢吡咯环化合物.其中查尔酮与β-烯胺、碘化锌、氯化铁和碳酸钾等物料物质的量比分别为1︰1.2,1︰1.5,1︰1.5,1︰1,二氯乙烷作为溶剂在80 ℃下反应8 h得到二氢吡咯环化合物.在此条件下进行了底物拓展,收率在10%~54%之间.
参考文献:
[1] 韩亮,王滨,唐梁斌.烷基化吡咯并吡咯二酮(DPP)衍生物的合成[J].浙江工业大学学报,2015,43(4):369-373.
[2] 王普,严人,黄金,等.生物拆分制备(S)-α-乙基-2-氧-1-吡咯烷乙酸工艺研究[J].浙江工业大学学报,2014,42(6):640-645.
[3] 袁帅,王普,何军邀.α-乙基-2-氧-1-吡咯烷乙酸乙酯水解酶产生菌发酵培养基的响应面优化[J].浙江工业大学学报,2011,39(5):536-540.
[4] BUSACCA C A,DONG Y. A facile synthesis of 4-aryl-2,3-dihydropyrroles[J]. Tetrahedron letters,1996,37(23): 3947-3950.
[5] KINDERMAN S S,VAN-MAARSEVEEN J H,SCHOEMAKER H E,et al.Enamide-olefin ring-closing metathesis[J]. Organic letters,2001,3(13): 2045-2048.
[6] WENDER P A,STRAND D. Cyclocarboamination of alkynes with aziridines: synthesis of 2,3-dihydropyrroles by a catalyzed formal [3 + 2] cycloaddition[J]. Journal of the American chemical society,2009,131(22): 7528-7529.
[7] FAN J,GAO L,WANG Z. Facile construction of highly functionalized 2-pyrrolines via FeCl3-catalyzed reaction of aziridines
with arylalkynes[J]. Chemical communications,2009(33):5021-5023.
[8] MONGE D,JENSEN K L,FRANKE P T,et al.Asymmetric one-pot sequential organo- and gold catalysis for the enantioselective synthesis of dihydropyrrole derivatives[J]. Chemistry-a european journal,2010,16(31): 9478-9484.
[9] FENG L,GAN Z,NIE X,et al.Highly regioselective synthesis of N-acyl-2,3-dihydropyrrole or N-sulfonyl-2,3-dihydropyrrole derivatives by nano-palladium catalyzed cycloisomerization of 1,6-dienes[J]. Catalysis communications,2010,11(6): 555-559.
[10] LIU C R,ZHU B H,ZHENG J C,et al.Highly diastereroselective synthesis of dihydrofurans and dihydropyrroles via pyridine catalyzed formal [4+1] annulation[J]. Chemical communications,2011,47(4): 1342-1344.
[11] POLINDARA-GARCIA L A,MIRANDA L D. Two-step synthesis of 2,3-dihydropyrroles via a formal 5-endo cycloisomerization of ugi 4-CR/propargyl adducts[J]. Organic letters,2012,14(21): 5408-5411.
[12] MIURA T,TANAKA T,HIRAGA K,et al.Stereoselective synthesis of 2,3-dihydropyrroles from terminal alkynes,azides,and alpha,beta-unsaturated aldehydes via N-sulfonyl-1,2,3-triazoles[J]. Journal of the American chemical society,2013,135(37): 13652-13655.
[13] MARTIN M C,PATIL D V,FRANCE S. Functionalized 4-carboxy- and 4-keto-2,3-dihydropyrroles via Ni(II)-catalyzed nucleophilic amine ring-opening cyclizations of cyclopropanes[J]. Journal of organic chemistry,2014,79(7): 3030-3039.
[14] GUO C,XUE M X,ZHU M K,et al.Organocatalytic asymmetric formal [3+2] cycloaddition reaction of isocyanoesters to nitroolefins leading to highly optically active dihydropyrroles[J]. Angewandte chemie international edition,2008,47(18): 3414-3417.
[15] TIAN J,ZHOU R,SUN H,et al.Phosphine-catalyzed [4 + 1] annulation between alpha,beta-unsaturated imines and allylic carbonates: synthesis of 2-pyrrolines[J]. Journal of organic chemistry,2011,76(7): 2374-2378.
[16] WURZ R P,CHARETTE A B. Doubly activated cyclopropanes as synthetic precursors for the preparation of 4-nitro- and 4-cyano-dihydropyrroles and pyrroles[J]. Organic letters,2005,7(12): 2313-2316.
[17] ZHANG G,ZHAGN Y,JIANG X,et al.Highly enantioslective synthesis of multisubstituted polyfunctional dihydropyrrole via an organocatalytic tandem Michael/cyclization sequence[J]. Organic letters,2011,13(15): 3806-3809.
[18] LI Y,XU H,XING M,et al.Iodine-promoted construction of polysubstituted 2,3-dihydropyrroles from chalcones and beta-enamine ketones(Esters)[J]. Organic letters,2015,17(15): 3690-3693.

