不同脱蜡剂对实时荧光定量PCR检测石蜡块EGFR基因突变结果的影响
徐 帆
(重庆三峡中心医院病理科 40400)
表皮生长因子受体基因(EGFR基因)是非小细胞肺癌((NSCLS)高频驱动基因,先检测、后治疗的NSCLS靶向个体化治疗模式已成为临床诊疗规范。所有接受EGFR靶向酪氨酸激酶抑制剂(EGFR-TK1)治疗的患者都需要接受EGFR分子检测。病理科所开展的石蜡块EGFR基因突变检测法是利用活检组织脱水后制成的石蜡块进行的DNA提取,然后实时荧光定量PCR分析结果,极大地方便了患者,但需确保敏感性和特异性。质量保证和质量控制是关键环节,其中重要的环节包括石蜡块的DNA提取[1],检测中的设备、试剂及实验室的检测环境。目前所有试剂公司在DNA提取的操作规范说明书中均要求对石蜡块切片脱蜡处理时使用二甲苯,但二甲苯具有极强的挥发性,对人体健康有影响。美国劳工部的职业安全与卫生管理处规定二甲苯的安全空气浓度在100 ppm以下,而目前分子实验室的工作环境超出了此安全范围。弥散在空气中的二甲苯可以通过呼吸道吸入或皮肤黏膜接触进入人体,损伤神经系统和血液系统,导致慢性中毒症状。对于空气要求极其严格的分子实验室环境污染大,我国已将二甲苯中毒定为职业病。有研究报道,松节油在病理苏木素-伊红(HE)制片的各个环节均能替代二甲苯,起到很好的效果[2-4],而石蜡块EGFR基因突变检测中石蜡切片DNA提取过程中的脱蜡与HE制片中原理一致。本研究旨在寻找一种既能不影响实时荧光定量PCR结果分析,又能不污染实验室工作环境的方法[5-6],以确保各个环节的质控,现报道如下。
1 材料与方法
1.1材料 从2014年11月起,连续6个月收集本院病理科石蜡标本切片68份,均分成A组(二甲苯脱蜡)和B组(松节油脱蜡)进行石蜡块EGFR基因突变检测。DNA提取试剂盒由QIAGEN生物工程有限公司提供,EGFR突变检测试剂盒由上海源奇生物公司提供,CObasZ480型PCR扩增仪器由罗氏公司提供。
1.2方法
1.2.1石蜡切片制作及脱蜡 标本均经4%中性甲醛固定,常规取材,脱水,石蜡包埋,6 μm厚切片10~15片。将石蜡切片放入1.5 mL离心管中,A组加入1.0 mL二甲苯,B组加入1.0 mL松节油,盖紧并剧烈震荡混匀10 s,然后将标本置于56 ℃水浴中10 min脱蜡,室温(15~25 ℃)下13 200×g离心5 min,吸取上清液丢弃。A组再加入1.0 mL二甲苯,B组再加入1.0 mL松节油,重复上述步骤2~3次,最后1次脱蜡离心10 min(大标本脱蜡2~3次,小标本脱蜡2次)。之后操作步骤严格按QIAGEN试剂盒及上海源奇试剂盒说明书进行。
1.2.2荧光定量PCR检测 扩增条件:42 ℃ 5 min;94 ℃ 3 min,94 ℃ 45 s;60 ℃ 80 s,共40个循环,反应体系共25 μL。在PCR循环第2步60 ℃时收集荧光信号。检测通道为:FAM,参比荧光设定为none。(1)基线的确定:软件默认为3~15个循环的平均荧光信号为基线。在实验中,一般选择曲线波动较小,较稳定的片段作为基线,可根据实际情况自行酌情调整。终点避免覆盖信号已经开始有明显增长的地方,且以起点与终点间间隔8个循环以上为原则。(2)阈值的确定:在阴性对照无扩增的情况下,以阈值设定在无典型扩增曲线样本的最高点,且阴性对照未检出为原则,确定起始阈值。(3)不同的反应液应分别单独确定各自的基线和阈值后,再进行各自分析。
1.2.3实验初期为了确保每次实验的客观性及准确性,每份标本都送上海源奇生物公司总部实验室进行印证实验,结果均相符合。本实验室也在2016年参加了病理质控评价中心(PQCC)分子病理室间质控石蜡块EGFR的检测,顺利通过质评并获得PQCC室间质评证书。
2 结 果
本研究实验中检测时均设立了外部质控和内质控(内参)。外部质控包含阳性及阴性对照,检测结果外部质控的阳性及阴性对照均符合要求;内质控(内参)均在有效范围内,显示检测过程规范、合理、有效。接收的同一标本检测相同的靶点时A、B对照组选取规则的扩增曲线为有效的(疑似阳性标本)读取其CT值,作为对照比较;不规则的扩增曲线为无效的作为阴性处理,不作为对照分析。68份标本中,每份标本A、B两组内质控(内参)CT值均有效,差值均小于0.99,见表1、图1。

表1 检测结果有效性判定(n=68)
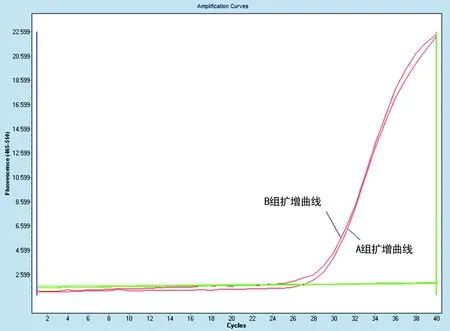
图1 A、B组内质控(内参)扩增曲线比较

A:18号检测靶点;B:19号检测靶点;C:21号检测靶点
图2 A、B组各检测靶点扩增曲线比较
在相同切片标本的18号检测靶点中,A、B两组均有3份疑似阳性标本,两组扩增曲线CT值之差均小于0.99;结合内质控(内参)CT值分析,最终结果判定1份切片标本A、B两组均为阳性,2份切片标本A、B两组均为阴性。在相同切片标本的19号检测靶点中,A、B两组均有7份疑似阳性标本,两组扩增曲线CT值之差均小于0.99;结合内质控(内参)CT值分析,最终结果判定3份切片标本A、B两组均为阳性,4份切片标本A、B两组均为阴性。在相同切片标本的21号检测靶点中,A、B两组均有11份疑似阳性标本,两组扩增曲线CT值之差均小于0.99;结合内质控(内参)CT值分析,最终结果判定6份切片标本A、B两组均为阳性,5份切片标本A、B两组均为阴性。本研究中只检测到18、19、21这3个靶点的阳性结果进行比对,其他的3个靶点未检测到阳性结果。最终结果分析表明同一份切片标本分为A、B两组经不同的脱蜡剂处理后同时实时荧光定量PCR分析,结果无差异,阳性及阴性结果判定相符。A、B组各检测靶点扩增曲线比较,见图2。
3 讨 论
EGFR基因共28个外显子,其中编码酪氨酸激酶的是第18~21号外显子。关于EGFR基因突变的研究表明,尽管突变部位分散整个酪氨酸激酶编码区,但绝大多数突变集中在第19外显子的缺失和第21外显子的L858R点突变。本实验使用的EGFR突变检测试剂盒由上海源奇生物公司提供,检测18、19、20、21、S768I、T790M,共6个靶点,方法简便、快速、准确。进行EGFR基因突变检测时,本研究将每份石蜡切片分入A、B两组,分别用二甲苯和松节油脱蜡处理后[7],同时进行实时荧光定量PCR扩增,探讨两组扩增曲线的差异性,保证EGFR基因突变检测结果判读的客观性和准确性[8-9],同时又为实验室塑造一个良好的工作环境,确保实验操作每一个过程有效合理[10]。分析A、B两组同一份石蜡切片检测相同靶点时有效扩增曲线CT值,以及内质控(内参)CT值之差均小于0.99,最终判定两组阳性、阴性结果均相符,确定采用二甲苯和松节油两种脱蜡剂后实时荧光定量PCR扩增实验结果判读一致,完全相符。本报道旨在研究石蜡块EGFR基因突变检测时使用不同的脱蜡剂后,实时荧光定量PCR扩增曲线形态的相似性,CT值结果比对的差异性,以及最终对实时荧光定量PCR扩增结果相符度的比较。至于在基因突变检测诸多方法中,如荧光原位杂交技术(FISH)和DNA测序,不同的脱蜡剂对结果有无影响则需要进一步的研究。
综上所述,采用二甲苯和松节油对石蜡切片行脱蜡处理后,其实时荧光定量PCR分析结果判读无差异。对于靶点的检测无影响[11-12]。由于二甲苯具有极强的挥发性,对人体健康有一定的影响,而松节油对人体无害,采用松节油脱蜡既保证了分子实验室的空气环境,保护了工作人员的身体,同时又不影响实时荧光定量PCR结果分析的准确性及可靠性[13],可使实验室的操作更加规范、科学、合理。
[1]王伯沄,李玉松,黄高昇,等.病理学技术[M].北京:人民卫生出版社,2000:128-134.
[2]傅春燕,胡康新,肖德胜,等.松节油香味封片剂在HE制片中的应用[J].诊断病理学杂志,2006,13(5):397.
[3]谭俊,符弘枚.松节油型生物制片透明剂在HE制片中的应用[J].国际检验医学杂志,2010,31(8):908-909.
[4]曹晖,胡平,方力.松节油与二甲苯混合液替代单纯二甲苯进行组织透明的实验体会[J].黑龙江医药科学,2000,23(1):70.
[5]杨军.组织标本处理的经济环保流程[J].中国组织工程研究与临床康复,2008,12(46):9015-9017.
[6]韩庆伟,詹彦萍.松节油透明在冰冻切片中的应用[J].实用医技杂志,2007,14(14):1866-1867.
[7]邓昂.病理切片中松节油代替二甲苯脱蜡[J].华中医学杂志,2002,26(5):262.
[8]阙丹,肖何,陈川,等.REDE-DHPL(检测NSCLC血浆EGFR突变及其临床意义[J].重庆医学,2016,45(13):1767-1769.
[9]喻巍,梁剑平,杨德松,等.连续100例肺癌术后 EGFR 基因突变检测结果分析[J].肿瘤药学,2016,6(2):150-153.
[10]罗勇军,刘昕.实时荧光定量PCR标准品的制备及应用[J].重庆医学,2005,34(3):414-415.
[11]王鑫,支修益.2009年非小细胞肺癌靶向治疗新进展[J].中国处方药,2010,8(4):42-44.
[12]王梁燕,洪奇华,张耀洲.实时定量PCR技术及其应用[J].细胞生物学杂志,2004,26(1):62-67.
[13]高云,陈嘉昌,朱振宇,等.EGFR基因突变及其检测方法的研究进展[J].分子诊断与治疗杂志,2011,3(1):51-57.

