中国人群CYP2D6基因多态性及其与激素受体阳性早期乳腺癌他莫昔芬代谢的关系
杨帏 李苏 邓颖斐 何彩云 廖海 魏文文 史艳侠
中山大学肿瘤防治中心肿瘤内科(广州510060)
乳腺癌是女性最常见的恶性肿瘤,大约50%~60%的乳腺癌患者是激素受体(HR)阳性,内分泌治疗是这些患者治疗计划中不可缺少的部分[1-2]。他莫昔芬是绝经前HR阳性患者的标准辅助内分泌治疗[3]。由于中国女性乳腺癌诊断的中位年龄为45~49岁,比白种人年轻10岁[4],他莫昔芬的合理使用对中国乳腺癌患者具有更为现实的意义。但是,TAM的疗效显示出明显的个体差异。到目前为止,我们还没有一个好的标记来预测TAM的疗效。TAM作为一种前体药抗肿瘤作用极弱,它进入人体后需要经过一系列霉作用转化成其活性抗肿瘤成分endoxifen,在过去的10年中,有一些线索表明CYP2D6多态性,可能对霉活性(通过endoxifen/TAM比值间接评估酶活性)有很大影响,导致吲哚昔芬的浓度发生显著变化,并可能与降低他莫昔芬的治疗效果相关。一些回顾性研究描述了患者的CYP2D6基因型和TAM治疗疗效之间的关系,并探讨了使用翻译表或定量活动评分系统预测CYP2D6活性的可能性,以观察具有不同CYP2D6活性患者TAM治疗的疗效和副作用。一些研究得出了不同的结论,CYP2D6基因型在预测TAM疗效中的价值仍然存在争议。
当我们探索CYP2D6的真相时,发现CYP2D6多态性存在显著的种族差异。CYP2D6基因多态性在中国人群中的分布与西方人群差异很大[5]。但我们没有发现他莫昔芬在中国人群和高加索人群中的疗效差异很大。到目前为止,还没有前瞻性临床试验直接证据证明CYP2D6基因型-表型-吲哚昔芬的血药浓度-TAM疗效的关系,特别是在中国人群差异较大的基因型背景下,有必要进行临床研究探讨它们内部的关系及其对我们临床实践的影响。我们分析了临床药物遗传学实施联盟数据库(Clinical Pharmacogenetics Implementation Consortium CPIP)中的数据(https://cpicpgx.org/)以观察CYP2D6等位基因在东西方人群中的分布,并进行前瞻性ⅡC期临床试验以确定中国人群CYP2D6基因型与吲哚昔芬的血药浓度之间的相关性,探索一种改进的基因型-表型预测系统分类方法来预测中国人群中吲哚昔芬的血药浓度差异,并为后续分析TAM的疗效提供科学依据。
1 对象与方法
1.1 研究对象 对2015年8月至2017年10月在中山大学肿瘤防治中心诊治的133例患者行基因型测定;同时检测其中88例患者血药浓度。患者年龄28~58岁,中位年龄为45岁(表1)。接受他莫昔芬治疗的激素受体阳性的绝经前早期乳腺癌患者,包括新诊断的乳腺癌和目前使用TAM治疗<3年的患者。所有患者需要使用他莫昔芬治疗至少40 d才能达到稳态血药浓度。TAM应按固定时间10 mg/d,每12 h 1次口服。本研究不允许进行剂量调整。患者服用药物剂量,用药时间受到严格控制,CYP2D6抑制剂的使用受到限制。纳入标准:ECOG评分≤2,组织学或细胞学证实为早期乳腺浸润性癌(TNM分期Ⅰ~Ⅲ期),激素受体阳性(即在免疫组化方法检测下至少有1%乳腺癌细胞为ER和或PR阳性),术后患者有内分泌治疗指征,拟接受TAM或已经接受不足3年的TAM治疗,预计生存期≥6个月。排除标准:同时接受其他任何抗肿瘤治疗,肝肾功能不全,急性炎症期需治疗,合并其他肿瘤,妊娠或哺乳期患者等。本研究得到中山大学肿瘤防治中心肿瘤医院伦理委员会的批准,所有患者在参加试验前签署知情同意书。
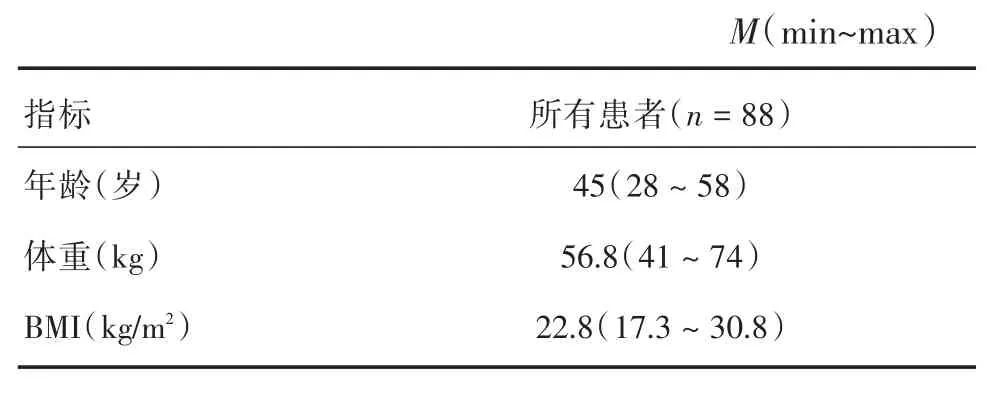
表1 患者的基本情况数据Tab.1 Demographic data for all eligible patients
1.2 CPIP数据资料收集 从CPIP数据库下载CYP2D6基因型、二倍体型、及表型数据,该数据库是通过搜索PubMed®数据库(1995年至2017年8月)汇总后数据。仅保留CPIP数据集中与本研究检测相关的CYP2D6等位基因型病例。对数据进行统计学分析(表2)。
1.3 检测方法
1.3.1 CYP2D6基因型检测 从3 mL全血中提取白细胞DNA,并使用ABI 3500遗传分析仪通过Sanger测序进行分析。根据CYP2D6等位基因的解读标准,我们选择以前在中国人群中报道的最常见的7个等位基因,包括*1、*2、*4、*5、*10、*14和*41。根据基因型预测CYP2D6表型的标准Ⅰ和Ⅱ[6-7]列于表3。
1.3.2 他莫昔芬和代谢物浓度检测 当患者服用他莫昔芬至少45 d时,开始收集血样,3个月内共抽取3次。服用他莫昔芬5.5 h后抽取3 mL静脉血,随后离心上清液。使用HPLC-MS/MS(API 2000)测定方法测量他莫昔芬和吲哚昔芬的血药浓度,使用乙氧基苯甲酰胺作为内标。计算血清中待测药物的浓度并根据标准曲线报告。
1.4 统计学方法 使用SSPS 20.0版本进行分析。P<0.05认为差异有统计学意义。使用百分率描述分类变量,而使用均数±标准差描述定量数据。统计学差异比较采用卡方检验、方差分析(ANOVA)和t检验。
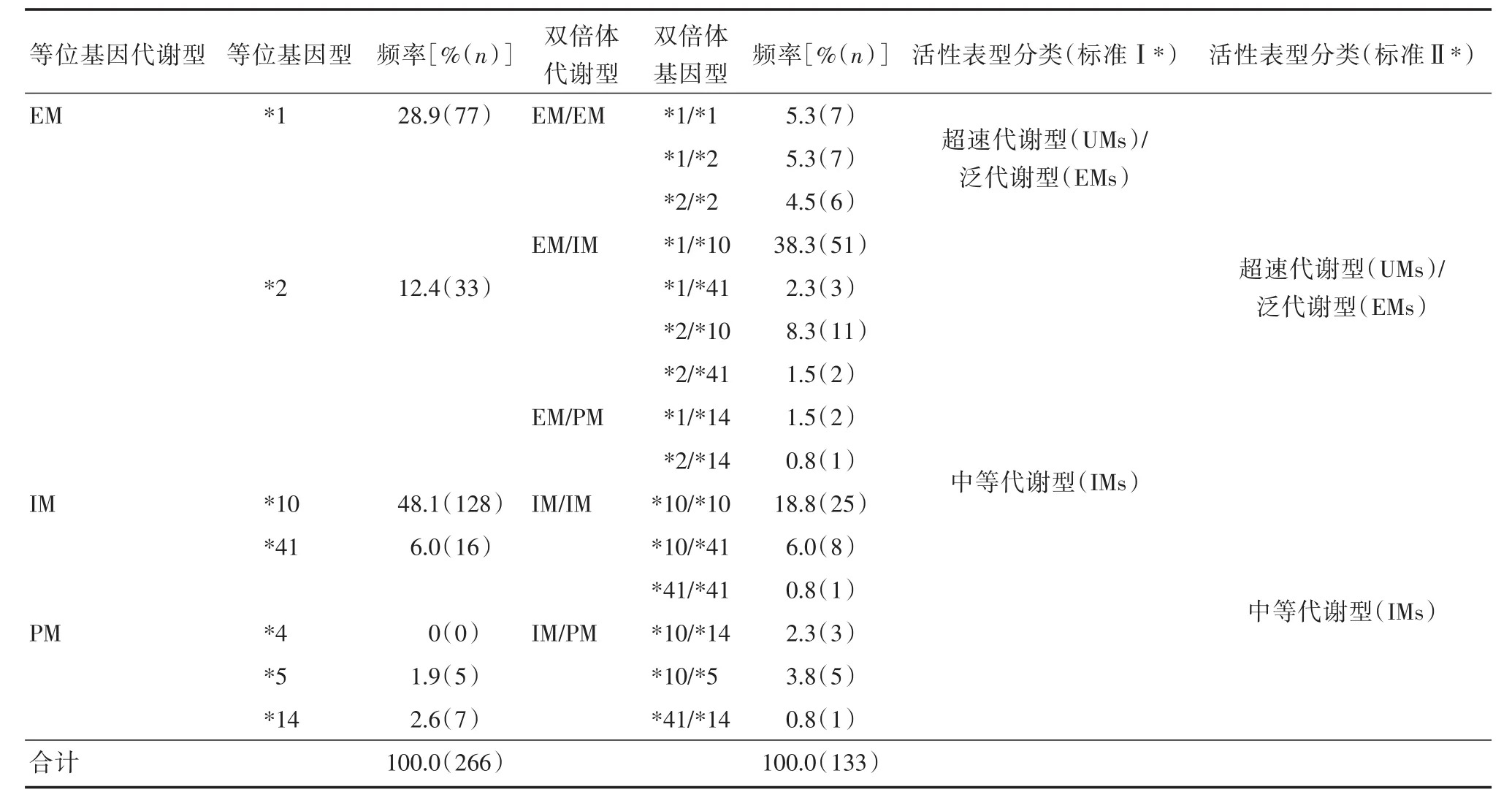
表2 在中国乳腺癌患者中的CYP2D6等位基因频率及基因型分布Tab.2 CYP2D6 allele frequencies and Distribution of CYP2D6 genotypes in Chinese breast cancer patients
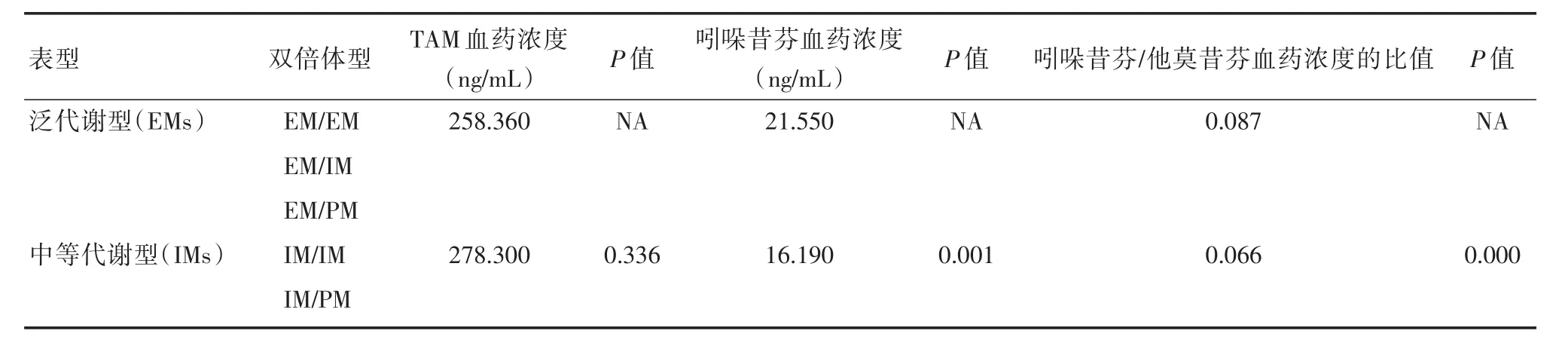
表3 不同代谢表型患者他莫昔芬和吲哚昔芬血药浓度以及吲哚昔芬/他莫昔芬血药浓度的比值差异比较Tab.3 Comparison of endoxifen:tamoxifen ratio and tamoxifen and endoxifen by AmpliChip CYP2D6 expected phenotype
2 结果
2.1 中国人群CYP2D6基因型-表型分布 本研究检测的7种常见CYP2D6等位基因:CYP2D6*1、*2、*4、*5、*10、*14和*41分布频率分别为28.9%、12.4%、0%、1.9%、48.1%、2.6%和6.0%。最常见的二倍体基因型为*1/*10(38.3%)、*10/*10(18.8%),其他二倍体基因型频率均<10%。根据CYP2D6的活性预测标准Ⅰ[6],中间表型IMs占85%,而正常代谢表型EM占15%。根据CYP2D6活性预测标准Ⅱ[7-8],中间表型(IMs)占 40.9%,正常代谢表型EMs占59.1%。本研究没有发现差代谢表型患者(PMs)。见表3。
2.2 CPIP数据库中的CYP2D6基因型-表型分布 根据临床药物遗传学实施联盟数据,高加索与东亚人群的CYP2D6等位基因频率分布有显著差异。CPIP数据中东亚人群的CYP2D6基因型分布与本研究中国人群基本一致,证明本研究基因测试结果是可靠的,并且强有力地保证了后续研究基因型分布与血浆浓度之间关系。
2.3 在各种二倍体、等位基因型中比较他莫昔芬和吲哚昔芬血药浓度以及吲哚昔芬/他莫昔芬血药浓度的比值差异 我们通过检测他莫昔芬和吲哚昔芬血药浓度以及吲哚昔芬/他莫昔芬血药浓度的比值来评估CYP2D6酶的活性。CYP2D6双倍型与年龄、BMI无关(P>0.05)。各二倍体间以及中间表型(EM/IM,EM/PM,IM/IM和IM/PM)间的吲哚昔芬/他莫昔芬血药浓度的比值差异有统计学意义(P=0.01,P=0.007)。
由于本研究中检测到的无功能性等位基因的数目较少,因此我们将它们(*4、*5和*14等位基因)组合到PM组中分析。对于*1、*2、*10、*41、PM等位基因型间吲哚昔芬血药浓度以及吲哚昔芬/他莫昔芬血药浓度的比值差异有统计学意义(P=0.022,P=0.043),见图1。

图1 CYP2D6基因型与血药浓度关系Fig.1 Relationship between selected CYP2D6 genotype groups and serum concentration
当我们按照表型分类标准Ⅰ[6]观察正常代谢表型(EM)与中间表型(IM)之间的差异时,如表1所示,吲哚昔芬浓度以及吲哚昔芬/他莫昔芬血药浓度的比值差异均无统计学意义(P=0.841,P=0.268)。如果我们按照标准Ⅱ对患者进行分组[7-8],正常代谢表型(EM)与中间表型(IM)之间吲哚昔芬血药浓度(P=0.001)和吲哚昔芬/他莫昔芬血药浓度的比值(P=0.000),差异有统计学意义(表3,图2)。
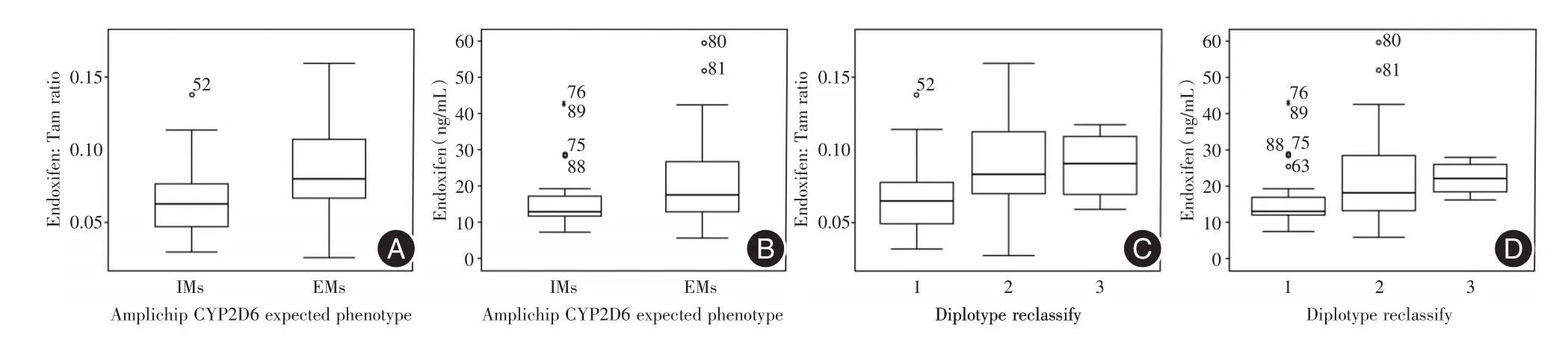
图2 新表型分类体系与传统分类体系比较Fig.2 Comparison between new phenotypic classification system and traditional classification system
2.4 通过聚类分析提出的新表型分类体系比原体系更好地反映CYP2D6活性 通过聚类分析我们将二倍体型重新归类为3组:第1组包括所有除*1等位基因外,两条等位基因均为纯合突变类型;第2组包括所有杂合子,且其中一条等位基因是*1等位基因;第3组为纯合子野生型,即携带两条*1等位基因。3组间吲哚昔芬血药浓度和吲哚昔芬/他莫昔芬浓度的比值差异均有统计学意义(P=0.000)。组1与组2间吲哚昔芬血药浓度差异也有统计学意义(P=0.000)(图2)。
3 讨论
根据本研究和分析CIPI数据库的结果,中国南方乳腺癌患者CYP2D6基因型分布与前期结果一致[9]。目前已发现100多种不同的CYP2D6基因突变[10]。在高加索人群中CYP2D6*4发生率明显高于中国人群,发生率分别为18.17%、0.65%。而中国女性中最常见的CYP2D6等位基因为CYP2D6*10,发生率为51.6%~57.4%,其仅占白种人的5%以下[11-12]。GAEDIGK等[13]根据CYP2D6探针右美沙芬代谢物谱,提出使用“主动评分”方法从基因型推断CYP2D6表型。根据CYP2D6等位基因的不同变异和组合,通过翻译表或定量活性评分将患者分成超快(UMs)、广泛(EMs)、中间(IMs)或差(PMs)代谢的四种代谢表型[13-14]。考虑到中国人群中*10等位基因的突变率及IMs表型的比例较高。使用基因型和活性表型分类系统Ⅰ[6]将正常代谢表型和中间表型进行分组,实际检测到的两组吲哚昔芬血药浓度差异没有统计学意义。值得注意的是,*1和*2单体型间吲哚昔芬血浆浓度差异有统计学意义,且*2等位基因吲哚昔芬血浆浓度与IM等位基因相似,其他研究也有类似报道[15-16]。HERTZ等[15]发现*2等位基因活性与IM等位基因相似。右美沙芬药代动力学研究显示CYP2D6*2与野生型相比具有其约40%的活性[16]。在最近的报道中,*2等位基因可以改变外显子剪接并减少基因表达[17]。在本研究中EM/IM、EM/PM、IM/IM和IM/PM四组间的吲哚昔芬血药浓度和吲哚昔芬/TAM浓度比值的差异是非常大的,此前也有研究报道[15]。显然目前的基因型-表型分类系统对中国人来说并不理想[6]。这种不适当的分组可能是不同表型组间吲哚昔芬浓度没有差异的原因之一。IMs表型组(IM/IM、EM/PM、IM/IM、IM/PM)在中国人群中占有很大的比例,且吲哚昔芬血药浓度范围很广,有必要开发新的基因型-表型分类系统来满足我们的临床需求[8,18-20]。
既往有研究根据另一表型分类系统Ⅱ进行分组[7-8]。本研究也探索了经表型分类系统Ⅱ分组的患者间血药浓度差异,发现在正常代谢和中间表型之间的吲哚昔芬血药浓度和吲哚昔芬/TAM浓度比值存在统计学差异。而进一步根据聚类分析,本研究探索的新的分类方法可能更适合于预测吲哚昔芬血药浓度。但是,仍然有必要扩大样本量来验证新的分类系统的预测价值。
本研究为第一个关于CYP2D6基因多态性的前瞻性研究,也是第一个将CYP2D6基因型与活性代谢产物吲哚昔芬浓度直接联系起来的临床研究。其中服用药物剂量,用药时间,体质指数,肝肾功能,CYP2D6抑制剂的使用等受到严格控制。本研究存在一些局限性。首先,由于UM、PM表型患者的数量很小,我们无法评估这些表型之间的差异。其次,采用Sanger测序的方法进行序列测定,根据文献资料选取最常见的7个等位基因进行分析。非目标等位基因不能被检测到并可能被错误分类。先前的研究报道,一些新发现的功能变异基因[21]2988G>A应该被定义为*41等位基因型,但是这些*41等位基因常常被错误地定义为*2等位基因,导致错误分类。最近的一项研究显示,有24%预测为EM的基因型患者实际上表现为PM表型[22]。这种基因型和表型之间的差异被称为表型转化,引发关于基因分型是否可以准确预测表型的讨论[22-24]。另一项研究表明,CYP2D6基因型只能解释39%的个体吲哚昔芬血药浓度差异性。基于既往和本研究结果,CYP2D6基因型和代谢表型确存在不一致性,单一的CYP2D6基因型是否能准确预测TAM的代谢状态受到质疑,需要进一步研究开发新的CYP2D6表型预测系统指导中国人他莫昔芬治疗。
已有研究人员[25]提出使用治疗药物监测(TDM)作为准确和全面的表型预测的方法,这使得基因分型的价值备受争议。预测TAM表型的药理试验非常复杂,可能受到进食食物和个体间生物利用度等多种因素的影响。近年来,已经提出评估CYP2D6特异性底物及其代谢物的比值,可能比基因分型预测TAM代谢更为准确。本研究结果显示吲哚昔芬/TAM浓度比值是反映CYP2D6酶活性的较敏感和稳定的指标。新的分类系统中,吲哚昔芬/TAM浓度比值在不同组间差异有显著性,提示新系统可能更适合我们的患者分组。
最后,本研究没有考虑其他可能影响他莫昔芬血药浓度的因素[11],我们还没有长期随访观察他莫昔芬的疗效,但是这项研究为进一步研究提供科学依据。
(志谢:王树森,徐飞,袁中玉,王曦和唐军同样对这项研究作出了贡献)
[1]DAVIES C,GODWIN J,GRAY R,et al.Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen:patient-level meta-analysis of randomised trials[J].Lancet,2011,378(9793):771-784.
[2]SCHIAVON G,SMITH I E.Endocrine therapy for advanced/metastatic breast cancer[J].Hematol Oncol Clin North Am,2013,27(4):715-736.
[3]MURDTER T E,SCHROTH W,BACCHUS-GERYBADZE L,et al.Activity levels of tamoxifen metabolites at the estrogen receptor and the impact of genetic polymorphisms of phase I and II enzymes on their concentration levels in plasma[J].Clin Pharmacol Ther,2011,89(5):708-717.
[4]Early Breast Cancer Trialists′Collaborative Group.Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the randomised trials[J].Lancet,2005,365(9472):1687-1717.
[5]ZHOU Q,YU X M,LIN H B,et al.Genetic polymorphism,linkage disequilibrium,haplotype structure and novel allele analysis of CYP2C19 and CYP2D6 in Han Chinese[J].Pharmacogenomics J,2009,9(6):380-394.
[6]SWEN J J,NIJENHUIS M,DE BOER A,etal.Pharmacogenetics:from bench to byte-an update of guidelines[J].Clin Pharmacol Ther,2011 ,89(5):662-673.
[7]SERRANO D,LAZZERONI M,ZAMBON C F,et al.Efficacy of tamoxifen based on cytochrome P450 2D6,CYP2C19 and SULT1A1 genotype in the Italian Tamoxifen Prevention Trial[J].Pharmacogenomics J,2011,11(2):100-107.
[8]HOSKINS J M,CAREY L A,MCLEOD H L.CYP2D6 and tamoxifen:DNA matters in breast cancer[J].Nat Rev Cancer,2009,9(6):576-586.
[9]TEFT W A,GONG I Y,DINGLE B,et al.CYP3A4 and seasonal variation in vitamin D status in addition to CYP2D6 contribute to therapeutic endoxifen level during tamoxifen therapy[J].Breast Cancer Res Treat,2013,139(1):95-105.
[10]LIM HS,J U LEE H,SEOK LEE K,et al.Clinical implications of CYP2D6 genotypes predictive of tamoxifen pharmacoki-netics in metastatic breast cancer[J].J Clin Oncol,2007,25(25):3837-3845.
[11]JIN Y,DESTA Z,STEARNS V,et al.CYP2D6 genotype,antidepressant use,and tamoxifen metabolism during adjuvant breast cancer treatment[J].J Natl Cancer Inst,2005,97(1):30-39.
[12]TEFT W A,GONG I Y,DINGLE B,et al.CYP3A4 and seasonal variation in vitamin D status in addition to CYP2D6 contribute to therapeutic endoxifen level during tamoxifen therapy[J].Breast Cancer Res Treat,2013,139(1):95-105.
[13]GAEDIGK A,SIMON S D,PEARCE R E,et al.The CYP2D6 activity score:translating genotype information into a qualitative measure of phenotype[J].Clin Pharmacol Ther,2008,83(2):234-242.
[14]BORGES S,DESTA Z,JIN Y,et al.Composite functional genetic and comedication CYP2D6 activity score in predicting tamoxifen drug exposure among breast cancer patients[J].J Clin Pharmacol,2010,50(4):450-458.
[15]HERTZ D L,SNAVELY A C,MCLEOD H L,et al.In vivo assessment of the metabolic activity of CYP2D6 diplotypes and alleles[J].Br J Clin Pharmacol,2015,80(5):1122-1130.
[16]ABDULJALIL K,FRANK D,GAEDIGK A,et al.Assessment of activity levels for CYP2D6*1,CYP2D6*2,and CYP2D6*41 genes by population pharmacokinetics of dextromethorphan[J].Clin Pharmacol Ther,2010,88(5):643-651.
[17]WANG D,POI M J,SUN X,et al.Common CYP2D6 polymorphisms affecting alternative splicing and transcription:longrange haplotypes with two regulatory variants modulate CYP2D6 activity[J].Hum Mol Genet,2014,23(1):268-278.
[18]SCHROTH W,GOETZ M P,HAMANN U,et al.Association between CYP2D6 polymorphisms and outcomes among women with early stage breast cancer treated with tamoxifen[J].JAMA,2009,302(13):1429-1436.
[19]REGAN M M,LEYLAND-JONES B,BOUZYK M,et al.CYP2D6 genotype and tamoxifen response in postmenopausal women with endocrine-responsive breast cancer:the breast international group 1-98 trial[J].J Natl Cancer Inst,2012,104(6):441-551.
[20]JOHANSSON H,GANDINI S,SERRANO D,et al.A pooled analysis of CYP2D6 genotype in breast cancer prevention trials of low-dose tamoxifen[J].Breast Cancer Res Treat,2016,159(1):97-108.
[21]WANG D,PAPP A C,SUN X.Functional characterization of CYP2D6 enhancer polymorphisms[J].Hum Mol Genet,2015,24(6):1556-1562.
[22]PRESKORN S H,KANE C P,LOBELLO K,et al.Cytochrome P450 2D6 phenoconversion is common in patients being treated for depression:implications for personalized medicine[J].J Clin Psychiatry,2013,74(6):614-621.
[23]BERM E J,RISSELADA A J,MULDER H,et al.Phenoconversion of cytochrome P450 2D6:the need for identifying the intermediate metabolizer genotype[J].J Clin Psychiatry,2013,74(10):1025.
[24]PRESKORN S H.Dr Preskorn replies[J].J Clin Psychiatry,2013,74(10):1025-1026.
[25]JAGER N G,ROSING H,SCHELLENS J H,et al.Use of dried blood spots for the determination of serum concentrations of tamoxifen and endoxifen [J].Breast Cancer Res Treat,2014,146(1):137-144.

