力竭运动和运动预适应对大鼠心脏跨室壁复极离散度和缝隙连接蛋白43影响的研究
马宏,田攀,,李俊峡,赵峰,王洋,崔英凯,张刚,曹雪滨
运动作为一种刺激因素,可以极大地增加心肌耗氧量,引起短暂的心肌相对缺血或绝对缺血,反复的运动则引起反复短暂的心肌缺血,从而诱导机体产生内源性保护物质,提高心脏耐受缺血缺氧的能力,这种现象称为运动预适应(EP)。力竭运动(EE)则是机体持续运动直至完全不能运动,这不仅会导致心肌的形态结构、生化指标及心脏功能发生病理性改变,还会引起心脏电生理的紊乱。跨室壁复极离散度(TDR)是恶性心律失常的预测指标之一,是心脏性猝死发生的重要机制[1]。心肌缝隙连接蛋白(Cx)中的Cx43,是心室肌的主要构成部分,它的表达和分布改变时缺血性心肌电重构是心律失常的结构基础[2]。因此,本研究初步探讨力竭性运动对心脏跨室壁复极离散度和缝隙连接蛋白43影响,并对运动预适应的保护作用进行研究。
1 资料与方法
1.1 实验动物分组及模型建立 健康雄性SD大鼠80只,2月龄体重(220~250)g,由军事医学科学院实验动物中心提供,动物合格证号:SCXK(京)-2012-004。所有大鼠进行为期5 d的跑台适应性训练(跑台坡度为零,速度为15 m/min,时间为20 min)。适应性训练后随机分为4组:安静对照组(CC组),运动预适应组(EP组)、一次性运动力竭组(EE组)、运动预适应+力竭运动组(EP+EE组)。参照Bedford标准建立一次性力竭运动模型,大鼠在坡度为零的跑台上进行速度为28~30 m/min的跑台持续性运动,直至力竭。EP组大鼠在坡度为零的跑台上进行一次速度为28~30 m/min、每次运动时间为15 min、中间休息时间15 min、重复上述方式共4次间歇运动。EP+EE组大鼠以28~30 m/min速度运动15 min,休息15 min,重复4次,然后重复以28~30 m/min的跑台持续性运动,直至力竭。CC组在完成分组后进行正常喂养参与运动训练。训练方式是采用电流刺激方式(电刺激<1 mA)来督促大鼠进行跑台训练运动。判断力竭状态的标准为: 大鼠伏地式卧于跑道末端,外界刺激不能促使其继续运动。本研究中动物处置方法均符合伦理学标准。
1.2 主要实验试剂 苏木精-伊红(HE)染料(河北博海公司),马森三色复合(Masson’s)染剂(河北博海公司),兔抗总Cx43(Total-Cx43)单克隆抗体(Abcam Trading),兔抗磷酸化的Cx43(P-Cx43)单克隆抗体(Abcam Trading),Alexa Fluor 488标记山羊抗兔IgG(北京中杉金桥公司),小鼠抗三磷酸甘油醛(GAPDH)单克隆抗体(北京中杉金桥公司),荧光二抗(河北博海公司)等。
1.3 检测指标及方法 力竭后开胸取心脏,-80℃液氮冰冻;取左室心肌组织剪碎制备组织匀浆液,冰上裂解30 min后,4℃下离心5 min,吸取上清分装于0.5 ml离心管,-20 ℃保存。
1.3.1 心脏电生理指标的检测 建模成功后,各组大鼠采用10%水合氯醛400 mg/kg进行腹腔麻醉、固定后,用针状电极刺入大鼠皮下记录心电图。对心律失常率、T波峰末间期(Tp-e)、QT间期(QTC)进行记录统计。
1.3.2 心肌组织结构改变 各组大鼠取左室心尖部心内膜下2 mm×1 mm×1 mm大小心肌组织,苏木素-伊红(HE)染色、马森三色复合(Masson’s)染色后分别于光镜和电镜下观察组织病理学改变。
1.3.3 心肌Cx43分布情况 各组大鼠取左室心尖部心内膜下0.5 cm×0.5 cm×0.1 cm大小心肌组织,经固定、脱水、、透明后,石蜡包埋,然后将5 um厚切片附于多聚赖氨酸附膜的载玻片上,于60℃过夜,再经脱蜡、入水,高压修复后用免疫组化笔圈住组织,滴加正常山羊血清封闭液后,分别滴加第一抗体(浓度为1: 70),4℃过夜,PBS清洗,滴加红色荧光标记的第二抗体(IgG),37℃避光,PBS洗后滴加DAPI染色液,避光室温孵育10 min,最后用水溶性封片剂封片,于荧光显微镜下观察。
1.3.4 免疫印迹试验(Western Blot) 检测心肌Total-Cx43和P-Cx43蛋白表达BCA法测定左室心肌组织蛋白浓度,取蛋白样品,加入适量上样缓冲液使其充分变性,十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE),转至聚偏二氟乙烯(PVDF)膜,加入封闭液封闭后,分别用封闭液稀释的兔多克隆抗体Cx43、磷酸化兔多克隆抗体Cx43(1:1000)进行一抗孵育,AlexaFluor488标记山羊抗兔IgG (1:3000)进行二抗孵育。用超敏免疫化学发光试剂盒曝光成像、扫描、软件分析。以GAPDH为内参,结果以目的条带灰度值与内参条带灰度值的比值表示。
1.4 统计学分析 采用统计软件SPSS 19.0进行统计分析,计量资料采用(±s)表示,组间比较采用单因素方差分析,率的比较采用卡方检验,相关性分析采用Pearson相关系数,以P<0.05为差异有统计学意义。
2 结果
2.1 EP对力竭大鼠心室肌跨壁复极离散度的影响鉴于大鼠心室壁薄很难直接用于各种仪器精确测量心室肌跨壁复极离散度,由于心电图T波峰末间期(Tp-e)、QTC临床上在细胞发生机制、细胞电生理基础及其临床应用价值方面均与心肌TDR相匹配,本研究通过计算Tp-e、QTC来反映TDR。EE组、EP组、EP+EE组与CC组相比较,上述几组中的大鼠均可见室性心律失常D的发生,且在EE组的发生率较EP+EE组、EE组明显升高。且与CC组比较,EE组、EP组、EP+EE组大鼠Tp-e、QTC值均明显延长(P<0.05);而与EE组比较,EP+EE组大鼠Tp-e、QTC值均明显缩短(P<0.05)(表1)。
2.2 EP对力竭大鼠心肌结构的影响 CC组(A)大鼠心肌染色均匀、心肌细胞排列整齐、心肌纤维形态结构正常,无心肌细胞肿胀、无间质水肿、无肌膜破损;EE组(D)大鼠心肌染色明显不均,大量心肌纤维断裂、排列无序,间质纤维中度增生、水肿,大量心肌细胞肿胀坏死; EP组(B)、EP+EE组(图C)心肌染色较均匀,断裂的心肌纤维及水肿坏死的心肌细胞较少(图1)。

表1 各组大鼠室性心律失常发生率、Tp-e、QTC值

图1 光镜下观察各组大鼠心肌组织病理学改变(HE染色,400倍光镜)
2.3 EP对力竭大鼠心肌纤维的影响 CC组(A)大鼠心肌细胞间结缔组织(CT)分布较少(Masson’s染色中蓝绿色部分为结缔组织),心肌细胞排列整齐,且心肌细胞紧密。EE组(D)大鼠心室肌细胞排列稀疏、错乱,心肌细胞明显肥大,细胞间结缔组织(CT)较多增生。EP组(B)及EP+EE组(C)大鼠心肌细胞较CC组大鼠心肌顺序排列紧凑,心肌细胞肥大并且细胞表面光滑,但仍有明显CT增生(图2)。

图2 电镜下观察各组大鼠心肌纤维病理学改变(Masson’s染色,400倍电镜)
2.4 EP对力竭大鼠心肌Cx43分布的影响 CC组(A)大鼠心室肌连接蛋白Cx43排列紧密,集中于心肌细胞端端连接处。EE组(D)大鼠缝隙连接蛋白呈现点团状杂乱分布,并且Cx43表达总量降低;EP组(B)、EP+EE组(C)大鼠缝隙连接蛋白Cx43的分布的规律程度居于CC组与EE组之间(图3)。

图3 免疫荧光染色结合激光扫描共聚焦显微镜成像观察各组大鼠心肌Cx43分布情况(红色荧光为细胞膜上Cx43)
2.5 EP对力竭大鼠心肌Total-Cx43及P-Cx43表达的影响 各组大鼠心肌Total-Cx43含量比较,EE组、EP组、EP+EE组均较CC组明显减少,有统计学差异(P<0.05);与EP组相比,EE组、EP+EE两组数量均明显减少,差异有统计学意义(P<0.05);但相比于EE组,EP+EE组数量显著增加,且有统计学差异(P<0.05)(表2)。各组大鼠心肌P-Cx43含量比较,EE组、EP组、EP+EE组均较CC组明显减少,有统计学差异(P<0.05);相比较于EP组,EE组与EP+EE组大鼠心肌P-Cx43量明显减少,有统计学差异(P<0.05);但EP+EE组与EE组之间没有明显差异,无统计学意义(P>0.05)(图4~7)。
2.6 相关性分析 Total-Cx43与Tp-e、Total-Cx43与QTC、P-Cx43与Tp-e、P-Cx43与QTC之间均呈负相关(r=-0.797,-0.831,-0.639,-0.682,P<0.05)(表3)。
3 讨论
适度的运动有利于提高人类的运动能力,对人体的健康也有极大的好处,可促使心脏发生结构和功能的重塑,表现为心肌纤维增粗、毛细血管密度增加,心脏功能储备充足,心肌收缩力增加,即形成“运动员心脏”;但过度的运动则可能使机体受到损失,特别是力竭性运动会导致严重的心脏损伤,称之为力竭性心脏损伤[3,4]。运动性心脏损伤的表现多种多样,表现为心脏形态结构的改变、心肌损伤标志物异常、运动性心律失常、心功能减低、晕厥等,甚至运动性猝死[5]。
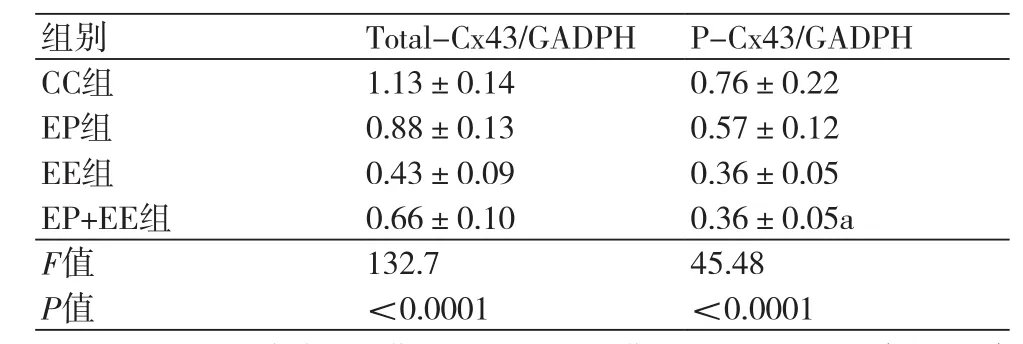
表2 各组大鼠Total-Cx43及P-Cx43表达情况(每组n=20)

图4 各组大鼠心肌Total-Cx43表达比较
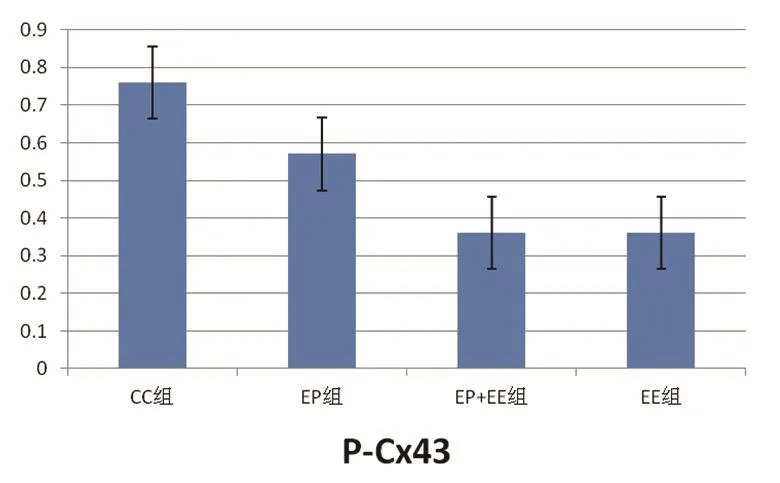
图5 各组大鼠心肌P-Cx43表达比较

图6 蛋白质免疫印迹试验(Western Blot)检测各组大鼠心肌Total-Cx43表达
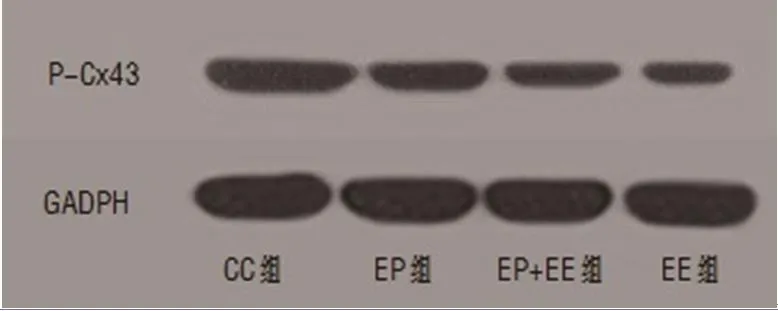
图7 蛋白质免疫印迹试验(Western Blot)检测各组大鼠心肌P-Cx43表达

表3 大鼠Total Cx43与Tp-e、Total Cx43与QTC、P-Cx43与Tp-e、P-Cx43与QTC的相关性分析
近年来相关研究发现,适当的运动具有类似缺血预适应(IP)的保护效应。既往研究资料认为过度的活动可以使得心肌细胞发生缺血,而经过反复多次短暂缺血性运动可以使得心肌细胞对心肌缺血产生耐受,称为运动预适应(EP),它是IP的一种特殊形式[6-9]。
跨室壁复极离散度(TDR)由Antzelevitch在1999年首次报道并提出概念,主要是指心脏心肌内层、中层和心肌外层心肌细胞动作电位时程(APD)时长不均一所造成的心肌复极次序不均一[10,11]。临床出现的多种恶性心律失常(VT、VF、SCD)可能和心室肌的TDR的异常增大有关并成为其一项重要的预测指标[12]。Tp-e、QTC临床上在细胞发生机制、细胞电生理基础及其临床应用价值方面均与心肌TDR相匹配,本研究通过计算Tp-e、QTC来反映TDR[13,14]。
本研究发现,力竭性运动可显著的增加大鼠心律失常发生率,而运动预适应可显著减低力竭运动大鼠的心律失常发生率,这可能与EP缩短了大鼠Tp-e、QTC值,防止了TDR的异常增大,从而维持了心肌的电生理稳态,减少了恶性心律失常的发生。
在不同组织中缝隙连接蛋白的种类、数量、分布状态、功能状态不同,而且同一组织或器官的不同部位,各种缝隙连接的数量、分布状态及功能状态也不一样。其中最重要的是Cx43,它在心脏的心房心室组织中都有分布。既往有研究报道,缝隙连接重构与多种恶性心律失常的发生(如VT,VF,SCD)有着密切关系。Cx43数量异常、分布不均及功能的异常都可以使得心肌细胞间信号传导及电传导耦联能力的异常,进而为触发多种折返性心律失常的发生提供了条件[15-17]。病理条件下心肌细胞可以发生各种表达功能的下降及细胞组织结构的重构,如Cx43 的表达量下降和分布紊乱,是恶性心律失常发生的关键改变之一[18]。
本研究发现,力竭性运动既减少了Cx43的表达量及分布状态,同时也改变了Cx43的磷酸化状态;而EP则可以显著上调力竭性运动中Cx43的表达量及Cx43的磷酸化状态,同时使Cx43在最大程度上保持其在正常生理状态下的应有分布状态,保持心肌的电生理稳态。
在相关性分析中, Total-Cx43与Tp-e、Total-Cx43与QTC、P-Cx43与Tp-e、P-Cx43与QTC之间均呈负相关,有统计学差异,P<0.05。这表明Total-Cx43、PCx43表达量的减少,使得心肌细胞间信号传导及电传导耦联能力的下降,Tp-e、QTC值延长,即TDR异常增大,为多种折返性心律失常的发生创造了条件。
综上所述,力竭性运动可以使心肌细胞电生理失稳态,力竭性运动使心肌缝隙连接蛋白Cx43、磷酸化缝隙连接蛋白Cx43的表达量较基础量减少,且分布状态由端端分布转向侧侧分布,引起心肌细胞电传导失耦联,形成折返,诱发各种心律失常的发生;而EP可显著上调力竭性运动中Cx43的表达量及Cx43的磷酸化状态,同时使Cx43在最大程度上保持其在正常生理状态下的应有分布状态,保持心肌的电生理稳态,减少心律失常的发生,因此,EP在一定范围内对力竭性运动造成的心肌损伤具有一定的保护作用。
[1]王秀琼,洪梅,陈媛,等. 心电图跨室壁离散度变化对预测心血管病临床意义的研究[J]. 医药前沿,2012,2(8):159-60.
[2]黄强辉,胡建新. 心肌缝隙连接蛋白43与心血管疾病的关系[J]. 岭南心血管病杂志,2012,18(1):81-4.
[3]曹雪滨,吴雪宁. 运动性心脏损伤的研究进展[J]. 解放军医药杂志,2016,28(2):1-6.
[4]吴学宁,曹雪滨,李俊峡. 基层官兵运动性心脏损伤的预警与防治[J]. 中国循证心血管医学杂志,2016,8(1):1396-8.
[5]王晓伟,曹雪滨,侯聪聪,等. 某战区作训人员力竭性心脏损伤的临床研究[J]. 中国中西医结合急救杂志,2013,20(5):270-4.
[6]Kavazis AN. Exercise preconditioning of the myocardium[J]. Sports Med,2009,39(11):923-35.
[7]Starnes JW,T aylor RP. Exercise-induced cardioprotection:endogenous mechanisms[J]. MedSci Exerc,2007,39(9):1537-43.
[8]Powers Sk,Quindry JC,Kavazis AN. Exercise-induced cardioprotection against myocardial ischemia-reperfusion injury[J].Free RadicBiol Med,2008,44(2):193-201.
[9]Brown DA,Moore RL. Perspectives in innate and acquired cardioprotection: cardioprotection acquired through exercise[J]. J Appl Physiol,2007,103(5):1894-9.
[10]Antzelevitch C. Heterogeneity and cardiac arrhythmias: an overview[J].Heart Rhythm,2007,4(7):964-72.
[11]CastroHevia J,Antzelevitch C,TornesBarzaga F,et al. Tpeak-TendandTpeak-Tend dispersion as risk factors for ventricular tachycardia /ventricular fibrillation in patients with the Brugada syndrome[J]. AmCollCardiol,2006,(47):1828-34.
[12]李晓君,柳丽萍,杨淑英. PCI对急性心肌梗死患者窦性心率震荡和QT离散度的影响[J]. 江苏实用心电学杂志,2011,20(2):121-2.
[13]程宏勇,张钲,白锋. 室速发作与T波峰-末间期的关系[J]. 临床心电学杂志,2006,15(1):16-8.
[14]张永利. 急性冠脉综合征患者PCI前后心室肌跨壁复极离散度指标的变化[J]. 临床心身疾病杂志,2015,21(4):23-5.
[15]Saffitz JE,Green KG,Kraft WJ,et al. Effects of diminished expression of connexin 43 on gap junction number and size in ventricular myecardium[J]. AJP-Heart and Circulatory Physiology,2000,278(S):H1662-70.
[16]Michael A,Beardslee,Deborah L,et al. Dephosphorylation and intracellular redistribution of ventricular connexin43 during electrical uncoupling induced byischemia[J]. Circ Res,2000,87:656-62.
[17]王荣,张存泰,阮燕菲,等. 大鼠心肌急性缺氧缝隙连接蛋白43磷酸化水平的改变及心律失常肽10对其影响[J]. 临床心血管病杂志,2007,5(23):375-8.
[18]Wang Y, Hill JA. Electrophysiological remodeling in heart failure[J].Mol Cell Cardiol,2010,48:619-32.

