结节性肺淀粉样变一例
程雪 方泓
淀粉样变性不是一种常见的疾病,其特点是细胞外异常纤维蛋白质沉积造成组织器官结构和功能改变。结节性肺淀粉样变罕见,现将我院收治的1例报道如下:
一、临床资料
患者,女,65岁,退休人员,因反复咳嗽半年,伴胸闷1周于2016年12月26日来我院就诊。半年前患者间断性的出现咳嗽,干咳为主,偶有白痰,曾自行口服消炎药,症状能缓解,但症情反复。入院1周前患者受凉后咳嗽加重,咯白色黏痰,伴胸闷,无胸痛、发热、咳血、恶心、呕吐等症状,遂来我院就诊。患者既往有高血压病史10余年,最高血压180/120 mmHg,口服苯磺酸氨氯地平片5 mg qd,血压控制尚可。否认有结核、肿瘤、慢性支气管炎、传染病等病史。无吸烟史。查体:体温36.5 ℃,脉搏86次/min,呼吸20次/min,血压140/85 mmHg,双肺呼吸音稍粗,可闻及散在的细湿啰音,心脏、腹部及下肢神经系统检查未见明显异常,浅表淋巴结未触及肿大。
实验室检查:血常规:白细胞12.42×109/L,中性粒细胞%88.3%,淋巴细胞%8.2%,嗜酸性粒血细胞%0.0%。生化检查:ALT、AST正常,直接胆红素7.0 μmol/L,白球比1.1,葡萄糖7.1 mmol/L,钙2.2 mmol/L。肿瘤标志物、结核杆菌、痰培养及咽拭纸培养未见异常,心电图及心脏超声正常。胸部CT提示:左肺下叶有一结节样高密度影,直径约16×12 cm,边界不规则,未见明显空洞,见图1。初步诊断:左肺下叶结节,恶性待排。
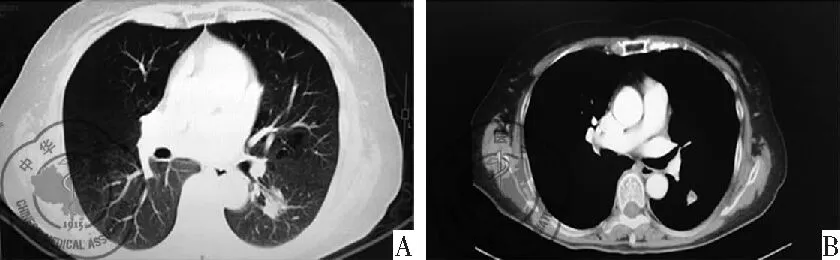
图1 胸部CT提示左肺下叶有一结节样高密度影,直径约16×12 cm,边界不规则,未见明显空洞
患者有手术指征,术前检查排除手术禁忌,于2016年12月29日全麻下行“剑突下胸腔镜左肺下叶切除术”,手术顺利,失血少,未输血。病理大体:左下叶16×12×4 cm,切面见一灰白灰红色结节:①2.0×1.5 cm,界清,质硬,局部近胸膜,灰白色结节;②1.0×0.7 cm,界不清,质中,局部近胸膜。病理学结论:①(左下叶)结节,②胶原纤维增生伴骨化生,见均质红染物质沉积伴异物巨细胞反应,见浆细胞及淋巴细胞浸润,倾向结节性淀粉样物沉积症。切缘:未见特殊性病变,第7.10.11组淋巴结:慢性炎。免疫组化结果:刚果红(-),特殊染色结果:抗酸(-),网染(-),PAS(-),六氨银(-),消化PAS(-)。术后恢复良好,出院后建议增加饮食补充营养,积极术后活动。术后2个月,患者咳嗽、胸闷症状消失。
讨 论
结节性肺淀粉样变比较罕见,其发病机理和病因尚不明确,往往好发于老年患者中,多在影像检查或尸检时发现[1]。表现为肺内单发或多发结节,以两肺下叶多发,50%的案例可见钙化或骨化[2]。根据其病例类型,将肺淀粉样变性分为血管型、结节性支气管型、结节性肺实质型、弥漫性肺泡间隔型、胸膜型;其影像学类型分为单节结型、多结节型、粟粒性、肺间质弥漫型4型[3]。本例患者属于结节性实质型肺淀粉样变。该病单凭放射学检查难以与恶性或良性肿瘤或炎症病变相区分,为明确诊断,经皮细针穿刺细胞学检查和CT引导下的活组织检查都是相对无创性的方法,但是无法区分结节性肺淀粉样变和肿瘤产生淀粉样物质。因此需要进行手术切除病变获得一个满意的结果。手术切除后孤立肺结节性淀粉样变的复发率很低,是最佳的治疗选择[4]。
结节性淀粉样变沉积物可能与囊肿相关,其发病机制可能是空气阻塞和淀粉样蛋白沉积引起肺泡壁缺血破坏[5-7],而结节性淀粉样变合并薄壁囊肿在干燥综合征的患者中最常见[8-10]。该患者既往无任何结缔组织疾病。
结节性肺淀粉样变临床上很难诊断,主要应与恶性或良性的原发性肺肿瘤相鉴别,由于各自的临床表现不同,且缺乏明确的影像特征,很难将它们区分开来。病理刚果红染色是确诊的金标准,正电子发射计算机断层扫描(PET)也有助于鉴别[11-13],然而这种方法较局限,很难将肺肿瘤和淀粉样变性区分开来[14]。该例患者手术前曾考虑为肺肿瘤或结节性肉芽肿,然而手术后的病理结果提示为结节性肺淀粉样变,并且术后症状改善,恢复良好。因此,正确诊断结节性淀粉样变是必要的,这决定患者的进一步治疗和预后。
参 考 文 献
1 Hui AN, Koss MN, Hochholzer L, et al. Amyloidosis presenting in the Lower respiratory tract: Clinincopathologic, radiologic, immunohistochemical, and histochemical studies on 48 cases[J]. Arch Pathol Lab Med, 1986, 110(3): 212-218.
2 Lee AY, Godwin JD, Pipavath SN. Case:182: pulmonary amyloidosis [J]. Radiology, 2012, 263(3): 929-932.
3 范小红, 车向宏. 原发性支气管淀粉样变性1例报告[J]. 山东医药, 2011, 51(2): 103.
4 Eguchi T, Yoshida K, Kobayashi N, et al. Localized nodular amyloidosis of the lung[J]. Gen Thorac Cardiovasc Surg, 2011, 59(10): 715-717.
5 Kim HY, Im JC, Song KS, et al. Localized amyloidosis of the respiratory system: CT features[J]. J Comput Assist Tomogr, 1999, 23(4): 627-631.
6 伍安, 李玉英, 吴国明. 原发性气管支气管肺淀粉样变1例[J]. 第三军医大学学报, 2013, 35(5): 389-389.
7 张波, 姚国忠, 陈林桂, 等. 原发性气管支气管肺淀粉样变1例并文献复习[J]. 临床肺科杂志, 2014(8): 1547-1548.
8 Aylwin AC, Gishen P, Copley SJ. Imaging appearance of thoracic amyloidosis[J]. J Thorac Imaging, 2005, 20(1): 41-46.
9 Desai SR, Nicholson AG, Stewart S, et al. Benign pulmonary lymphocytic infiltration and amyloidosis: computed topographic and pathologic features in three cases[J]. J Thorac Imaging, 1997, 12(3): 215-220.
10 周丽, 忻霞菲, 吴华香, 等. 原发性干燥综合征继发支气管肺淀粉样变一例并文献复习[J]. 中华风湿病学杂志, 2012, 16(6): 398-401.
11 Noordzij W, Glaudemans AW, van Rheenen RW, et al. Additional diagnostic value of SPECT/CT to planar Inodine-123 labeled serum amyloid P component scintigraphy in a patient with pulmonary nodular amyloidosis[J]. Amyloid, 2014, 21(2): 131-133.
12 Shouichi O, Shinsaku T, Ichiro N, et al. Lung adenocarcinoma expressing receptor for advanced glycation end-products with primary systemic AL amyloidosis: a case report and literature review[J]. BMC Cancer, 2017, 17: 22.
13 Nobata H, Suga N, Itoh A, et al. Systemic AA amyloidosis in a patient with lung metastasis from renal cell carcinoma[J]. Amyloid, 2012, 19(4): 197-200.
14 Miyazaki D, Yazaki M, Ishii W, et al. A rare lung nodule consisting of adenocarcinoma and amyloid deposition in a patient with primary systemic AL amyoidsis[J]. Intern Med, 2011, 50(3): 243-246.

