马铃薯格瓦斯工艺技术研究
张博,肖世娣,李艺凡,赵璐,薛逸轩,王菁,张惠玲,*
(1.宁夏大学宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川750021;2.宁夏大学农学院,宁夏银川750021)
马铃薯是我国当前最具发展前景的高产粮食作物之一[1]。国家提倡加大马铃薯深加工产品,提高附加值[2-3]。宁夏是我国重要的马铃薯生产地之一,马铃薯产业是宁夏优势特色农产品加工产业中的重点支持产业,宁夏马铃薯具有品种优良、加工风味好、淀粉含量高等优势[4-7]。开展马铃薯深加工研究对带动宁夏马铃薯产业具有重要意义。
本文以宁夏固原产地的马铃薯为主要原料开发马铃薯格瓦斯产品,并对其发酵工艺进行研究,为宁夏马铃薯资源深加工提供一条新思路。
1 材料和方法
1.1 材料与设备
1.1.1 材料
青薯9号马铃薯:宁夏固原;Vinozym牌果胶酶(7500PGNU/g)、淀粉酶(α-淀粉酶,活性酶蛋白<5%)、糖化酶(活性酶蛋白20%~30%):诺维信(中国)生物技术有限公司;纤维素酶(酶活≥7000 U/g):宁夏夏盛实业集团有限公司;蛋白酶(酸性蛋白酶,活性50000 U/g以上):Beijing Solarbio Science&Technology Co.,Ltd.;啤酒酵母(Pop):法国诺盟集团有限公司;乳酸菌(Lactobacillusbulgaricus,Streptococcusthermophilus):北京川秀科技有限公司1.0L型。
1.1.2 仪器设备
HHS型电热恒温水浴锅:上海博讯实业有限公司医疗设备厂;LRH-150B型恒温培养箱:广东泰宏君科学仪器股份有限公司;RZ-988T型打浆机:深圳五联通达科技有限公司;TL90T型手持折光仪:上海天垒仪器仪表有限公司;雷诺PHSJ-3F型实验室pH计、INESAL5型紫外可见光检测器:上海仪电分析仪器有限公司;AL204型分析天平:梅特勒-托利多国际贸易(上海)有限公司;锥形瓶;25 mL密度瓶;20 mL顶空瓶。
1.2 检测方法
酒精的测量:密度瓶法(GB/T 4928-2008《啤酒分析方法》)。
可溶性固形物的测量:折射仪法测量(NY/T2637-2014《水果和蔬菜可溶性固形物含量的测定折射仪法》)。
pH值测量:pH计测定(GB 5009.237-2016《食品安全国家标准食品pH值的测定》)。
菌落总数的测定:平板计数法(GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》)。
大肠菌群的测定:MPN计数法(GB 4789.3-2016《食品安全国家标准食品微生物学检验大肠菌群计数》)。
吸光度值(Abs)测量:紫外可见光检测器于450 nm波长下,以蒸馏水做参比,测定样品的吸光度值。
酸度(以乳酸计)测量采用酚酞指示剂法:吸取5 mL样液,加入50 mL煮沸并冷却至室温的蒸馏水,加入2~3滴酚酞指示剂,以0.1 mol/L NaOH标准溶液滴定至微红色,30 s不褪色为终点,记下消耗NaOH标准溶液的毫升数A,计算酸度(以乳酸计)[8]。
酸度(以乳酸计)/%=[(0.1×A×0.09)/5]×100
还原糖测定:DNS法(3,5-二硝基水杨酸法)[9]。
1.3 感官品评方法
感官评分标准见表1。

表1 感官评分标准Table 1 Sensory scoring criteria
2 方法
2.1 工艺流程
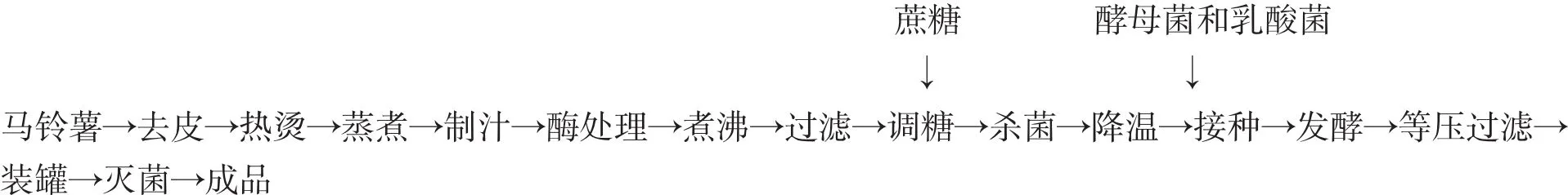
2.2 操作要点
2.2.1 原料预处理
2.2.1.1 料水比的确定
选取无霉烂、无发芽、无病虫害的鲜马铃薯去皮切丁,在含有0.2%的柠檬酸水溶液中95℃热烫5 min护色后取出。分别采用 1∶2、1∶3、1∶4、1∶5、1 ∶6(g/mL)的料水比[10-11]制汁,并煮沸15 min~20 min,分别取样测定可溶性固形物含量及还原糖含量,确定最佳料水比。
2.2.1.2 酶最适添加量的确定
在1∶4(g/mL)料水比的马铃薯汁的条件下,分5组分别设计添加不同量[10]的淀粉酶、糖化酶、果胶酶、蛋白酶、纤维素酶的试验,测定还原糖含量或吸光度值以确定酶的最适添加量。
2.2.1.3 马铃薯汁成分调整
根据产品的要求,酒精度达到0.8%vol,残糖达到192 mg/L;因此将按照2.2.1.2中的酶解条件处理好的马铃薯汁的糖度调整为300 mg/L;过滤,并用食用级柠檬酸调整pH值为5.3[12],然后采用121℃,高压蒸气灭菌20 min,待冷。
2.2.2 发酵
取冷却后的马铃薯汁接种混合菌0.3%,在28℃下发酵,采取间歇式密闭发酵,使发酵液压力保持在30 kPa,保证CO2含量大于0.26%。以残糖达到192 mg/L,酒精度达到0.8%vol左右时为终止发酵条件,巴氏灭菌终止发酵。
取以上发酵好的马铃薯格瓦斯,在30 kPa~40 kPa[12]的压力下,对发酵液进行过滤并灌装,然后立即进行巴氏杀菌。
2.3 发酵条件的单因素试验
2.3.1 接种比例的确定
乳酸菌可以使马铃薯格瓦斯风味更好,香气浓郁[13],为了增加马铃薯格瓦斯风味,采取酵母菌和乳酸菌混合发酵。采用1∶4的料水比,糖度为300 mg/L,pH值为5.3、接种量为0.3%,在28℃下发酵,制备马铃薯汁 5份,分别按照酵母菌和乳酸菌 1 ∶1、1 ∶1.5、1∶2、1 ∶2.5、1 ∶3 的质量比接种混合菌[8,14-15],当达到终止发酵条件时终止发酵,测定酒精和乳酸含量,确定最佳比例。
2.3.2 混合菌接种量的确定
采用 1∶4(g/mL)的料水比,糖度为 300 mg/L,pH 值为5.3的条件下,制备马铃薯汁5份,分别按照0.1%、0.2%、0.3%、0.4%、0.5%[16]的接种量接种质量比为1∶2的酵母菌和乳酸菌,在28℃的温度下发酵,当达到终止发酵条件时终止发酵,测定酒精含量、乳酸含量和感官品质。
2.3.3 发酵温度的确定
在1∶4(g/mL)的料水比下制备马铃薯汁5份,糖度为300 mg/L,pH值为5.3,灭菌冷却后按照酵母菌和乳酸菌1∶2的质量比接种,接种量0.5%进行发酵,分别在24、27、30、33、36 ℃的温度[17]下发酵。当达到终止发酵条件时终止发酵,测定发酵液的酒精含量、乳酸含量、还原糖含量和感官品质。
2.3.4 发酵时间的确定
在1∶4的料水比糖度为300 mg/L,pH值为5.3,灭菌冷却后按照酵母菌和乳酸菌1∶2的质量比接种,接种量 0.5%,28 ℃下进行发酵,在 0、12、16、20、24、28、32、36 h 时[18]取样测定,当酒精度达到 0.8%vol左右,残糖达到192 mg/L时,确定为最佳终止发酵时间。
2.4 发酵条件优化试验
在以上单因素试验结果的基础上综合分析,设计发酵菌种接种量、发酵温度、发酵时间和添加比例,四因素三水平的正交试验L9(34),进一步确定最佳发酵工艺参数。综合以上单因素试验的试验结果进行分析,正交试验因素水平表见表2。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal test
3 结果与分析
3.1 原料预处理条件确定
3.1.1 料水比的确定
料水比对马铃薯汁的影响见表3。
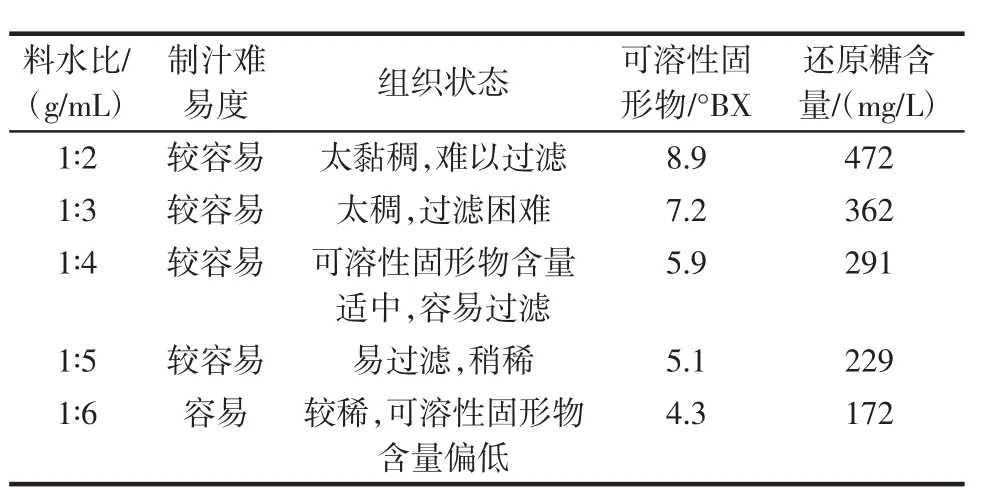
表3 料水比对马铃薯汁的影响Table 3 Effect of ratio of material to water on potato juice the
由表3看出,料水比为1∶4(g/mL)时对马铃薯汁的可溶性固形物和还原糖含量适中,而且容易过滤。
3.1.2 酶最适添加量确定
3.1.2.1 淀粉酶
不同淀粉酶添加量下马铃薯汁的显色反应见表4。

表4 不同淀粉酶添加量下马铃薯汁的显色反应Table 4 Color reaction of potato juice with different amylase adding amount
当淀粉酶的添加量在0.10%时,马铃薯汁的淀粉显色反应出现碘液本身的浅棕色,说明此时马铃薯汁中淀粉已全部被淀粉酶分解,故淀粉酶的添加量应为0.075%。
3.1.2.2 糖化酶
不同糖化酶添加量对马铃薯汁还原糖的影响见表5,不同糖化酶添加量对马铃薯汁可溶性固形物的影响见图1。

表5 不同糖化酶添加量对马铃薯汁还原糖的影响Table 5 Effects of different glucoamylase adding amount on reducing sugar in potato juice
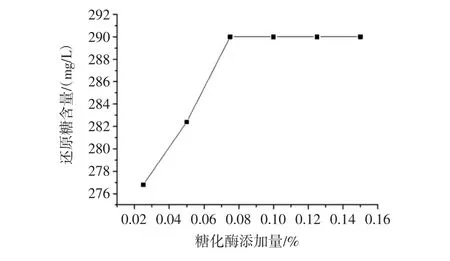
图1 不同糖化酶添加量对马铃薯汁可溶性固形物的影响Fig.1 Effect of different glucoamylase adding amount on soluble solids content in potato juice
综合表5和图1可知,糖化酶添加量从0.10%起还原糖含量为290 mg/L且不再发生变化,故糖化酶添加量选择0.10%。
3.1.2.3 果胶酶
果胶酶的添加量对马铃薯汁吸光度值的影响见图2。
由图2看出,随着果胶酶添加量的增加,在60 mg/L时吸光度值趋于平稳,因此选择60 mg/L为果胶酶的最适添加量。
3.1.2.4 蛋白酶
蛋白酶的添加量对马铃薯汁吸光度值的影响见图3。
由图3看出,随着蛋白酶添加量的增加,曲线在蛋白酶添加量为110 mg/L时出现拐点后趋于平稳,因此选择110 mg/L为蛋白酶的最适添加量。

图2 果胶酶的添加量对马铃薯汁吸光度值的影响Fig.2 Effect of pectinase adding amount on absorbance value of potato juice

图3 蛋白酶的添加量对马铃薯汁吸光度值的影响Fig.3 Effect of protease adding amount on absorbance value of potato juice
3.1.2.5 纤维素酶
纤维素酶的添加量对马铃薯汁吸光度值的影响见图4。

图4 纤维素酶的添加量对马铃薯汁吸光度值的影响Fig.4 Effect of cellulase adding amount on absorbance value of potato juice
由图4看出,当纤维素酶添加量在50 mg/L时,吸光度值达到最低,再增大酶的添加量,使过多的纤维素酶颗粒存在,出现吸光度升高的现象,表明吸光度值在最低点时纤维素酶添加量最佳。
3.2 单因素试验结果
3.2.1 最佳接种比例
接种比例对马铃薯格瓦斯发酵的影响见表6。

表6 接种比例对马铃薯格瓦斯发酵的影响Table 6 Effect of inoculation proportion on potato kvass fermentation
按照产品要求,当残糖达到192 mg/L时终止发酵。由表6看出,酵母菌和乳酸菌接种比例在1∶2时,乙醇和乳酸含量适中,口味协调,酸甜适中,香气柔和,杀口感好。
3.2.2 最佳接种量
菌种接种量对马铃薯格瓦斯发酵的影响见表7。

表7 菌种接种量对马铃薯格瓦斯发酵的影响Table 7 Effect of inoculation amount of bacteria on potato kvass fermentation
从表7可以看出,发酵终止时,接种量在0.3%时,乳酸、酒精、残糖含量达到了一个协调值,香气和口感都达到一个最佳平衡状态,且具有较好的CO2杀口感。
3.2.3 最佳发酵温度
发酵温度对马铃薯格瓦斯发酵的影响见表8。
从表8可以看出,发酵温度高时,有利于乳酸菌产生乳酸[19];发酵温度在27℃时有利于酵母产生乙醇,乳酸菌在此温度下缓慢产生乳酸,当达到发酵终止要求时,马铃薯格瓦斯酸甜适中,乙醇和乳酸含量合适,口感柔和且有杀口力。

表8 发酵温度对马铃薯格瓦斯发酵的影响Table 8 Effect of fermentation temperature on potato kvass fermentation
3.2.4 最佳发酵时间
发酵时间对马铃薯格瓦斯发酵的影响见表9。

表9 发酵时间对马铃薯格瓦斯发酵的影响Table 9 Effect of fermentation time on potato kvass fermentation
当发酵时间在16 h~20 h时,当残糖达到192 mg/L,酒精也达到产品要求,而且整体感官评分较高,且与产品质量指标中要求较为接近,确定为最佳发酵时间。
3.3 发酵条件优化
发酵条件优化结果见表10、表11、表12。
以上4个指标单独分析出来的优化水平不一致,对于因素A,其对还原糖含量和感官评分的影响都排在第二位,且此时都取A1,故A因素取A1;对于因素B,其对酒精含量、乳酸含量和感官评分的影响都排第一位,且此时都取B1,故B因素取B1;对于因素C,其对还原糖含量排在第一位,且此时取C3,故C因素取C3;对于D因素,其对酒精含量的影响排第二位,此时取D1,其对乳酸含量的影响排在第二位,此时取D2。赵晓指出,从格瓦斯的感官整体接受度来看,酵母菌∶乳酸菌达到1∶2时,格瓦斯的整体接受度较高[15,20]。故D因素取D2。综上所述,马铃薯格瓦斯发酵过程中的最优条件为A1B1C3D2,即最佳菌种接种量为0.3%,最佳发酵温度为26℃,最佳发酵时间为20 h,最佳菌种接种比例酵母∶乳酸菌为1∶2。
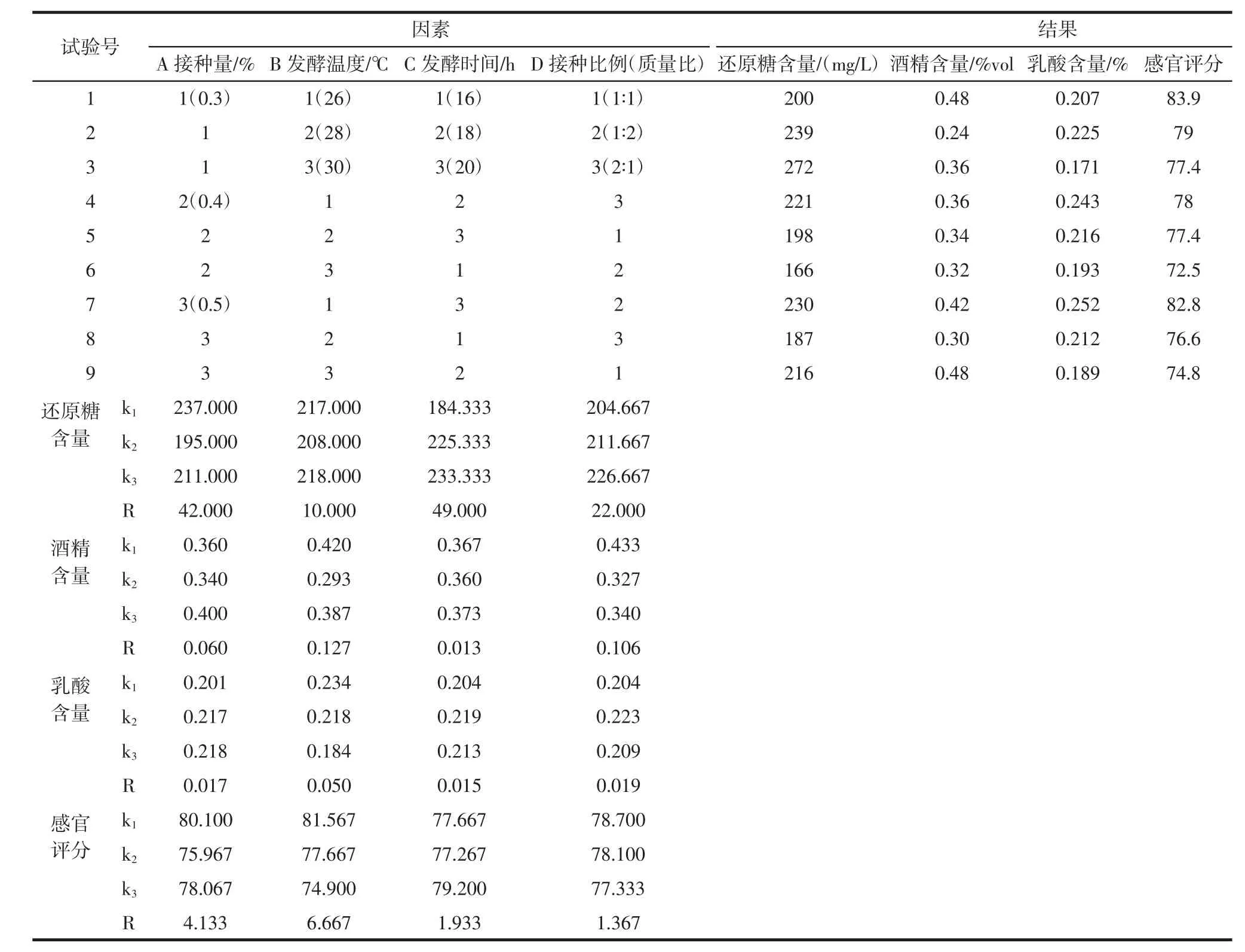
表10 发酵条件四因素三水平正交发酵条件对马铃薯格瓦斯发酵的影响验结果分析Table 10 Orthogonal experimental results analysis of four factors and three levels of fermentation conditions

表11 因素主次顺序Table 11 The order of the primary and secondary factors

表12 优化水平组合Table 12 Optimize level combinations
3.4 产品质量指标
3.4.1 理化指标
理化指标见表13。

表13 马铃薯格瓦斯理化指标Table 13 Physical and chemical indexes of potato kvass
3.4.2 感官指标
外观:橙黄色,澄清透亮,无明显的悬浮物、沉淀物;口感:入口清新爽口,酸甜适中,有杀口感;滋气味:具有典型的马铃薯香及协调的发酵香。
3.4.3 微生物指标
细菌总数≤53CFU/mL;大肠菌群≤3 MPN/100 mL;致病菌:未检出。
4 结论
马铃薯格瓦斯的发酵最佳工艺参数为马铃薯制汁的料水比为1∶4(g/mL),淀粉酶、糖化酶、蛋白酶、果胶酶、纤维素酶的最佳添加量分别为0.075%、0.10%、110 mg/L、60 mg/L、50 mg/L。发酵最适条件为:发酵菌种接种量为0.30%,其中酵母菌和乳酸菌接种量比例为1∶2,发酵温度为26℃,发酵时间为20 h。发酵期间采取间歇式密闭发酵,使发酵液压力保持在30 kPa,保证CO2含量大于0.26%。根据以上最佳工艺参数,获得了口感协调的马铃薯格瓦斯产品。
[1]李天佑.“第二面包”.马铃薯[J].中国食品,1993(2):44-45
[2] 李子涵,杨晓晶.世界及中国马铃薯产业发展分析[J].中国食物与营养,2016,22(5):5-9
[3]Sloan AE.Top 10 trends to watch and work on:2003[J].Food Tech nology,2003,57(4):30-32
[4]吴利晓.不同栽培方式和种植密度对马铃薯产量及品质的影响[D].银川:宁夏大学,2016
[5] 者金兰,景治忠,于仙萍,等.全膜双垄覆盖沟播栽培条件下马铃薯品种比较研究[J].宁夏农林科技,2013,54(9):37-38
[6] 朱玉君.西吉县推广优质专用型马铃薯新品种[J].中国农业信息,2012(11):46-46
[7]毛玉乾.干旱区马铃薯品种比较试验[J].宁夏农林科技,2013,54(12):7-8,12
[8] 涂强,康宁,冬梅,等.甘薯格瓦斯饮料工艺条件的研究[J].中国酿造,2008,27(21):93-96
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:211-213
[10]刘庆庆,束俊霞,李刚凤,等.马铃薯饮料酶解工艺的优化[J].安徽农学通报,2017,23(17):122-124
[11]韩占江,王伟华,李建宁.马铃薯奶饮料制作条件优化研究[J].广东农业科学,2009(9):133-135
[12]武国栋.工业化生产PET格瓦斯饮料的研究[J].饮料工业,2006(7):16-17
[13]徐速,刘复军,梁金钟,等.工业化生产格瓦斯的研究[J].生物技术,1997(4):44-48
[14]汤丽华,张惠玲,刘敦华.发酵型土豆汁饮料的工艺研究[J].饮料工业,2009,12(9):11-14
[15]赵晓.格瓦斯酵母菌株筛选及发酵工艺的研究[D].哈尔滨:东北农业大学,2013
[16]李巧云,王潇,卢富山,等.乳酸菌和酵母菌混合培养条件优化研究[J].江西农业学报,2013,25(10):121-123
[17]王小鹤,石太渊.高粱黑粉真菌格瓦斯饮料制作工艺的研究[J].食品科技,2009,34(8):41-43,48
[18]艾静.谷物格瓦斯的研制[D].哈尔滨:东北农业大学,2014
[19]罗斌,胡亚平,李海林,等.果蔬格瓦斯饮料的研制[J].保鲜与加工,2009,9(5):44-47
[20]闫彬,贺银凤.酸马奶中乳酸菌与酵母菌的共生发酵特性[J].食品科学,2012,33(7):131-137

