芝麻酚对猪精液冷冻保存效果的影响
王 捷,耿果霞,杨 丽,徐德军,陈华丽,苟清碧,裴一飞,吴 琳,李青旺*
(1.西北农林科技大学 动物科技学院,陕西 杨凌 712100;2.西北农林科技大学 动物医学院,陕西 杨凌 712100)
相比较于其他动物,猪精子质膜含有丰富的不饱和脂肪酸和少量的胆固醇,使猪精子对冷冻刺激更为敏感[1]。大量的活性氧(reactive oxygen species,ROS)会在冷冻过程中形成,以及预处理中精浆的移除,导致精子内氧化还原系统失衡,质膜受到破坏,失去了选择通透性,冷冻解冻后精子活率显著降低[2]。大量研究表明,外源性抗氧化剂的添加,可有效消除过量ROS,提高精子抗氧化损伤能力,维持细胞结构。Giaretta等[3]发现,一定浓度的维生素C能提高猪解冻后精子活率和膜完整性。Jeong等[4]研究证明,在冷冻稀释液中添加适量Vitamin E可以提高解冻后猪精子活率和功能完整性。Chanapiwat等[5]和Kaeoket等[6]一致认为,添加适量L-半胱氨酸明显改善解冻后精子质量。Gadea等[7]研究表明,在冷冻稀释液中添加适量还原型GSH可以明显改善整体解冻后精子质量,增强核蛋白结构的稳定性,从而提高其体内和体外的受精能力。Varo-Ghiuru等[8]在叶黄素对冷冻解冻后精子质量的影响研究中发现,适当浓度的叶黄素可以增强解冻后精子对渗透压的耐受性,维持DNA双链结构并提高活率和顶体的完整性。尽管如此,仍然不能满足实际生产需要,因此,寻找一些更有效的抗氧化剂,对提高优良公畜利用率,加快猪精子冷冻保存研究,完善人工授精技术具有重要的意义。
芝麻酚(3,4-亚甲二氧基苯酚,sesamol,SM)是存在于芝麻油中的一种芳香类物质,白色至淡黄色结晶性粉末或颗粒,微溶于水,易溶于乙醇、乙醚等极性有机溶剂,具有良好的药理作用并常作为食品和医药的抗氧化剂。芝麻酚对OH·、NO、 O-·2等活性氧自由基均具有较强的清除作用[9-10]。芝麻酚被用于食品领域,多用来添加至植物或者动物油脂中,以提高油脂的抗氧化能力,延长油脂的保存时间[11]。但作为天然无毒的抗氧化剂,目前尚未发现芝麻酚对猪精子冷冻保存效果的研究。本试验将不同浓度的芝麻酚作为外源性抗氧化剂添加到冷冻稀释液中,通过检测解冻后猪精子的活率、功能完整性和抗氧化能力,探究芝麻酚对猪精子冷冻保存效果的影响。
1 材料与方法
1.1 试验材料
精液样品采集于杨凌某猪场,试验猪为健康状态良好,1~2岁龄杜洛克种公猪(n=3)。手握法采集猪精液,37 ℃显微镜下观察,乳白色、无异味且活率大于75%的精液用于试验。
1.2 方 法
1.2.1 预处理 用等温等量BTS液稀释检验合格的猪精液样品,经0.5 h平衡后离心(800 r/min,10 min,17 ℃),弃上清液。用冷冻基础液(Tris-Citric Acid Glucose,TCG)和卵黄以4∶1体积比配置成冷冻Ⅰ液,预冷后缓慢加入到离心后的沉积中,按1∶2比例稀释,纱布包裹后放入4 ℃冰箱平衡1.5~2 h。再等体积缓慢加入预冷过的Ⅱ液(在冷冻Ⅰ液基础上添加终浓度为3%的甘油),并用纱布包裹后在4 ℃继续平衡2~3 h。选择精子活率高于0.6的精液样品进行冷冻。
1.2.2 冷冻 将装有精液样品并用封口粉密封好的0.25 mL细管放入程序冷冻仪中,以1 ℃/min的速率从4 ℃降至-5 ℃,当温度恒定在-5 ℃时,将细管置于液氮面3 cm上方熏蒸10 min,迅速投入到液氮中保存。
1.2.3 解冻 将细管从液氮中取出后迅速放入37 ℃恒温水浴锅中孵育45 s,然后取出,剪断两端后将精液倒入1.5 mL离心管内,置34 ℃恒温水浴锅中,10 min后进行精液品质检测。
1.3 质量检测
1.3.1 活率 用等温BTS液稀释解冻精液样品。400×倒置显微镜下观察精子,根据其运动状态评定精子活率。
1.3.2 线粒体活性 利用罗丹明( rhodamine123,Rh123)和碘化丙啶(propidium iodide,PI)荧光染料联合染色鉴别精子线粒体活性[12]。在荧光相差显微镜下(400×,激发波长488 nm、发射波长513 nm)观察,计数头部无红色荧光且颈部发绿色荧光精子所占比率,重复3次,每次计数精子不少于200个。
1.3.3 精子质膜完整性检测 通过HOST试验测定精子质膜完整性[13]。精液样品置于显微镜下(400×)观察,计数具有弯尾的精子所占比率,重复3次,每次计数精子不少于200个。
1.3.4 顶体完整性 利用FITC-PNA荧光染色法检测精子的顶体完整性[14]。在荧光相差显微镜下(400×,激发波长480 nm、发射波长530 nm)观察,计数头部顶端发绿色荧光精子所占比率,重复3次,每次计数精子不少于200个。
1.3.5 DNA完整性 利用吖啶橙染色法检测精子DNA完整性[15]。在荧光相差显微镜下(400×下,激发光波长450 nm、发射光波长490 nm)观察,计数头部发绿色荧光精子所占比率,重复3次,每次计数精子不少于200个。
1.3.6 生化参数 取精液样品离心(25 ℃, 1 600 r/min,5 min),在所得沉淀物中加入3倍体积1% TritonX-100抽提20 min,再次离心(25 ℃,4 000 r/min,30 min),保留上清液,使用南京建成生物工程研究所的MDA、SOD、CAT和GSH-Px试剂盒,分别检测解冻后猪精子MDA水平以及 SOD、CAT和GSH-PX酶的活力。
1.4 统计分析
应用SPSS19.0软件对数据进行单因素方差分析,结果以平均数±标准差表示,以P<0.05表示差异显著。
1.5 试验设计
分别向稀释液中添加0.05、0.10、0.15、0.20和0.25 g/L的芝麻酚,以不添加芝麻酚的TCG稀释液作为对照,检测解冻后猪精子活率、质膜完整率、顶体完整率、线粒体活性、DNA完整性、MDA水平和抗氧化酶活性。
2 结果与分析
2.1 芝麻酚对解冻后猪精子活率和线粒体活性的影响
通过冷冻前添加一定浓度的芝麻酚,可以显著提高解冻后猪精子活率和线粒体活性(P<0.05),在0.1~0.2 g/L的范围内,芝麻酚浓度和解冻后精子的活率和线粒体活性呈正相关(P<0.05),并且当芝麻酚浓度为0.2 g/L时,精子活率和线粒体活率最高(P<0.05),活率为45.84%,线粒体活性为56.87%。当芝麻酚浓度为0.25 g/L时,解冻后精子活率显著低于对照组(P<0.05)。添加0.05 g/L和0.25 g/L芝麻酚和对照组相比较,精子线粒体活性并没有明显改变(P>0.05)。
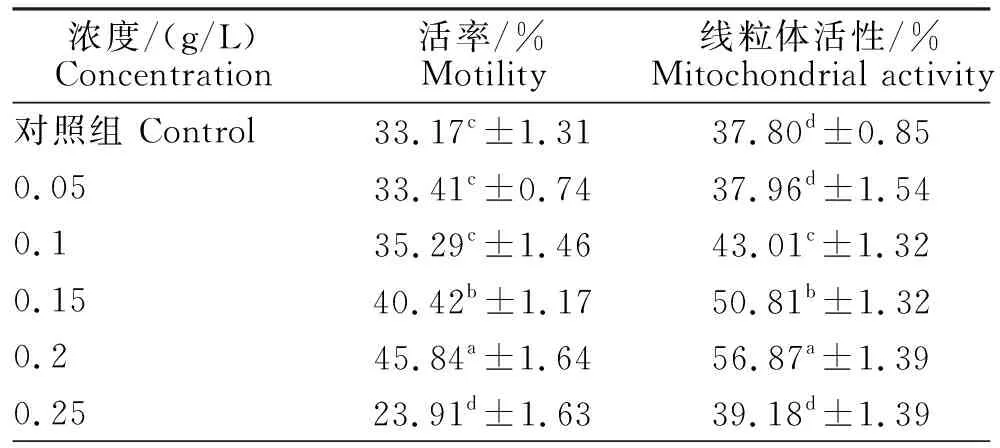
表1 芝麻酚对冷冻-解冻后猪精子活率和线粒体活性的影响Table 1 Effect of sesamol on frozen-thawed boar spermatozoa motility and mitochondrial activity
2.2 芝麻酚对解冻后猪精子功能完整性的影响
通过冷冻前添加一定浓度的芝麻酚,可以显著提高解冻后精子质膜完整率、顶体完整率和DNA完整率(P<0.05)。当芝麻酚浓度为0.2 g/L时,精子质膜完整率和顶体完整率最高,相比较于对照组,分别提高了18.78%和14.09%(P<0.05)。但当芝麻酚浓度为0.25 g/L时,精子DNA完整率最高,为72.46%(P<0.05)。芝麻酚添加浓度为0.05 g/L与对照组相比较,解冻后精子质膜完整率、顶体完整率和DNA完整率差异不显著(P>0.05)。
2.3 芝麻酚对解冻后猪精子生化参数的影响
通过冷冻前添加一定浓度的芝麻酚,可以显著提高解冻后精子SOD、CAT和GSH-Px活性(P<0.05)。当芝麻酚添加浓度为0.2 g/L时,MDA水平最低(P<0.05),SOD和GSH-Px活性最高(P<0.05),而当芝麻酚添加浓度为0.15 g/L时,CAT活性最高(P<0.05)。当芝麻酚添加浓度为0.05 g/L时,与对照组相比较差异不显著(P>0.05)。因此,当芝麻酚添加浓度为0.2 g/L时,对猪精子抗氧化性效果最佳。

表2 芝麻酚对冷冻-解冻后猪精子功能完整性的影响Table 2 Effect of sesamol on frozen-thawed boar spermatozoa functional integrity
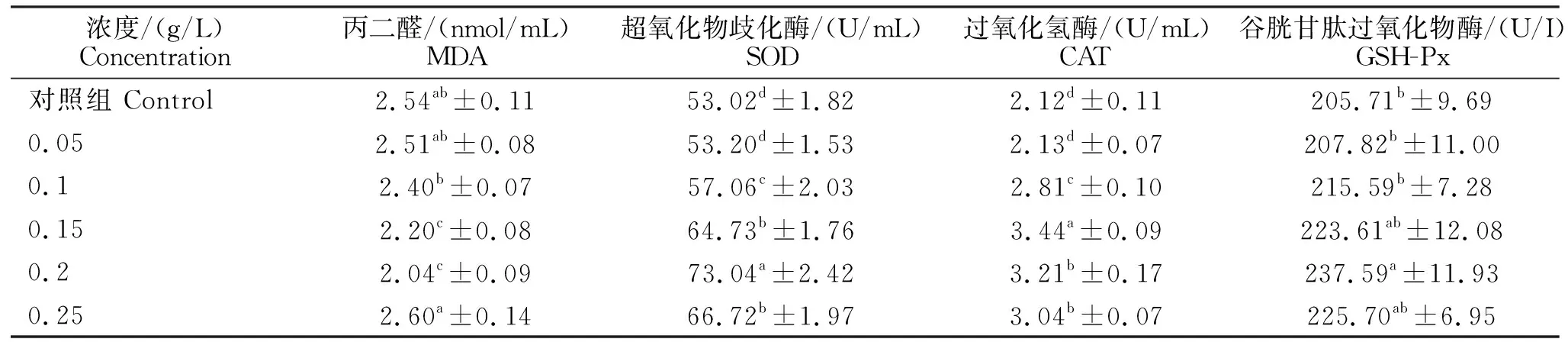
表3 芝麻酚对冷冻-解冻后猪精子生化参数的影响Table 3 Effects of sesamol on frozen-thawed boar spermatozoa biochemical parameters
3 讨 论
芝麻油中含有大量的PUFA,由于其内活性物质芝麻酚被认为是芝麻油主要品质稳定剂,可以保护PUFA不被氧化,故芝麻油比其他植物油稳定[16]。芝麻酚对O2-·自由基具有较强的清除作用,其清除活性要优于2,6-二叔丁基-4-甲基苯酚(BHT)和维生素E[10]。作为天然的食源性抗氧化剂,芝麻酚已被广泛研究于医学损伤防护上。芝麻酚能保护小鼠外周血淋巴细胞的DNA,显著降低因射线照射引起的DNA损伤[17],提高小鼠淋巴细胞DNA的自我损伤修复能力[18],通过改变氧化应激水平和炎症介质一定程度上解除环磷酰胺诱导的大鼠肝毒性[19]。但是,目前还未报道关于芝麻酚对猪精液冷冻保护效果的研究。本试验在冷冻稀释液中添加梯度浓度的芝麻酚,表明适量浓度的芝麻酚对猪精子冷冻保护具有良好的作用。
猪精子因其质膜富含PUFA,更易受到冷冻过程中产生的过量ROS的攻击,而发生脂质过氧化反应,损伤精子结构,活率和受精能力降低[2],因而猪精子对超低温冷冻比较敏感。在冷冻稀释剂中添加外源性抗氧化性剂可起到保护精子的作用,Varo-Ghiuru等[8]研究证明,水溶性维生素E能提高解冻后猪精子活率和顶体完整率。沈涛等[20]研究发现,在猪精液冷冻稀释液中添加α-硫辛酸,可以显著提高解冻后猪精子活率和SOD酶活性。孙艳青等[21]研究证明,在猪精液冷冻稀释液中添加葡萄籽原花青素,可以显著提高解冻后精子品质和抗氧化能力。本试验中,在冷冻稀释液中添加适量的芝麻酚,显著提高解冻后精子质量,本试验研究结果和上述研究结果一致。
本试验中,芝麻酚可提高解冻后猪精子质量和抗氧化能力,表明芝麻酚对冷冻-解冻后猪精子有保护作用。芝麻酚是一种高效无毒的抗氧化剂,分子中含有可提供良好抗氧化能力的酚羟基和亚甲二氧基苯环,以及结构中近似与苯环垂直的氧原子轨道使得整个分子结构更稳定[22],其稳定的抗氧化能力可以有效减少精子的氧化损伤,维持精子结构和功能完整性。Kanimozhi等[23]验证了芝麻酚可一定程度消除OH·、O2-、NO、DPPH·、ABTS·+等自由基。MDA是生物膜脂质过氧化的终产物,其含量可以间接反映机体受过氧化的损伤程度,而SOD、CAT和GSH-Px酶活性均可直接反映精子抗氧化能力[24]。本试验表明,芝麻酚可以提高精子内SOD、CAT和GSH-Px活性,Prasad等[25]研究表明,芝麻酚预处理体外培养的人淋巴细胞能提高SOD、CAT和GSH-Px活性,减轻γ射线的毒害作用、避免着丝粒发生畸变。当添加芝麻酚浓度达到0.25 g/L时,解冻后精子质量明显下降,甚至低于对照组。可能是因为在稀释液中添加高浓度的芝麻酚会降低精液样品的pH,从而对精子造成严重损害。pH可能通过影响乙酰辅酶A、琥珀酰辅酶A等一些代谢酶的酰化作用调节其活性进而调节这些酶介导的能量代谢,影响ATP水平,从而影响体外培养精子活力及功能[26]。
有研究通过比较含有芝麻酚、Vitamin E和同时含有芝麻酚和Vitamin E的油在60 ℃放置时间不同得出结论,而含有芝麻酚和Vitamin E的油抗氧化活性较高[27]。将芝麻酚和生育酚配伍,对猪精液冷冻保存是否有更好的效果,还需进一步试验。
4 结 论
本试验表明,猪精液冷冻稀释液中添加适量的芝麻酚可以显著提高解冻后精子活率、功能完整性和抗氧化活性,其最适添加浓度为0.2 g/L。
参考文献:
[1] CASAS I, Flores E. Gene Banking: The Freezing Strategy[M]// Boar Reproduction,2013:551-588.
[2] 张亮, 姜垠, 邱进杰,等. 猪精液冷冻保存影响因素研究进展[J]. 猪业科学, 2016, 33(2):114-116.
[3] GIARETTA E, ESTRADA E, BICCI D, et al. Combining reduced glutathione and ascorbic acid has supplementary beneficial effects on boar sperm cryotolerance[J]. Theriogenology, 2015, 83(3):399-407.
[4] JEONG Y J, KIM M K, SONG H J, et al. Effect of α-tocopherol supplementation during boar semen cryopreservation on sperm characteristics and expression of apoptosis related genes [J]. Cryobiology, 2009, 58(2):181-189.
[5] CHANAPIWAT P, KAEOKET K, TUMMARUK P. Effects of DHA-enriched hen egg yolk and L-cysteine supplementation on quality of cryopreserved boar semen[J]. Asian Journal of Andrology, 2009, 11(5):600-608.
[6] KAEOKET K, CHANAPIWAT P, TUMMARUK P, et al. Supplemental effect of varying L-cysteine concentrations on the quality of cryopreserved boar semen[J]. Asian Journal of Andrology, 2010, 12(5):760-765.
[7] GADEA J, MOLLA M, SELLES E, et al. Reduced glutathione content in human sperm is decreased after cryopreservation: Effect of the addition of reduced glutathione to the freezing and thawing extenders[J]. Cryobiology, 2011, 62(1):40-46.
[8] VAROGHIURU F, MICLEA I, HETTIG A, et al.Lutein, trolox, ascorbic acid and combination of trolox with ascorbic acid can improve boar semen quality during cryopreservation[J]. Cryo Letters, 2015, 36(1):1-7.
[9] KANIMOZHI P, PRASAD N R. Antioxidant potential of sesamol and its role on radiation-induced DNA damage in whole-body irradiated Swiss albino mice[J]. Environmental Toxicology & Pharmacology, 2009, 28(2):192-197.
[10] 李宇, 刘宇光, 董新荣,等. 芝麻酚清除O2-·自由基的活性研究[J]. 食品研究与开发, 2009, 30(1):44-45.
[11] 董新荣, 刘宇光, 李本祥. 芝麻酚对茶油抗氧化活性研究[J]. 食品研究与开发, 2008, 29(7):19-21.
[12] FRASER L, DZIEKOSKA A, STRZEZEDK R, et al. Dialysis of boar semen prior to freezing-thawing: its effects on post-thaw sperm characteristics[J]. Theriogenology, 2007, 67(5):994-1 003.
[14] ABOAGLA E M, TERADA T. Trehalose-enhanced fluidity of the goat sperm membrane and its protection during freezing[J]. Biology of Reproduction, 2001, 69(4):1 245-1 250.
[15] LIU L J, PENG-CHENG M A, WANG L, et al. Protective Effect of Astragalus Polyose on DNA Integrity of Human Sperm[J]. Journal of International Reproductive Health/family Planning, 2015, 225(9):50-53.
[16] 蒋文伟, 罗杰, 牟莉娟. 抗氧剂芝麻酚制备技术及抗氧化活性评述[J]. 林产化学与工业, 2001, 21(4):73-78.
[17] KANIMOZHI P, PRASAD N R. Antioxidant potential of sesamol and its role on radiation-induced DNA damage in whole-body irradiated Swiss albino mice[J]. Environmental Toxicology & Pharmacology, 2009, 28(2):192-197.
[18] NAIR G G, NAIR C K. Protection of cellular DNA and membrane from γ-radiation[J]. Cancer Biotherapy & Radiopharmaceuticals, 2010, 25(6):629.
[19] JNANESHWARI S, HEMSHEKHAR M, THUSHARA R M, et al. Sesamol Ameliorates Cyclophosphamide-Induced Hepatotoxicity by Modulating Oxidative Stress and Inflammatory Mediators[J]. Anti-cancer agents in medicinal chemistry, 2013, 14(7):975-983.
[20] SHEN T, JIANG Z L, LI C J, et al. Effect of alpha-lipoic acid on boar spermatozoa quality during freezing-thawing[J]. Zygote, 2015, 24(2):1-7.
[21] 孙艳青, 李青旺, 耿果霞,等. 葡萄籽原花青素对猪精液冷冻保存效果的研究[J]. 家畜生态学报, 2016, 37(5):46-51.
[22] SEUNGWOOK L, MINKYU J, MINHEE P, et al. Effects of roasting conditions of sesame seeds on the oxidative stability of pressed oil during thermal oxidation[J]. Food Chemistry, 2010, 118(3):681-685.
[23] KANIMOZHI P, PRASAD N R. Antioxidant potential of sesamol and its role on radiation-induced DNA damage in whole-body irradiated Swiss albino mice[J]. Environmental Toxicology & Pharmacology, 2009, 28(2):192-197.
[24] 邬志薇, 蒋霞, 童星,等. 芝麻酚清除自由基及对辐照大鼠抗氧化能力的影响[J]. 中华放射医学与防护杂志, 2013, 33(1):37-39.
[25] PRASAD N R, MENON V P, VASUDEV V, et al. Radioprotective effect of sesamol on gamma-radiation induced DNA damage, lipid peroxidation and antioxidants levels in cultured human lymphocytes[J]. Toxicology, 2005, 209(3):225-235.
[26] 王立蕊, 甄林青, 杨强震,等. 培养液pH值对小鼠精子体外培养过程中活力及蛋白修饰的影响[J]. 上海交通大学学报农业科学版, 2016, 34(3):6-14.
[27] 黄纪念, 宋国辉, 孙强. 芝麻和芝麻油的抗氧化活性[J]. 中国食物与营养, 2009(2):26-28.

