一种新型的脲类溶剂在锂空气电池中的应用
任 警,黄志梅,沈 越,黄云辉
一种新型的脲类溶剂在锂空气电池中的应用
任 警,黄志梅,沈 越,黄云辉
(华中科技大学材料科学与工程学院,湖北 武汉 430074)
在锂空气电池中,电解液对电池的充放电过程、放电产物的稳定性以及循环性能有着至关重要的影响。本文利用脲类溶剂1, 3-二甲基-2-咪唑啉酮(DMI)作为新型的锂空气电池电解液,有效地增加了放电产物过氧化锂(Li2O2)的溶解度,促进其溶剂化,并改善Li2O2与正极之间的接触,使得电池性能得到有效提高。通过研究表明,相比较传统的醚类电解液四乙二醇二甲醚(TEGDME),DMI能将电池放电容量提升1.5倍,而充电过电位则降低了0.6 V,减少了高电位导致的副反应。同时,通过加入氧抑制剂,稳定溶剂中的氧自由基,减少放电中间产物对DMI的攻击,使得电池循环性能得到显著提高。
锂空气电池;电解液;过氧化锂;循环性能
锂空气电池因为其超高的理论能量密度(3458 W·h/kg),被认为是具有潜力的下一代高比能储能体系[1-8]。但抛开美好的愿景,实际的研究还面临着诸多棘手的问题。其中一个重要的问题是放电产物具有难溶性和绝缘性。所以如果放电产物不能和正极有很好的接触,则通常会使得过电位超过1 V[9-12]。在高过电位下,电解液以及碳材料正极会被分解,生成的副产物逐渐积累,造成电池循环性能降低。因此放电产物的难溶性和绝缘性是造成锂空气电池难以实用化的重要原因。
针对目前有机系锂空气电池中这一问题,比较有效的解决方法是利用有一定溶剂化过氧化锂能力的溶剂来充当电解液[13-19]。相比较传统的惰性电解液,它们拥有较高的给质子能力(AN)或是有较强的给电子能力(DN),能更好的溶解过氧化锂及其中间产物,从而增加电池的放电容量,降低充电过电位,并且减少由高电位带来的副反应。但是AN或DN溶剂在溶解过程中,也不可避免地被氧自由基所攻击而分解,在消耗电解液的同时,也会产生不必要的副产物,对电池造成危害[20-22]。
考虑到以上问题,在本文中,我们采用一种新型的高DN溶剂,1, 3-二甲基-2-咪唑啉酮(DMI)作为锂空气电池的电解液(DN = 27.8)[23]。该溶剂有较低的黏度和挥发性,对锂盐(LiTFSI)和放电产物有很好的溶解性,有利于提升电池容量,降低电池充电过电位。针对氧自由基对电解液的攻击,将氧抑制剂2, 6-二叔丁基-4-甲基苯酚(BHT)作为添加剂,加入到电解液中,通过自身与氧自由基的结合,来减少氧自由基对DMI的攻击,从而提高电池的稳定性,最终使得电池循环性能得到提高。
1 实验材料和方法
1.1 材 料
锂片,由天津中能锂业提供。锂盐为双(三氟甲基磺酰)亚胺锂(LiTFSI),由Sigma Aldrich提供,使用前先通过真空烘箱彻底干燥。1, 3-二甲基-2-咪唑啉酮(DMI)、四乙二醇二甲醚(TEGDME)和二乙二醇二甲醚(DME),由Sigma Aldrich提供,使用前通过分子筛在手套箱中干燥1周。玻璃纤维隔膜,由Whatman提供,使用前在真空烘箱中干燥24 h。
1.2 分析测试仪器
多晶X射线衍射分析仪(XRD),型号为:X’ Pert PRO-DY2198(PANalytical B.V.,荷兰);场发射扫描电子显微镜(FSEM),型号为:Sirion 200(FEI,Holland);X射线光电子能谱(XPS),型号为:Kratos公司的Axis Ultra Dld-600 W,X光源为Al的Kα射线(1486.6 eV);核磁共振(NMR),型号为:Bruker AscendTM,600 MHz;充放电测试仪,型号为LAND CT2001A;电化学工作站,型号为辰华CHI 600D。
1.3 三维多孔碳纳米管(CNT)海绵的合成
三维多孔碳纳米管海绵利用化学气相沉积(CVD)在石英盖板上进行生长制得,如图1所示。先配制0.05 g/mL二茂铁的二氯苯溶液,然后将溶液转移到注射器中,并注入到石英管中,控制流速为0.13 mL/min。同时,向里面通入比例为3∶20的氢气和氩气,其中,氢气的流量为300 mL/min,并控制温度在860 ℃,这样即可在基底上生长出碳纳米管海绵。
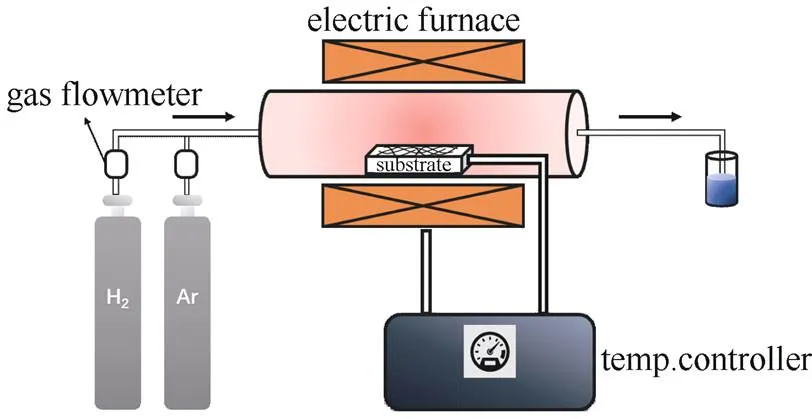
图1 碳纳米管海绵合成示意图
1.4 采用LISICON保护的参比电极的制备
实验中CV所采用的为LISICON保护的金属锂作为参比电极,如图2所示。首先,将LISICON切成5 mm×5 mm大小,固定在石英管的一侧,并将接缝处紧紧密封;然后将锂箔缠绕在不锈钢网上,并压紧后,放入石英管中;再向石英管中注入一定量的1 mol/L LiTFSI/TEGDME电解液,并浸没锂箔;最后将石英管口密封。需要注意的是LISICON不能和锂箔直接接触,两者之间需留出一定空隙,防止LISICON被锂箔还原而失效。
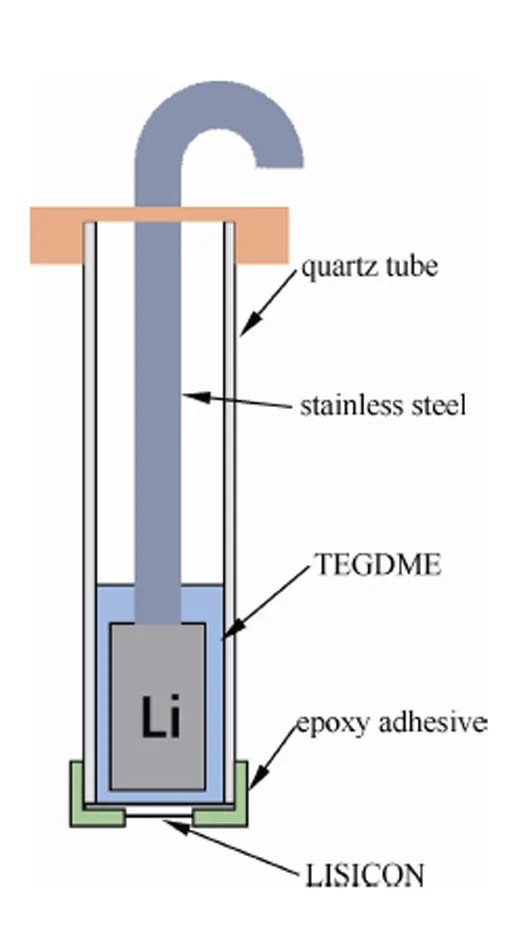
图2 采用LISICON保护的参比电极示意图
2 实验结果与讨论
2.1 电解液稳定性的表征
2.2 充放电性能和产物的表征
2.2.1 充放电性能的表征
为了证明DMI能够提升放电容量,分别以1 mol/L LiTFSI/DMI和1 mol/L LiTFSI/TEGDME作为电解液组装电池。从图4(a)中可以看出,在LiTFSI/DMI中,放电比容量为8107 mA·h/g,明显大于在LiTFSI/TEGDME中的5000 mA·h/g,这说明了DMI确实能提升电池的放电容量。除了放电容 量的提升,DMI还能在一定程度上降低充电过电位。两种电解液的首圈充放电曲线如图4(b)所示,LiTFSI/DMI的充电电位只有3.5 V,相比较LiTFSI/TEGDME降低了0.5 V,提升了电池的能量效率并减少了电解液和正极材料的氧化分解。根据“软硬酸碱”理论,Li+是一种硬酸,而DMI和Li+的结合能降低其酸性,有助于稳定同样是软碱的O2-。所以在充电时,有一少部分O2-存在于溶液中,而O2-则在溶剂里通过歧化反应得到Li2O2,即:



由于第二步反应在溶剂中进行,相较Li2O2直接在正极被氧化,此反应方式比较容易,且溶剂能将Li2O2传输到正极材料表面,促进其氧化分解,从而使充电电位降低。
此外,我们利用1 mol/L LiTFSI/DMI 作为电解液组装电池并直接进行充电,如图4(c)所示,电池在贡献140 mA·h/g的容量后即失效,表明DMI在锂空气电池环境下比较稳定,只存在微弱的分解。
2.2.2 充放电性能的表征
电池放电和充电后的正极分别通过SEM和XRD进行检测,检测前利用DME将正极材料清洗3次,然后晾干密封,以备测试。图5(a)和5(b)分别为首圈放完电后正极表面的SEM和XRD。通过SEM可以明显看出放电产物呈大颗粒椭圆形均匀沉积在电极表面,而XRD结果所显示的衍射峰位与Li2O2标准的XRD峰相匹配。图5(c)和5(d)显示的是充电过后的电极表面SEM和XRD。通过SEM发现,放电生成的颗粒物已经被分解,而XRD也没有放电产物的衍射峰显示,所以说明电池充放电是过氧化锂的形成和分解。


2.2.3 电池循环性能的表征
电池的循环性能测试以恒流充放电的形式进行,电流密度为0.2 mA/g,容量限制为1000 mA·h/g,如图6(a)所示,虽然在前几圈充电过电位能保持在较低的程度,但循环增加,充电过电位会逐渐升高,在循环约20圈后,充电过电位会上升到3.8 V以上,这是由于电解液在结合Li+时,会在电解液中生成超氧根氧自由基,虽然氧自由基能够部分被Li+-(solvent)稳定,但是电解液仍然无法避免被攻击,并且随着循环增加,副反应程度会越严重,导致电池充电过电位增加,并最终失效。为了验证副反应的存在,对循环过后的电解液进行NMR检测,并对电极片表面进行XPS表征,如图6(b)~6(d)所示。通过1H NMR谱可以看出,在= 5.25的位置有2个二重峰,= 5.85有1个二重峰,表明了CH2== CH—结构的产生,说明电解液在循环过程中确实存在分解。而通过XPS的C 1s谱可以看出在循环过后,290 eV处有很明显的峰对应Li2CO3,而没有检测出Li2O2,而在Li 1s谱中同样可以看到明显的Li2CO3峰。表明电极片表面的产物大多为碳酸锂,电解液和碳正极材料都可能参与生成了Li2CO3。
2.3 副反应的分析及改进
基于以上分析,我们对电解液在循环中可能的分解路径进行描绘,如图7所示,首先N—CH2键会断开,C原子的孤对电子会立即结合成双键。但在强氧化性环境下,双键并不稳定,并会继续被氧化,得到乙二酸,部分在正极处会转化成Li2CO3。
为了抑制氧自由基对电解液的攻击,将2, 6-二叔丁基-4-甲基苯酚(BHT)作为添加剂添加到电解液中。BHT作为常见的抗氧化剂,能够通过与氧自由基可逆的形成络合物,来达到约束氧自由基的目的,减少其与DMI之间的相互作用,从而提升电池的循环性能。图8(a)为加入5 mM BHT后电池的循环,电池在前30圈,能够保证充电电位保持在3.6 V,同时整个电池的循环可以达到约40圈,明显可以看出相比没加BHT时,电池的循环性能以及稳定性能都有了很大的提升。循环放电后对电极片进行XRD测试,发现放电产物仍然是Li2O2,如图8(b)所示,说明BHT的加入确实能够有效提高电池的循环性能和稳定性。
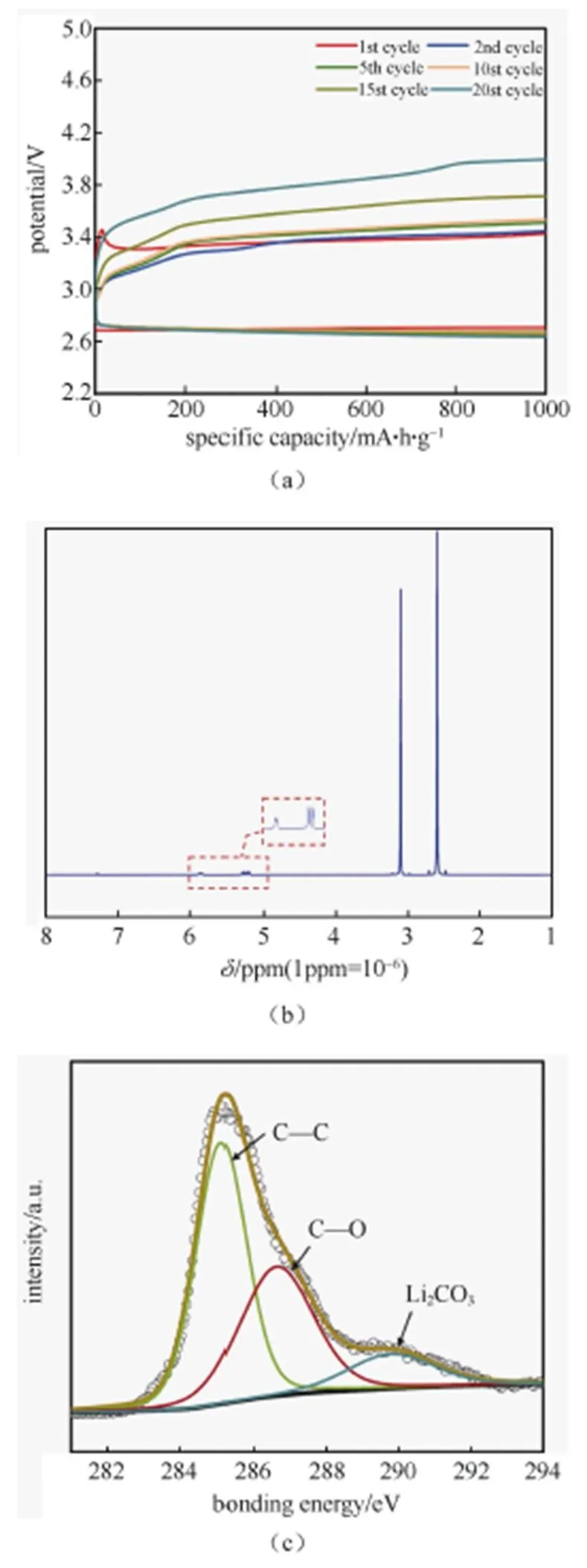
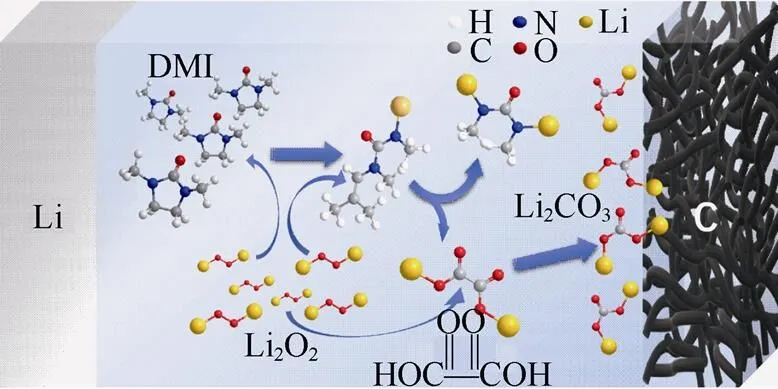
图7 电解液副反应示意图
3 结 论
(1)DMI与过氧化锂和金属锂之间化学稳定,具有合适的电化学窗口,适合作为锂空气电池的电解液。
(2)DMI能够溶剂化Li2O2及其中间产物,促进产物的液相成核,有效提升电池的容量。
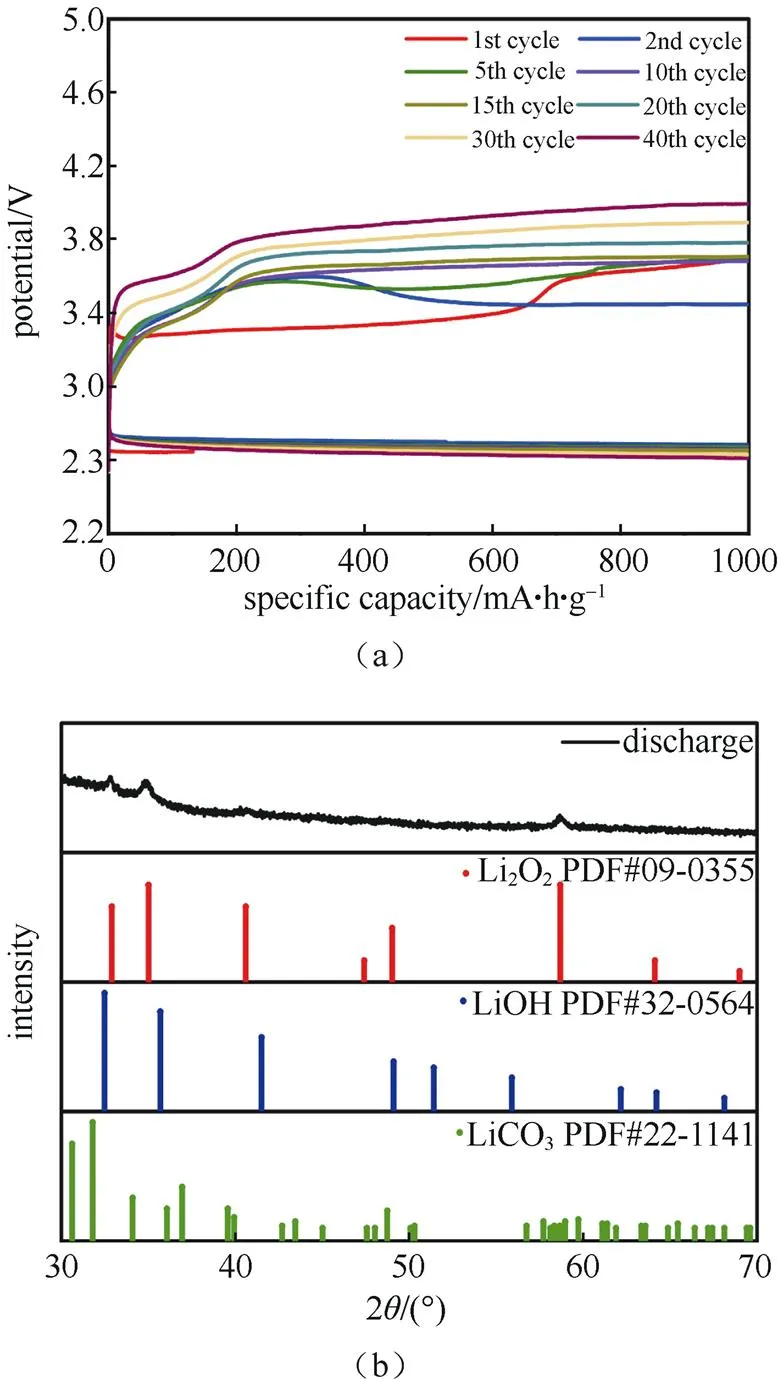
图8 (a)加入BHT后电池的充放电循环,充放电电流密度为200 mA/g;(b)循环后正极侧放电产物的XRD表征
(3)DMI与Li+的结合能够降低其酸性,生成的Li+-(solvent)能够和软碱O2-和O22-有较好的结合,有助于稳定氧自由基。
(4)DMI能够将溶解的Li2O2转移到正极表面,改善两者之间的接触,降低充电过电位。
(5)通过在电解液中加入抗氧化剂BHT,结合溶剂中的氧自由基,减少其对电解液的攻击,最终使得电池能够有更高的循环性能和稳定性。
[1] BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11(1): 19.
[2] GIRISHKUMAR G, MCCLOSKEY B, LUNTZ A C, et al. Lithium-air battery: Promise and challenges[J]. The Journal of Physical Chemistry Letters, 2010, 1(14): 2193-2203.
[3] HUMMELSHOJ J S, BLOMQVIST J, DATTA S, et al. Communications: Elementary oxygen electrode reactions in the aprotic Li-air battery[J]. The Journal of Chemical Physics, 2010, 132: 71101.
[4] LAOIRE C O, MUKERJEE S, ABRAHAM K M, et al. Elucidating the mechanism of oxygen reduction for lithium-air battery applications[J]. The Journal of Physical Chemistry C, 2009, 113(46): 20127-20134.
[5] OGASAWARA T, DÉbart A, HOLZAPFEL M, et al. Rechargeable Li2O2electrode for lithium batteries[J]. Journal of the American Chemical Society, 2006, 128(4): 1390-1393.
[6] LU Y C, GASTEIGER H A, PARENT M C, et al. The influence of catalysts on discharge and charge voltages of rechargeable Li-oxygen batteries[J]. Electrochemical and Solid-State Letters, 2010, 13(6): A69-A72.
[7] QIU F, HE P, JIANG J, et al. Ordered mesoporous TiC-C composites as cathode materials for Li-O2batteries[J]. Chemical Communications, 2016, 52(13): 2713-2716.
[8] XU J J, WANG Z L, XU D, et al. Tailoring deposition and morphology of discharge products towards high-rate and long-life lithium-oxygen batteries[J]. Nature Communications, 2013, 4(9): 2438.
[9] THOTIYL M M O, FREUNBERGER S A, PENG Z, et al. A stable cathode for the aprotic Li-O2battery[J]. Nature Materials, 2013, 12(11): 1050-1056.
[10] XU K. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chemical Reviews, 2004, 104(10): 4303-4418.
[11] CHEN Y, FREUNBERGER S A, PENG Z, et al. Li-O2battery with a dimethylformamide electrolyte[J]. Journal of the American Chemical Society, 2012, 134(18): 7952-7957.
[12] READ J. Characterization of the lithium-oxygen organic electrolyte battery[J]. Journal of the Electrochemical Society, 2002, 149(9): A1190-A1195.
[13] LAOIRE C O, MUKERJEE S, ABRAHAM K M, et al. Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable lithium-air battery[J]. The Journal of Physical Chemistry C, 2010, 114(19): 9178-9186.
[14] ZHOU B, GUO L, ZHANG Y, et al. A high-performance Li-O2battery with a strongly solvating hexamethylphosphoramide electrolyte and a LiPON-protected lithium anode[J]. Advanced Materials, 2017, 29(30): doi: 10.1002/adma.201701568.
[15] GAO X, JOVANOV Z P, CHEN Y, et al. Phenol-catalyzed discharge in the aprotic lithium-oxygen battery[J]. Angewandte Chemie International Edition, 2017, 56: 6539-6543.
[16] AETUKURI N B, MCCLOSKEY B D, GARCIA J M, et al. Solvating additives drive solution-mediated electrochemistry and enhance toroid growth in non-aqueous Li-O2batteries[J]. Nature Chemistry, 2015, 7(1): 50-56.
[17] ZHANG W, SHEN Y, SUN D, et al. Promoting Li2O2oxidationsolvent-assisted redox shuttle process for low overpotential Li-O2battery[J]. Nano Energy, 2016, 30: 43-51.
[18] JOHNSON L, LI C, LIU Z, et al. The role of LiO2solubility in O2reduction in aprotic solvents and its consequences for Li-O2batteries[J]. Nature Chemistry, 2014, 6(12): 1091-1099.
[19] LIU R, LEI Y, YU W, et al. Achieving low overpotential lithium-oxygen batteries by exploiting a new electrolyte based on,-dimethylpropyleneurea[J]. ACS Energy Letter, 2017, 2(2): 313-318.
[20] KWABI D G, BATCHO T P, AMANCHUKWU C V, et al. Chemical instability of dimethyl sulfoxide in lithium-air batteries[J]. The Journal of Physical Chemistry Letters, 2014, 5(16): 2850-2856.
[21] SHARON D, AFRI M, NOKED M, et al. Oxidation of dimethyl sulfoxide solutions by electrochemical reduction of oxygen[J]. The Journal of Physical Chemistry Letters, 2013, 4(18): 3115-3119.
[22] KHETAN A, LUNTZ A, VISWANATHAN V. Trade-offs in capacity and rechargeability in nonaqueous Li-O2batteries: Solution-driven growth versus nucleophilic stability[J]. The Journal of Physical Chemistry Letters, 2015, 6(7): 1254-1259.
[23] YAMASHITA K I, TSUBOI M, ASANO M S, et al. Facile aromatic finkelstein iodination (AFI) reaction in 1, 3-dimethyl-2-imidazolidinone (DMI)[J]. Synthetic Communications, 2012, 42(2): 170-175.
Achieving high performance lithium-O2battery by introducing a novel urea electrolyte
REN Jing, HUANG Zhimei, SHEN Yue, HUANG Yunhui
(School of Materials Science and Engineering, Huazhong University of Science and Technology, Wuhan 430074, Hubei, China)
The development of rechargeable Li-O2battery (LOB) has encountered bottlenecks at this stage. One of the biggest challenges is to lower the oxidation potential of Li2O2, the insulating and insoluble discharge product. In this paper, 1, 3-Dimethyl-2-imidazolidinone (DMI) is first to be used as electrolyte in LOB, which can increase the solubility of lithium peroxide, promote its solvation, and improve the contact between Li2O2and cathode, resulting in an improved battery performance. Compared to the traditional TEGDME electrolyte, DMI can increase the charge capacity by 1.5 times, while decrease the charge overpotential by 0.6 V, which suppress the side reaction caused by high potential. At the same time, by adding oxygen inhibitors, the oxygen radicals in the solvent are stabilized, the nucleophilic attack on the DMI by the discharge intermediate product is reduced, and the cycle performance of the battery is significantly improved.
lithium-O2battery; electrolyte; lithium peroxide; cycle performance
10.12028/j.issn.2095-4239.2018.0069
TM 911
A
2095-4239(2018)04-0667-07
2018-04-28;
2018-05-03。
国家自然科学基金项目(51602223和51632001)。
任警(1992—),男,硕士研究生,主要研究方向为锂空气电池,E-mail:maplerj@hust.edu.cn;
沈越,副教授,主要研究方向为锂空气电池、锂离子电池SOC、SOH实时监测以及纳米材料与器件,E-mail:shenyue1213@hust.edu.cn。

