不同品质小麦日粮添加霉菌吸附剂对育肥猪生长性能、养分消化率及肠道健康的影响
吴朋朋,曹璀文,徐剑波
(1.南京工业大学经济与管理学院,江苏南京 211816;2.江苏常州经济开发区行政审批局,江苏常州 213025)
小麦在我国种植面积大,产量多,是较好的饲料资源,但由于含有的非淀粉多糖(木聚糖、葡聚糖、甘露聚糖)影响营养物质的利用,因此,限制其作为家禽饲料原料的应用(冯定远和吴新连,2001)。此外,不同地区小麦质量存在区别,小麦在收割或贮存期间方法不当容易引起霉菌污染。霉菌毒素是由含有毒性的丝状真菌产生的次生代谢产物(Binder,2007)。谷物中主要的霉菌毒素包括黄曲霉毒素、玉米赤霉烯酮、T-2毒素及呕吐毒素,而猪是对这些毒素最为敏感的动物之一(Richard,2007)。因此,本试验选择两种不同质量的小麦,同时在日粮中添加霉菌吸附剂,考察其对育肥猪生长性能、养分消化率及肠道健康的影响,为受毒素污染的小麦在猪日粮中的应用提供理论依据。
1 材料与方法
1.1 试验材料 霉菌吸附剂(主要成分为丙酸和甲酸钙),购自鲁西兽药有限公司。
1.2 试验日粮与分组 选择86 d健康、体重接近[(38.08±0.56)kg]的杜×长×大商品猪各200头,随机分成4组,每组5个重复,每个重复10头。采用2(低品质小麦和高品质小麦)×2(3000 mg/kg和0 mg/kg霉菌吸附剂)设计试验日粮。处理1组为低品质小麦组(无霉菌吸附剂),处理2组为低品质小麦+ 3000 mg/kg霉菌吸附剂组,处理3组为高品质小麦组(无霉菌吸附剂),处理4组为高品质小麦+ 3000 mg/kg霉菌吸附剂组。不同品质小麦营养成分、日粮组成及营养成分见表1~3。
1.3 饲养管理 猪只自由饮水和采食,每天早上7点和下午3点各饲喂1次,室温控制在(25±1)℃,采用自然光照和人工光照相结合,光照时间为16 h(30 lx),按照常规免疫制度进行免疫和消毒。试验时间为6周。
1.4 测定指标
1.4.1 养分消化率的测定 在试验结束时,每个重复选3头猪,分别收集各猪只粪便300 g,-20℃保存,干物质、总能、粗蛋白质和有机物等消化率的测定参考Landero等(2011)的研究方法。
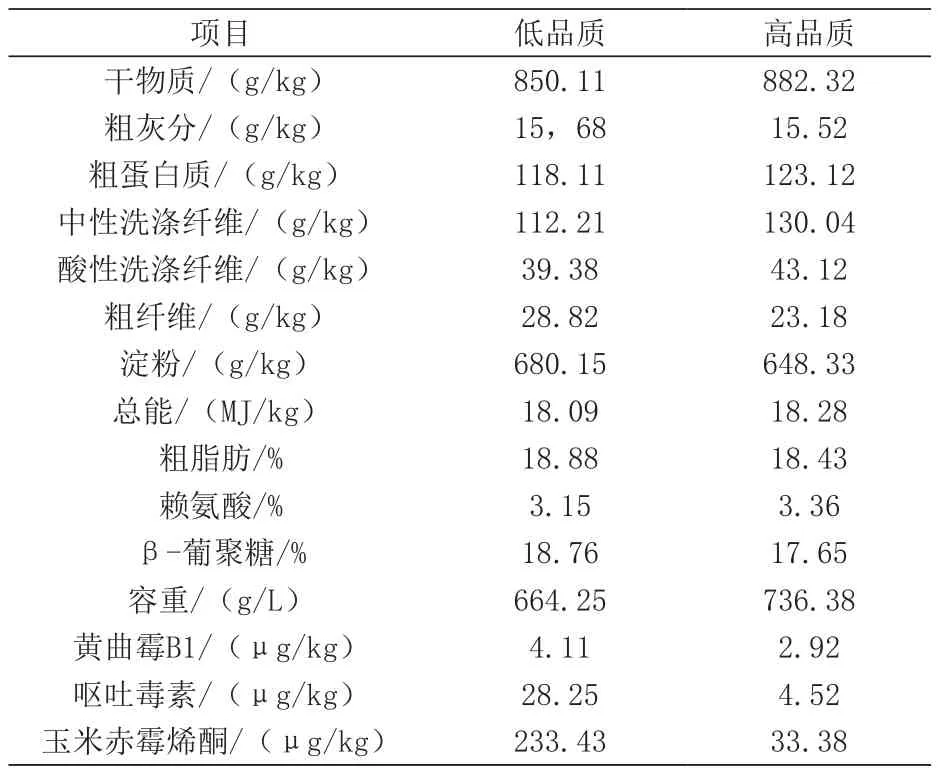
表1 不同品质小麦营养成分分析(风干基础)
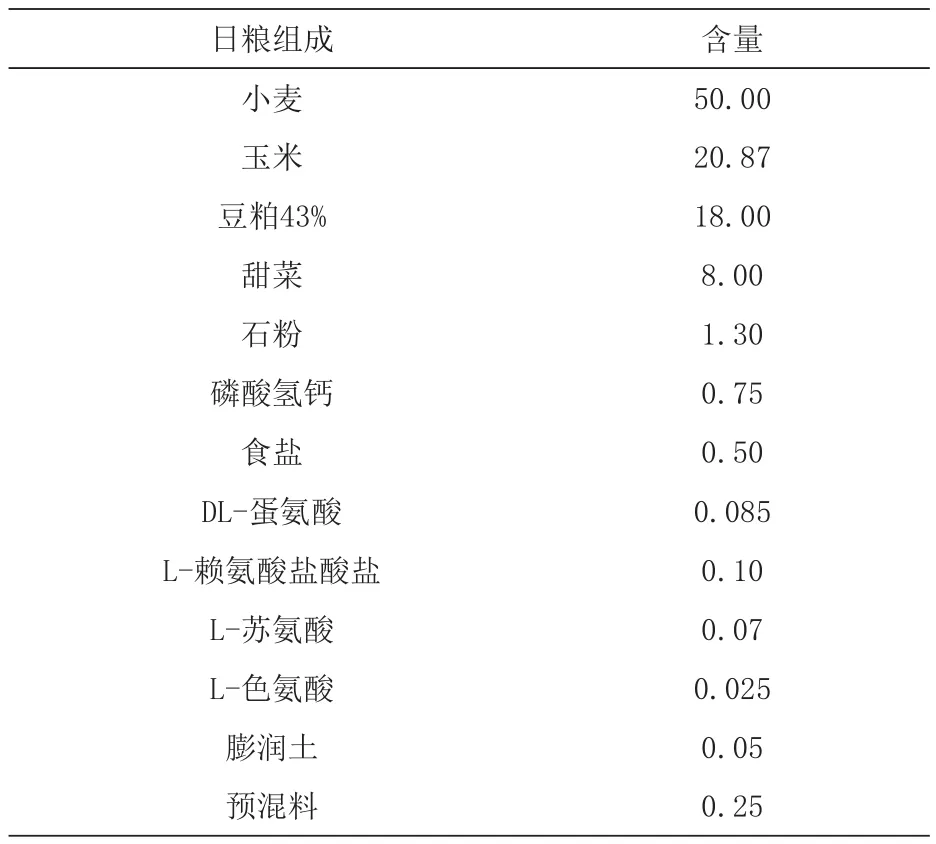
表2 日粮组成 %
1.4.2 肠道相关基因表达的测定 在试验结束时,每组按重复选择体重一致的2头猪屠宰,收集各肠段内容物,Epperdoff管-20℃保存。参考O’shea等(2012)研究方法进行PCR程序及引物设计胃泌素(GAST)、胃饥饿素(GHRL)、胰岛素样肽1受体(GLP1R)、胰岛素样肽2受体(GLP2R)、下 丘 脑 神 经 肽 Y(NPY)、YY 肽(PYY)、钠离子转运载体 2A1(SLC2A1)、钠离子转运载体2A2(SLC2A2)、钠离子转运载体2A7(SLC2A7)、分化抗原簇 36(CD36)、钠离子转运载体15家族A1(PEPT1)、钠离子转运载体5家族 A1(SGLT1)、肿瘤坏死因子(TNF)、白细胞介素 6(IL6)、紧密连接蛋白 2抗体(CLDN2)。参考Pierce等(2006)研究方法测定挥发性脂肪酸的含量。参考Huang等(2012)研究方法测定肠道菌群数量。
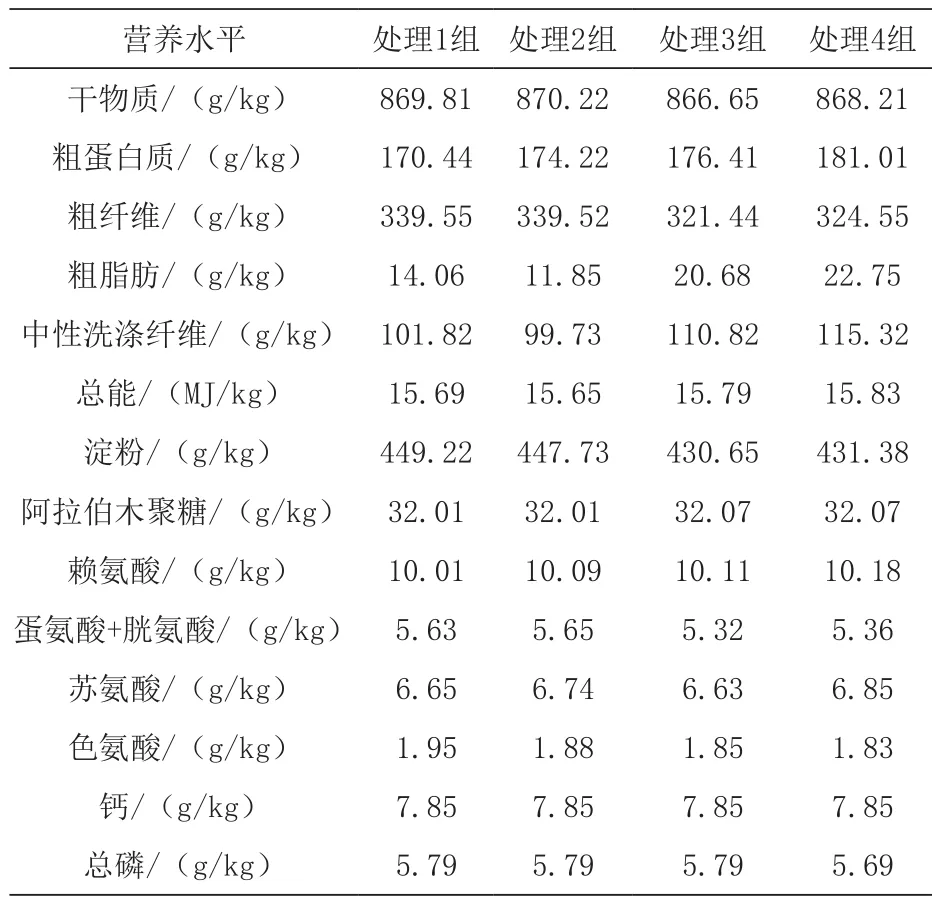
表3 各处理组日粮营养水平(风干基础)
1.5 数据统计与分析 试验数据采用SPSS(18.0版)多因子方差分析进行分析,用Tukey’s多重比较对各处理组均值进行差异显著性检验,以P<0.05作为差异显著判断标准。
2 结果与分析
2.1 小麦日粮添加霉菌吸附剂对育肥猪生长性能的影响 由表1可知,与低品质小麦相比,高品质的小麦具有更高的容重和干物质含量,几种毒素的水平均较低。由表4可知,小麦品质与霉菌吸附剂对生长肥猪日均采食量、日增重和料重比均无显著交互效应(P>0.05)。与低品质小麦组相比,高品质小麦组显著提高了育肥猪平均日采食量(P<0.05)和平均日增重(P<0.05)。饲喂时间对育肥猪平均日采食量和料重比具有显著影响(P < 0.05)。
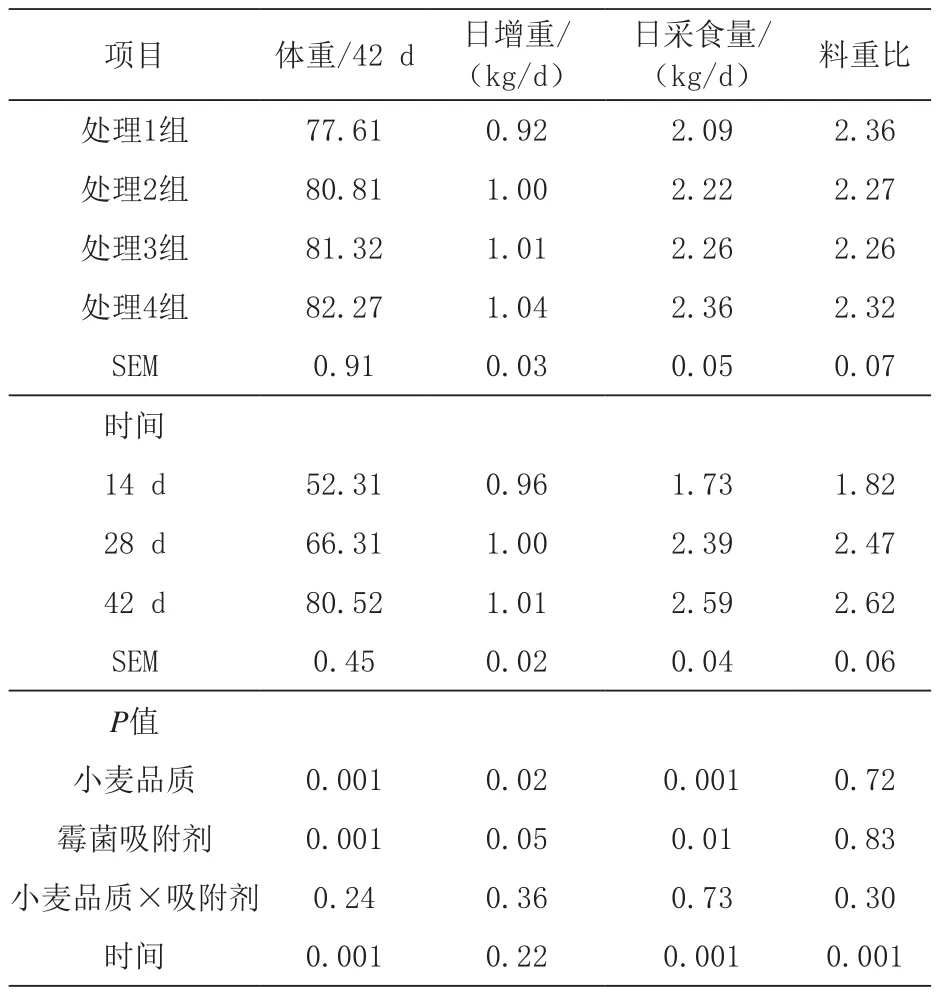
表4 各处理组对生长肥猪生长性能的影响
2.2 小麦日粮添加霉菌吸附剂对育肥猪养分表观消化率的影响 由表5可知,育肥猪饲喂低品质小麦较高品质小麦显著降低了干物质、有机物、氮、总能、净能和消化能的表观消化率(P<0.05),而日粮添加霉菌吸附剂较无霉菌吸附剂日粮显著提高了干物质、有机物、氮、总能、净能和消化能的表观消化率(P<0.05)。

表5 各处理组对生长肥猪养分表观消化率的影响
2.3 小麦日粮添加霉菌吸附剂对育肥猪结肠内容物细菌和挥发性脂肪酸比的影响 由表6可知,小麦品质和霉菌吸附剂对结肠内容物细菌含量的影响无显著交互效应(P>0.05)。饲喂高品质小麦日粮的生长猪较低品质小麦日粮显著降低了结肠内容物大肠杆菌含量(P<0.05),而日粮添加霉菌吸附剂较无霉菌吸附剂日粮显著提高了结肠内容物乳酸杆菌含量(P<0.05)。
2.4 小麦日粮添加霉菌吸附剂对育肥猪肠道相关基因表达的影响 由表7可知,小麦日粮添加霉菌吸附剂显著提高了育肥猪十二指肠GHRL基因mRNA表达水平(P<0.05)。由表8可知,小麦品质和霉菌吸附剂对十二指肠PEPT1和SGLT1基因的mRNA表达水平的影响具有显著交互效应(P<0.05)。与高品质小麦日粮相比,低品质小麦组显著提高了SCL2A1基因mRNA表达水平(P<0.05)。小麦日粮添加霉菌吸附剂显著降低了SCL2A1和SGLT1基因mRNA表达水平(P<0.05)。小麦日粮添加霉菌吸附剂对育肥猪肠道免疫因子和紧密连接蛋白相关基因表达的影响见表9,低品质小麦组较高品质小麦组显著提高了十二指肠和结肠TNF及十二指肠CLDN2基因mRNA表达水平(P<0.05)。
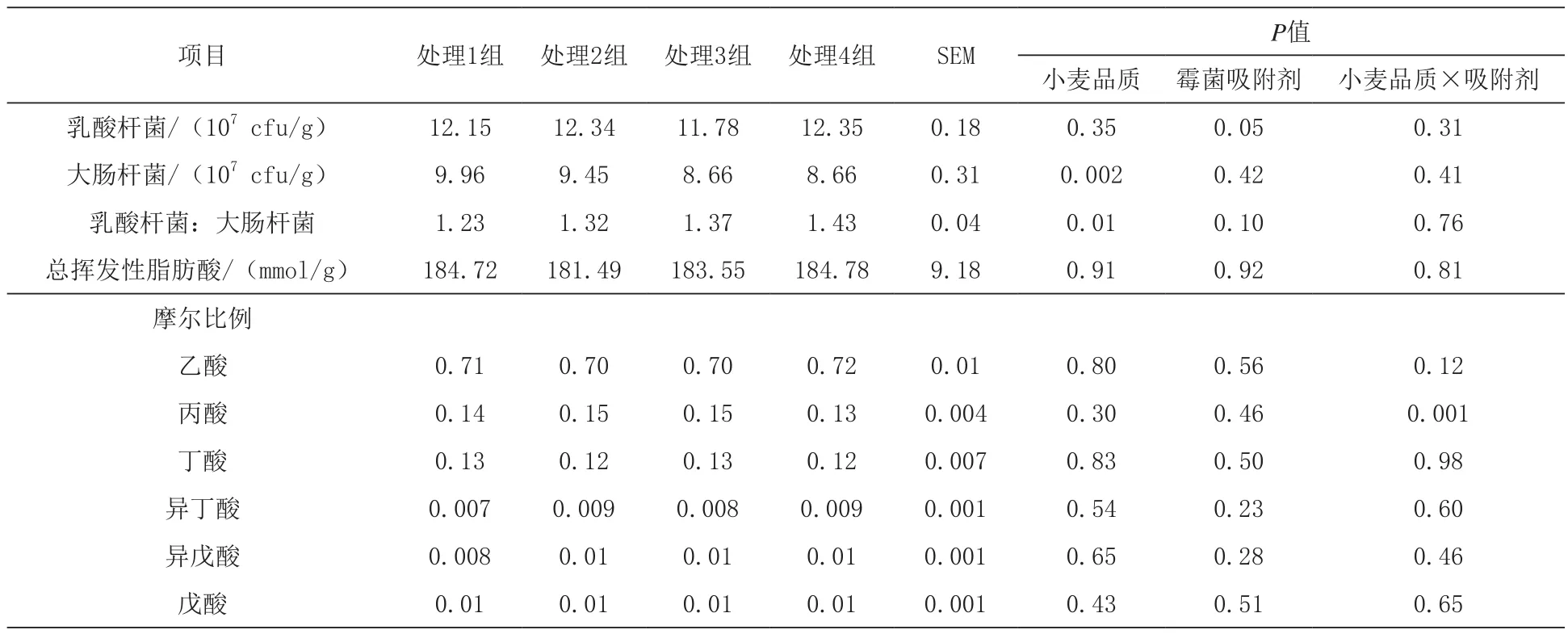
表6 各处理组对生长肥猪结肠内容物细菌和挥发性脂肪酸比例的影响
3 讨论
3.1 不同品质小麦日粮添加霉菌吸附剂对育肥猪生长性能的影响 低品质小麦容重、干物质和粗蛋白质含量均低于高品质小麦。谷物中的高水分会促进霉菌毒素的生长,同时高水分也导致容重降低(Hook,1984)。动物采食后,由于血液循环增强,从而抑制胃肠道GHRL基因的表达,提高采食抑制相关基因的表达(Suzuki,2010)。此外,机体GHRL表达的提高可能与机体需要更多能量来满足代谢有关,日粮添加霉菌吸附剂后提高了日增重,也与肠道养分消化率提高有关(Wren等,2001)。
3.2 不同品质小麦日粮添加霉菌吸附剂对育肥猪养分表观消化率及转运载体基因表达的影响 动物采食含霉菌毒素污染的饲料后,胃肠道是第一个接触高浓度毒素的器官,Bracarense等(2012)研究发现,毒素可以诱导胃肠道形态和组织学变化,使肠绒毛减少、萎缩,从而降低营养物质的吸收率和消化率。在本研究中我们也发现,低品质小麦日粮组中CLDN2表达的提高可能与毒素降低肠屏障功能有关,反过来又导致TNF表达提高(Zeissig等,2007)。日粮添加霉菌毒素吸附剂提高了营养物质的表观消化率,降低了CLDN2 mRNA表达,这说明黄曲霉毒素、呕吐毒素和玉米赤霉烯酮对营养物质消化率具有负面作用。本试验使用的霉菌吸附剂含有丙酸钙和甲酸钙,有机酸可以降低胃肠道pH,从而刺激胃蛋白酶的活性,提高蛋白质利用率;其次,胃肠道低pH,改变小肠隐窝深度与绒毛高度的比例,进而提高养分消化率(Suiryanrayna和Ramana,2015)。Mosenthin等(1992)研究也发现,有机酸可以提高肠道蛋白质和氨基酸的表观消化率。

表7 各处理组对生长肥猪肠道采食调控基因表达的影响

表8 各处理组对生长肥猪肠道营养物质转运载体基因表达的影响

表9 各处理组对生长肥猪肠道免疫因子及紧密连接蛋白基因表达的影响
3.3 不同品质小麦日粮添加霉菌吸附剂对育肥猪结肠内容物细菌和挥发性脂肪酸比的影响Nyachoti等(2006)报道,乳酸杆菌含量可以作为肠道有益菌的指标,而大肠杆菌含量则作为肠道有害菌的指标。本研究发现,低品质小麦日粮组显著提高了结肠大肠杆菌的数量,而添加霉菌吸附剂后,提高了乳酸杆菌的含量,这与霉菌吸附剂中的有机酸成分有关,因为有机酸可以阻断大肠杆菌的粘附,抑制其增殖;同时,促进乳酸杆菌生长,提高乳酸或其代谢产物的生成,降低胃肠道pH(Fuller,1977)。
3.4 不同品质小麦日粮添加霉菌吸附剂对育肥猪肠道相关基因表达的影响 动物采食饲料消化后,关键是确保养分消化和利用;肠细胞通过改变营养物质转运载体的表达,从而对养分的吸收进行调节(Dyer等,2015)。SLC2A1、SLC2A7基因能编码葡萄糖转运载体,提高葡萄糖的吸收效率,PEPT1负责编码氨基酸转运载体,提高氨基酸的吸收效率(Wu 等,2015)。本研究发现,低品质小麦组较低品质小麦添加霉菌吸附剂组提高了十二指肠PEPT1和SGLT1基因表达。然而目前关于霉菌毒素对转运载体的影响报道较少,其具体影响机制还有待进一步研究。但高品质小麦添加霉菌吸附剂对转运载体无显著影响,这与Chen等(2016)研究结果一致。
4 结论
低品质小麦易受霉菌毒素污染,降低生长育肥猪日采食量、日增重及养分消化率,提高十二指肠PEPT1、TNF及CLDN2的表达。低品质小麦日粮添加霉菌吸附剂可以提高营养物质的消化率,达到与高品质小麦日粮类似的结果。
[1]冯定远,吴新连.非常规饲料原料的合理使用[J].广东饲料,2001,10(3):13~ 15.
[2]Binder E,Tan L,Chin L et al. Worldwide occurrence of mycotoxins in commodities,feeds and feed ingredients[J]. Anim Feed Sci Technol,2007,137:265~ 282.
[3]Bracarense A,Lucioli J,Grenier B et al. Chronic ingestion of deoxynivalenol and fumonisin,alone or in interaction,induces morphological and immunological changes in the intestine of piglets[J]. Br J Nutr,2012,107:1776~ 1786.
[4]Chen X,Naehrer K,Applegate T. Interactive effects of dietary protein concentration and aflatoxin B1 on performance,nutrient digestibility,and gut health in broiler chicks[J].Poultr Sci,2016,95 :1312~1325.
[5]Dyer J,Salmon K,Zibrik L et al. Expression of sweet taste receptors of the T1R family in the intestinal tract and enteroendocrine cells[J].Biochem Soc Trans,2005,33:302~ 305.
[6]Fuller R. The importance of lactobacilli in maintaining normal microbial balance in the crop[J]. Br Poultr Sci,1977,18 :85~ 94.
[7]Hook S C. Specific weight and wheat quality[J]. Sci Food Agric,1984,35:1136~1141.
[8]Huang Y,Adams M C. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J]. Int J Food Microbiol,2004,91 :253~ 260.
[9]Landero J L,Beltranena E,Cervantes M et al. The effect of feeding solvent-extracted canola meal on growth performance and diet nutrient digestibility in weaned pigs[J].Anim Feed Sci Technol,2011,170:136~140.
[10]Mosenthin R,Sauer W C,Ahrens F et al. Effect of dietary supplements of propionic acid,siliceous earth or a combination of these on the energy,protein and amino acid digestibilities and concentrations of microbial metabolites in the digestive tract of growing pigs[J].Anim Feed Sci Technol,1992,37 :245 ~ 255.
[11]Nyachoti C,Omogbenigun F,Rademacher M et al. Performance responses and indicators of gastrointestinal health in early-weaned pigs fed low-protein amino acid-supplemented diets[J]. Anim Sci,2006,84:125~ 134.
[12]O’Shea C,Sweeney T,Bahar B et al. Indices of gastrointestinal fermentation and manure emissions of growing-finishing pigs as influenced through singular or combined consumption of and inulin[J]. Anim Sci,2012,90 :3848 ~ 3857.
[13]Pierce K,Sweeney T,Callan J et al. The effect of inclusion of a high lactose supplement in finishing diets on nutrient digestibility,nitrogen excretion,volatile fatty acid concentrations and ammonia emission from boars[J].Anim Feed Sci Technol,2006,125:45 ~ 60.
[14]Richard J L. Some major mycotoxins and their mycotoxicosis-an overview[J].Int J Food Microbiol,2007,119:3 ~ 10.
[15]Suiryanrayna M V,Ramana J. A review of the effects of dietary organic acids fed to swine[J]. Anim Sci Biotechnol,2015,6 :45.
[16]Suzuki K,Simpson K A,Minnion J S et al. The role of gut hormones and the hypothalamus in appetite regulation[J]. Endocr J,2010,57:359~ 372.
[17]Wren A,Seal L,Cohen M et al. Ghrelin enhances appetite and increases food intake in humans[J]. Clin Endocrinol Metab,2001,86:5992.
[18]Wu L,Liao P,He L et al. Growth performance,serum biochemical profile,jejunal morphology,and the expression of nutrients transporter genes in deoxynivalenol(DON)-challenged growing pigs[J].BMC Vet Res,2015,11 :144.
[19]Zeissig S,Bürgel N,Günzel D et al. Changes in expression and distribution of claudin 2,5 and 8 lead to discontinuous tight junctions and barrier dysfunction in active Crohn’s disease[J]. Gut,2007,56 :61~72.

